
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы выражения содержания растворенного вещества в раствореСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Концентрацией раствора называется величина, выражающая относительное содержание растворенного вещества в растворе. Концентрация раствора имеет разные формы выражения: либо безразмерными единицами – долями или процентами, либо величинами размерными. Важнейшие из них следующие. Массовая доля растворенного вещества (ω) показывает, сколько едениц массы растворенного вещества содержится в 100 еденицах массы раствора. Массовая доля – безразмерная величина, ее выражают в долях единицы или процентах:
где ω – массовая доля (%) растворенного вещества; m1 – масса растворенного вещества, г; m – масса раствора, г. Масса раствора равна произведению объема раствора V на его плотность r:
Молярная концентрация (молярность) раствора – показывает, сколько молей растворенного вещества содержится в 1л раствора. Молярную концентрацию (моль на литр) выражают формулой
где m1 – масса растворенного вещества, г; М – молярная масса растворенного вещества, г/моль; V – объем раствора, л. Нормальная концентрация (нормальность раствора) показывает, сколько грамм-эквивалентов растворенного вещества содержится в 1 л раствора (моль на литр): где m1 – масса растворенного вещества, г; Э – молярная масса эквивалента растворенного вещества, г/моль; V – объем раствора, л. Моляльность раствора Сm показывает количество растворенного вещества, находящееся в 1 кг растворителя:
где m2 – масса растворителя, кг; n – количество растворенного вещества, моль. Титр раствора (Т) показывает массу (г) растворенного вещества, содержащегося в 1 мл раствора:
где m1 – масса растворенного вещества, г; V – объем раствора, мл; Сн – нормальность раствора, моль/л; Э – молярная масса эквивалента, г/моль. При выполнении заданий рекомендуется использовать методические указания [7]. Примеры составления условий задач и их решения Задача 554 Вычислить молярность и нормальность 40 %-го раствора фосфорной кислоты, плотность которого 1,25 г/см3. Объем раствора 1л. Решение: Для расчета молярности и нормальности раствора найдем массу фосфорной кислоты в 1 л (1000 мл) 40 %-го раствора: w = m1 · 100/V ∙ r; Молярная масса эквивалента Н3РO4 равна 98/3 = 32,7 г/моль. Тогда СН = 500/32,7 = 1,53 моль/л. Задача 578 Вычислить массовую долю КОН в 2н. растворе, плотность которого 1,08 г/см3. Решение: Поскольку нормальность рассчитывается на 1 л раствора, найдем массу растворенного вещества в 1 л: СН= m1/Э∙V; ЭKOH = 56 г/моль; mКОН=2∙56∙1=112 г. Теперь вычислим массовую доли КОН в растворе, содержащем 112г гидроксида калия: w= m1∙100/V∙r=112∙100/1000∙1,08=10,4 %.
Задача 596 Какой объем 30%-го раствора азотной кислоты, плотность которого 1,18 г/см3, необходимо взять для приготовления 0,5 л 1,0 н. раствора? Решение: Сначала найдем массу азотной кислоты, необходимую для приготовления 0,5 л 1,0 н. раствора:
Вычислим, в каком объеме 30 %-го раствора содержится 31,5 г азотной кислоты:
В задачах 541–568 определить молярность и нормальность следующих растворов. Объем раствора 1 л
В задачах 569–594 определить массовую долю вещества в процентах. Объем раствора 1 л
В задачах 595–619 определить объем концентрированного раствора, необходимый для приготовления определенного объема разбавленного раствора заданной концентрации
При выполнении заданий рекомендуется использовать методические указания [7].
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 686; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.43.106 (0.01 с.) |

 ,
, , тогда
, тогда  .
.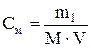 ,
,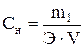 ,
, ,
,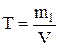 или
или  ,
, . Молярная масса Н3РO4 равна 98 г/моль, следовательно,
. Молярная масса Н3РO4 равна 98 г/моль, следовательно, 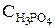 = 500/98 = 5,1 моль/л.
= 500/98 = 5,1 моль/л. ;
;  г/моль;
г/моль;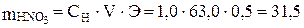 г.
г.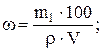
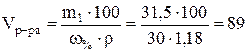 мл.
мл.


