
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В задачах 392–420 определить электродвижущую силу элементов, написать уравнения реакций, за счет которых возникает разность потенциалов. Составить схемы элементовСодержание книги
Поиск на нашем сайте
В задачах 421–445 составить схемы гальванических элементов, в которых протекают приведенные ниже токообразующие реакции. Вычислить э.д.с. элементов. Чему равно DG?
В задачах 446–471 вычислить константы равновесия окислительно-восстановительных реакций, протекающих в гальванических элементах
Электролиз Электролиз представляет собой процесс, в котором окислительно-восстановительные реакции происходят под действием постоянного электрического тока. Химические реакции при электролизе обратны реакциям в гальванических элементах. При электролизе растворов солей необходимо помнить правила: 1. Катионы металлов, имеющих малую величину стандартного электродного потенциала (от Li+ до AI3+ включительно), не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды: 2H2O +2e ® H2 + 2OH–. 2. Катионы металлов, имеющих стандартный электродный потенциал меньший, чем у водорода, но больший, чем у алюминия (от AI до H2) при электролизе восстанавливаются одновременно с молекулами воды. Причиной этого явления служит более высокая концентрация катионов металла в растворах по сравнению с ионами водорода ( 3. Катионы металлов, имеющих стандартный электродный потенциал больший, чем у водорода (от Sb3+ + до Аu+), при электролизе практически полностью восстанавливаются на катоде. 4. На нерастворимом аноде в процессе электролиза происходит окисление анионов или молекул воды. При этом анионы бескислородных кислот (S2-, I-,Вг-, С1-) при их достаточной концентрации легко окисляются. Если же раствор содержит анионы кислородных кислот (например, SO42–, NO3–, СО3 2–, PO43–), то на аноде окисляются не эти ионы, а молекулы воды: 2H2O + 4e ® O2 + 4H+. 5. Растворимый анод сам подвергается окислению (растворению), т.е. поcылает электроны во внешнюю цепь. При отдаче электронов смещается равновесие между электродом и раствором: Me ↔ Men+ + ne. металл уходят уходят во анода в раствор внешнюю цепь Примеры составления условий задач и их решения Задача 472 Разобрать процессы, протекающие у электродов при электролизе водных растворов: Na2SO4, Cd(NO3)2, KBr, CuCl2; для каждого из них составить общее уравнение реакции. Решение: Вода может быть как окислителем, так и восстановителем, поэтому при электролизе водных растворов у электродов могут восстанавливаться и окислиться не ионы электролита, а вода. Это зависит от сравнительной величины окислительно-восстановительных потенциалов воды и ионов электролита. I. Электролиз водного раствора Na2SO4. Стандартный электродный потенциал системы
значительно отрицательнее потенциала водородного электрода в нейтральной водной среде
Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода: 2H2O +2e ® H2↑ + 2OH–, а ионы Na+, приходящие к катоду, будут накапливаться в прилегающей к нему части раствора (катодное пространство). На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода: 2H2O – 4e → O2 + 4H+; поскольку отвечающий этой системе стандартный электродный потенциал значительно ниже, чем стандартный электродный потенциал, характеризующий систему: 2SO42– – 2e = S2O82–, Ионы SO42–, движущиеся при электролизе к аноду, будут накапливаться в анодном пространстве. Умножая уравнение катодного процесса на два и складывая его с уравнением анодного процесса, получаем суммарное уравнение процесса электролиза: 6H2O ↔ 2H2↑ + 4OH– + O2↑ + 4H+. у катода у анода Приняв во внимание, что одновременно происходит накопление ионов Na+ в катодном пространстве и ионов SO42– в анодном пространстве, суммарное уравнение процесса можно записать в следующей форме: 2Na2SO4 + 6H2O ↔ 2H2↑ + 4NaOH + O2↑ + 2H2SO4. у катода у анода Таким образом, одновременно с выделением водорода и кислорода образуется гидроксид натрия (в катодном пространстве) и серная кислота (в анодном пространстве). В случае, когда растворы катодного и анодного пространств перемешиваются, образующиеся в результате электролиза щелочь и кислота нейтрализуются и дают вновь соль (Na2SO4): 4NaOH + 2H2SO4 = 2NaSO4 + 4 H2O. В итоге электролиз сводится к электрохимическому разложению воды:
2. Электролиз водного раствора Cd(NO3)2. Решение: При электролизе водных растворов солей цинка, железа, кадмия и некоторых других металлов, стоящих в ряду напряжения, хотя и левее водорода, но близко к нему, на катоде выделяются эти металлы. Объясняется это тем, что процесс разрядки ионов Н+ осложняется адсорбцией атомов и молекул водорода на поверхности электродов. Для того чтобы десорбировать водород и получить его в газообразном состоянии, необходимо приложить избыточную э.д.с. Увеличение э.д.с. приводит к тому, что на катоде происходит выделение металла, стоящего в ряду напряжения левее водорода: Cd2+ + 2e ↔ Cd, Нитрат-ионы скапливаются вблизи анода, но окислению легче подвергается вода: 2H2O – 4e → O2 + 4H+, В целом процесс выражается уравнением 2Cd(NO3)2 + 2H2O ↔ 2Cd + O2↑ + 4HNO3. у катода у анода При электролезе солей, состоящих из ионов малоактивных металлов (стоящих в ряду напряжения после водорода) и кислородсодержащих анионов, также набдюдается выделение металла на катоде. На аноде выделяется кислород в результате окисления воды с изменением pH среды за счет вторичного процесса – образования кислоты. 3. Электролиз водного раствора КВr. Решение: Ионы калия обладают меньшей окислительной способностью, чем вода. Поэтому на катоде происходит восстановление воды, а на аноде – окисление брома, которые обладают большей восстановительной способностью, чем вода. катод K+, HOH; 2H2O + 2e → H2 + 2OH– в-е, о-ль PH > 7 анод Br–, HOH; 2Br– – 2e = Br2 о-е, в-ль
катионы активного металла калия, которые не восстанавливаются на катоде, накап- ливаются в прикатодном пространстве. В целом процесс выражается уравнением
4. Электролиз водного раствора СuCl2. Решение: В растворе хлорид меди (II) диссоциирует на ионы: CuCl2 «Cu2+ + 2Cl– Значение стандартного электродного потенциала меди (0,34 В) положительно, следовательно, ионы меди(II) будут легко восстанавливаться в водных растворах: катод (-) Сu2+ + 2e ® Сu. Хлорид -анионы, как и многие анионы бескислородных кислот, окисляются в водных растворах: анод (+) 2 СI– -2e® С12 Суммарное уравнение процесса:
1 Cu2+ + 2е ® Cu в-е, о-ль;
Задача 503 Вычислить массу серебра, выделившуюся на катоде при пропускании тока силой 6А через раствор нитрата серебра в течение 30 мин. Решение: Соотношения между количеством прошедшего электричества и количеством вещества, выделившегося при электролизе, были открыты английским физиком М. Фарадеем в 30-х годах XIX века. Первый закон. Количества веществ, превращенных при электролизе, пропорциональны количеству электричества, прошедшего через электролит. Второй закон. При прохождении одного и того же количества электричества через различные электролиты количества различных веществ, испытывающие превращение у электродов, пропорциональны химическим эквивалентам этих веществ. Для выделения или превращения с помощью тока 1г-экв любого вещества необходимо всегда одно и то же количество электричества, называемое числом Фарадея. Выразим законы Фарадея общим уравнением:
где m – масса продукта электролиза, г; I – сила тока, А; t – время, с; F – число Фарадея – 96500 к/г-экв; Э – химический эквивалент, г/г-экв. Вычисляем массу, выделившуюся на катоде, серебра:
Задача 509 Найти объем кислорода (условия нормальные), который выделится при пропускании тока силой 6А в течение 30 мин через водный раствор KOH. Решение: При вычислении объемов выделившихся газов представим уравнение Фарадея в следующей форме:
где V – объем выделившегося газа, л; Vэ – его эквивалентный объем, л/моль. Поскольку при нормальных условиях эквивалентный объем водорода равен 11,2 л/моль, а кислорода - 5,6 л/моль, то получим
Задача 515 При электролизе водного раствора АgNO3 с нерастворимым анодом в течение 50 мин при силе тока в 3,0 А на катоде выделилось 9,6 г серебра. Вычислить выход по току. Решение: При практическом проведении электролиза действительный расход тока, вследствие протекания тех или иных побочных процессов, обычно превышает количество его, рассчитанное согласно закону Фарадея. Поэтому на практике часто приходится иметь дело с коэффициентом использования тока, или с так называемым выходом по току (η – эта). Выходом по току называется отношение количества практически выделенного при электролизе вещества к тому количеству его, которое должно было бы выделиться согласно закону Фарадея. Выход по току находим как Отсюда Задача 532 Сколько времени нужно пропускать ток силой 2,0 А через раствор сульфата никеля, чтобы покрыть металлическую пластинку 200 см2 слоем никеля, толщиной 0,01 мм, если плотность никеля 8,9 г/см3. Выход по току составляет 90 %. Решение: Объем покрытия V=S×h = 200× 0,001= 0.2 см3 Масса будет равна mфакт = V × r = 0,2 × 8,9 = 1,78 г. Эквивалентная масса никеля Э = 29,345 г/моль. Решая уравнение
Итак, при практическом осуществлении электролиза часто наблюдаются кажущиеся отклонения от закона Фарадея. Чаще всего они проявляются при катодном восстановлении электроотрицательных металлов, когда часть электрического тока расходуется на разряд ионов водорода. Законы электролиза относятся к электролизу растворов, расплавов и твердых электролитов с чисто ионной проводимостью.
Задача 533 Определить толщину слоя металла – Pt (в миллиметрах), нанесенного на другой металл гальваническим методом. Исходный электролит H2[PtCl6]. Площадь поверхности металлической пластинки 250 см2, плотность пластины 21,47 г/см2. Время электролиза 45 мин, ток силой 0,2 А, выход по току составляет 90%. Решение: Зная выход по току, определяем количество выделенного при электролизе вещества:
Тогда объем покрытия:
При выполнении задания рекомендуется использовать методические указания [6].
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 359; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.68.228 (0.008 с.) |

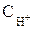 = 10–7моль/л), а также явление перенапряжения.
= 10–7моль/л), а также явление перенапряжения.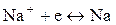
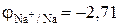 В
В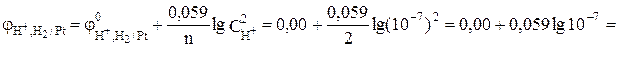
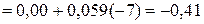 В.
В.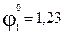 В,
В,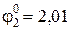 В.
В.
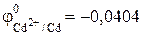 В.
В.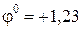 В.
В.

 1 2 Cl– – 2e ® Cl2 o-e, в-ль;
1 2 Cl– – 2e ® Cl2 o-e, в-ль; 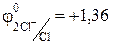 В
В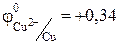 В
В
 ,
,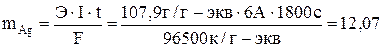 г.
г.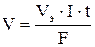 ,
,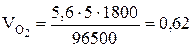 л.
л. ,
, 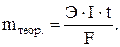
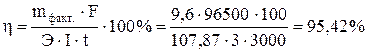 .
.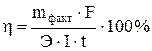 относительно t и подставляя в него числовые значения, находим
относительно t и подставляя в него числовые значения, находим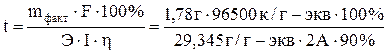 = 3251 с = 54,19 мин.
= 3251 с = 54,19 мин. г.
г.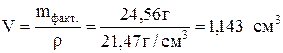 и толщина слоя:
и толщина слоя: 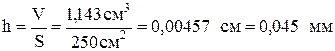 .
.


