
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В задачах 285–300 определить константу равновесия обратимых химических реакций при заданной температуре и указать, как будет смещаться равновесие при повышении температуры или давленияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
В задачах 301–314 вычислить константу равновесия химической реакции и определить начальные концентрации вступивших в реакцию веществ
В задачах 315–319 определить, энергию активации химической реакции по следующим данным:
В задачах 320–324 определить, во сколько раз возрастет скорость химической реакции, если температура повысилась на 100 oС
В задачах 325–329 определить, во сколько раз возрастает скорость химической реакции при применении катализатора по сравнению со скоростью реакции, идущей без катализатора. Реакция идет при температуре 1000 К
ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
Окислительно-восстановительные реакции Окислительно-восстановительными реакциями называются реакции, сопровождающиеся переходом электронов от одних атомов или ионов к другим. Теория окислительно-восстановительных процессов основана на следующих понятиях: - окисление (о-е) – процесс отдачи электронов атомом, молекулой или ионом. При окислении степень окисления увеличивается. Например: Са – 2е → Са2+; Н2 – 2е → 2Н+; Sn+2 – 2e → Sn+2; - восстановление (в-е) – процесс присоединения электронов атомом, молекулой или ионом. Например: Se + 2e → Se2–; Br2 + 2e → 2Br–; Sn+4 + 2e → Sn+2. При восстановлении степень окисления уменьшается. Вещества, отдающие электроны, называются восстановителями. Вещества, присоединяющие электроны называются окислителями. Окислительно-восстановительные реакции являются сопряженными. Окисление невозможно без одновременно протекающего с ним восстановления и наоборот. Известно, что правильно составленное уравнение химической реакции является выражением законов сохранения массы и энергии. Чтобы законы сохранения соблюдались, химические реакции необходимо уравнивать. Существует несколько способов достижения искомой цели. Ионно-электронный метод Этот метод применим только для окислительно-восстановительных реакций, протекающих в растворах электролитов. В методе ионо-электронных полуреакций коэффициенты окислительно-восстановительной реакции определяют с учетом конкретной формы ионов, участвующих во взаимодействии. Преимущество метода состоит в том, что нет необходимости пользоваться формальным представлением о степени окисления; применяются реально существующие ионы. Кроме того, этот метод позволяет учесть влияние реакции среды на характер окислительно-восстановительного процесса. При составлении ионно-электронных полуреакций необходимо использовать правила стяжения и два вывода, вытекающих из них. 1. Если продукт реакции содержит больше кислорода, чем исходное вещество, то расходуется либо вода – в нейтральных и кислых растворах, либо ионы ОН– – в щелочных растворах (р.окисления).
Например: SO32–+ Н2О – 2е ® SO42– + 2H+. Продукт реакции SO42– содержит больше кислорода, чем исходное вещество SO32–. Следовательно, в нейтральной и кислой среде недостающий кислород берется из воды: Н2О ® О2– + 2H+.
В полуреакции: СrO2– + 4OH–® СrO42– + Н2О недостающий кислород берется из гидроксид ионов, учитывая правило стяжения в щелочной среде: 2OH–® О2– + Н2О. 2. Если продукт реакции содержит меньше кислорода, чем исходное Например: Сr2O72– + 14 H+ + 6е ® 2 Сr3– + 7 H2O. Избыточный кислород в кислой среде образует с ионами водорода воду: О2– + 2Н+ ® Н2O. MnO4– + 2 H2O + 3e ® MnО2 + 4 ОН–. Избыточный кислород в нейтральной и щелочной среде стягивается с молекулами воды с образованием гидроксид-ионов: О2– + Н2O ® 2OH–. Примеры составления условий задач и их решения Задача 335 Определить восстановитель и окислитель, расставить коэффициенты, пользуясь методом электронно-ионных полуреакций в следующих окислительно-восстановительных реакциях: 1. Na2SO3 + КМnО4 + H2O ® Na2SO4 + МnО2 + КОH 2. NaCrO2 + H2O2 + KOH ® Na2CrO4 + K2CrO4 + H2O 3. Mn(NO3)2 + РbO2 + HN03 ® HMnO4 + РЬ(N03)2 + H2O. Решение: 1. В молекулярной схеме реакции определяем изменение степени окисления, находим окислитель и восстановитель:
в-ль о-ль среда Составляем электронно-ионные полуреакции сначала для процесса окисления, а затем для процесса восстановления, учитывая закон сохранения массы и заряда и правила стяжения:
2 МnО4– + 2H2O + 3е ® МnO2 + 4OH- в-е, о-ль
Умножаем на полученные множители обе полуреакции и суммируем: 3 SO32– + 2 МnО4– + 7 H2O ® 3 SO42– + 2 МnO2 + 8 OH– + 6 Н+. После преобразования ионное уравнение реакции будет иметь следующий вид: 3 SO32– + 2 МnО4– + H2O → 3 SO42– + 2 МnO2 + 2 OH–. В молекулярной форме это уравнение запишется следующим образом: 3 Na2SO4 + 2 КМnО4 + H2O = 3 Na2SO4 + 2 МnО2 + 2 КОH.
2.
3 H2O2 + 2e ® 2 OH– в-е, о-ль
Для перехода CrO2– в ион CrO42– необходим кислород, который в щелочной среде выделяется из гидроксид-ионов (2ОН– → О2– + Н2О). Восстановление H2O2 в щелочной среде идет с образованием ионов OH–. Умножаем на полученные множители обе полуреакции и суммируем: 2CrO2– + 3H2O2 + 8OH– ® 2CrO42– + 4H2O + 6OH–. После преобразования ионное уравнение реакции следующее: 2 CrO2– + 3 H2O2 + 2 OH– → 2 CrO42– + 4 H2O. На основе ионного уравнения запишем уравнение реакции в молекулярной форме: 2 NaCrO2 + 3 H2O2 + 2 KOH ® Na2CrO4 + K2CrO4 + 4 H2O. 3.
2 Mn+2 + 4 H2O – 5е ® MnO4– + 8 Н+ o-e, в-ль 5 РbO2 + 4 Н+ + 3е ® Рb2+ + 2 H2O в-е, о-ль
После преобразования ионное уравнение реакции будет иметь вид: 2 Mn+2 + 5 РbO2 + 4 Н+ = 2 MnO4– + 5 Рb2+ + 2 H2O. 2 Mn(NO3)2 + 5 РbO2 + 6 HNO3 = 2 HMnO4 + 5 Рb(NO3)2 + 2H2O. В рассмотренных реакциях взаимодействуют вещества, одно из которых служит окислителем, а другое - восстановителем, третье - средой. Такие реакции относятся к реакциям межмолекулярного окисления-восстановления. Реакция 330(1) служит примером реакций самоокисления - самовосстановления (диспропорционирования), в которых функции окислителя и восстановителя выполняет один и тот же элемент. В реакции 330(2) оба элемента (восстановитель и окислитель) входят в состав одного и того же исходного вещества. Реакции такого типа называются реакциями внутримолекулярного окисления-восстановления. При выполнении задания рекомендуется использовать методические указания [4].
В задачах 330–391 определить восстановитель и окислитель, расставить коэффициенты, пользуясь методам электронно-ионных или электронных полуреакций
Гальванические элементы Гальваническими элементами называются устройства, с помощью которых химическая энергия окислительно-восстановительных процессов может быть преобразована в электрическую. В основе работы гальванических элементов лежат явления, происходящие на границе между металлом и раствором электролита и сопровождающиеся возникновением на ней разности или скачка потенциалов.
Разности или скачки потенциалов на границе металл-раствор зависят от активности катионов металла в растворе или, другими словами, каждой данной активности катионов металла в растворе соответствует определенное значение равновесного скачка потенциалов. Они называются электродными потенциалами, а их значения определяются относительно стандартного водородного электрода, принятого в качестве эталона, потенциал которого, называемый стандартным или нормальным, условно принимается равным нулю. Всякий гальванический элемент состоит из двух электродов – металлов, погруженных в растворы электролитов; последние сообщаются друг с другом – обычно через пористую перегородку. Электрод, на котором в ходе реакции происходит процесс окисления, называется анодом; электрод, на котором осуществляется восстановление, – катодом. При схематическом изображении гальванического элемента граница раздела между металлом и раствором обозначается вертикальной чертой, граница между растворами электролитов – двойной вертикальной чертой: Zn|Zn(NO3)2 ||AgNO3|Ag. Максимальное напряжение гальванического элемента, отвечающее обратимому протеканию происходящей в нем реакции, называется электродвижущей силой Е (э.д.с.) элемента. Если реакция осуществляется в стандартных условиях, т.е., если все вещества, участвующие в реакции, находятся в своих стандартных состояниях, то наблюдаемая при этом э.д.с. называется стандартной электродвижущей силой Ео данного элемента. Э.д.с. гальванического элемента может быть представлена как разность двух электродных потенциалов φ, каждый из которых отвечает полуреакции, протекающей на одном из электродов: Е = φAg – φZn. Здесь φAg и φZn – потенциалы, отвечающие электродным процессам, происходящим соответственно на серебряном и цинковом электродах.
Примеры составления условий задач и их решения Задача 399 Составить схему, написать уравнения электродных процессов и рассчитать э.д.с. элемента, состоящего из цинковой и никелевой пластин, опущенных в растворы сернокислых солей с концентрацией Решение: В ряду напряжений Zn стоит левее Ni, поэтому в гальваническом элементе отрицательным (анодом) будет цинковый электрод, а положительным (катодом) - никелевый. Схема гальванического элемента (-) Zn½ZnSO4½½NiSO4½Ni (+). При работе элемента протекают реакции: на аноде Zn ® Zn2+ + 2e, на катоде Ni2+ + 2e ® Ni.
Электродные потенциалы необходимо вычислить по уравнению Нернста:
Отсюда Е = -0,309 - (-0,819) = 0,51 В.
С учетом того, что число электронов, переносимых во время электрохимической реакции металлами, одинаково и концентрации растворов равны, уравнение упрощается и принимает вид
Гальванический элемент может быть составлен не только из различных, но и из одинаковых электродов, погруженных в растворы одного и того же электролита, различающиеся только концентрацией (концентрационные гальванические элементы). Э.д.с. такого элемента также равна разности потенциалов составляющих его электродов. Электрод, погруженный в более концентрированный раствор, положителен по отношению к другому, который погружен в более разбавленный раствор.
Задача 406 Вычислить электродвижущую силу концентрационного элемента: Cu½CuCrO4 (C1=0,01 моль/л) ½½ CuCrO4 (C2=0,1 моль/л)½Cu. Решение: Рассчитаем э.д.с. по уравнению
Элемент будет действовать до тех пор, пока не выравнится концентрация ионов у обоих электродов. Задача 423 Составить схему гальванического элемента, в котором протекает токообразующая реакция: Cd + CuSO4 (C=1 моль/л) ® CdSO4 (C=1 моль/л) + Cu. Вычислить э.д.с. элемента и энергию Гиббса DG. Решение: По ряду напряжения находим:
Реакция окисления должна протекать на аноде, а реакция восстановления – на катоде, значит, элемент запишем в виде (-) Cd½CdSO4½½CuSO4½Cu (+).
Изменение энергии Гиббса вычислим по уравнению DG = nFE0, где n -число электронов, принимающих участие в электрохимической реакции, F – число Фарадея (96 500 Кл или 96 500 Дж/В×моль). DG = -2×96500×0,74 = -142,820 кДж/моль. Таким образом, для любого электрохимического элемента, работающего самопроизвольно, Е должна быть положительной, а DG, соответственно, отрицательной.
Задача 449 Исходя из величин стандартных электродных потенциалов рассчитать константу равновесия реакции, протекающей в гальваническом элементе: Cu + 2AgNO3 ® Cu(NO3)2 + 2Ag. Решение: По ряду напряжений находим, (-) Cu½Cu2+ ½½Ag+½Ag (+).
Между константой равновесия реакции, протекающей в гальваническом элементе, и э.д.с. элемента существует зависимость
Вычислим константу равновесия реакции:
Сопоставляя электродные потенциалы, можно заранее определить направление, в котором будет протекать окислительно-восстановительная реакция. Поскольку
то окислителем будет служить ион серебра, а восстановителем – медь: рассматриваемая реакция будет протекать слева направо. По величине константы равновесия (К=3,8 ×1015) судим о сдвиге равновесия реакции в сторону продуктов реакции. Число 1015 означает, что равновесие в данной системе наступит тогда, когда произведение концентрации ионов исходных продуктов будет в 1015 раз меньше произведения концентраций ионов конечных продуктов. Задача 420 Определить э.д.с. элемента, у которого электродами являются две платиновые пластинки, опущенные в растворы SnCl2 и FeCl3. Составить схему гальванического элемента. Решение: В этом элементе по проводнику, соединяющему электроды, будет идти электрический ток в результате окислительно-восстановительной реакции: SnCl2 + 2FeCl3 ® SnCl4 + 2FeCl2. В подобных гальванических элементах электроды (Рt) не участвуют во взаимодействии, а являются лишь переносчиками электронов. Схему элемента для приведенной выше реакции можно представить следующим образом: (-) Pt, Sn2+ ½Sn4+ ½½Fe3+ ½Fe2+ , Pt(+). На аноде Sn2+ -2e ® Sn4+ j01= + 0,15В. На катоде Fe3+ +e ® Fe2+ j02= + 0,771 В. Sn2+ + 2Fe3+ ® Sn4+ + 2Fe2+. Исходные и полученные в результате реакции ионы олова образуют окислительно-восстановительную пару Sn2+/Sn4+, которая является одним из полуэлементов. Вторым полуэлементом является окислительно-восстановительная пара Fe3+/Fe2+. Разность потенциалов на границе между инертным электродом и раствором, содержащим окисленную и восстановленную формы вещества, называют окислительно-восстановительным потенциалом:
При выполнений заданий рекомендуется использовать методические указания [5]. Стандартные значения электродных потенциалов найти в табл. 4 приложения.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 473; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.245.181 (0.011 с.) |

 , кДж/моль
, кДж/моль

 3 SO32– + H2O – 2e ® SO42– + 2Н+ o-e, в-ль
3 SO32– + H2O – 2e ® SO42– + 2Н+ o-e, в-ль .
. 2 CrO2– + 4OH– – 3e ® CrO42– + H2O о-е; в-ль
2 CrO2– + 4OH– – 3e ® CrO42– + H2O о-е; в-ль .
.
 = 0,01 моль/л.
= 0,01 моль/л.
 .
. .
. .
. ;
;  ;
; .
. .
. ;
;  .
. .
. ,а
,а  . Отсюда следует, что медный электрод будет отрицательным, т.е. анодом:
. Отсюда следует, что медный электрод будет отрицательным, т.е. анодом: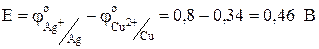
 , откуда
, откуда  .
. K = 3,8∙1015.
K = 3,8∙1015. ,
, .
.


