
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В задачах 620–634 вычислить осмотическое давление водных растворов неэлектролитовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
В задачах 635–648 вычислить молярную массу растворенного вещества по следующим данным:
(1мм рт. ст. = 133,3 Па; 1атм. = 1,01325∙105 Па = 101,325 КПа)
В задачах 649–661 вычислить температуру замерзания и кипения растворов
В задачах 662–677 вычислить молярную массу растворенного вещества по понижению температуры замерзания растворов
В задачах 678–693 вычислить молярную массу растворенного вещества по повышению температуры кипения растворов
Растворы электролитов При растворении электролита в воде увеличивается общее число частиц, т. к. электролиты диссоциируют на ионы и наблюдается отклонение от законов Вант-Гоффа и Рауля. Это отклонение характеризуется изотоническим коэффициентом i, который показывает, во сколько раз осмотическое давление росм, повышение температуры кипения Dtкип, понижение температуры замерзания Dt’зам электролита, найденные экспериментально, больше соответствующих значений (Pосм, Dtкип, Dt’зам)для растворов неэлектролитов при той же молярной концентрации или моляльности. Значение изотонического коэффициента для растворов электролитов больше 1, для растворов неэлектролитов равно 1. Осмотическое давление для растворов электролитов с учетом изотонического коэффициента Pосм = i×n×R×T/V=i×T×R × СМ. 2-й закон Рауля для растворов сильных электролитов выражается уравнениями Dtкип= i×m1×Кэ×1000/М×m2 и Dtзам= i×m1×Кк×1000/М×m2. Изменение общего числа частиц в растворах электролитов характеризуется степенью электролитической диссоциации a. Степень диссоциации и изотонический коэффициент электролита связаны между собой соотношением a = i –1 / k-1, где k – число ионов, образующихся при диссоциации молекулы вещества. В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты, диссоциированные на 30 % и больше, обычно называют сильными, диссоциированные в пределах от 30 до 3 % – электролитами средней силы, еще менее диссоциированные – слабыми электролитами. Согласно новой электростатической теории электролитов, сильные электролиты в разбавленных растворах нацело диссоциированы на ионы, т.е. степень диссоциации a = 1. Однако степень диссоциации определяется экспериментально и оказывается, как правило, меньше единицы (a < 1). Объясняется это тем, что измеряется всегда не истинная, а кажущаяся степень диссоциации. Так, если a = 0,7, то все молекулы диссоциированы на ионы, но ионы свободны лишь на 70 %, остальные 30 % ионов «связаны» электростатическими взаимодействиями. Слабые электролиты диссоциируют в растворах не полностью. В их растворах устанавливается равновесие между недиссоциированными молекула и продуктами их диссоциации - ионами. Степенью диссоциации a электролита называется доля его молекул, подвергшихся диссоциации, т.е. отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул электролита:
где n –число молекул, распавшихся на ионы; N – общее число растворенных молекул. В случае электролита АХ устанавливается равновесие
константа которого (константа диссоциации) определяется соотношением
Для бинарного электролита АХ константа и степень диссоциации связаны соотношением (закон разбавления Оствальда): Кд = СМ × a2/1-a, где См – молярная концентрация электролита, моль/л. Так как для слабых электролитов степень диссоциации значительно меньше единицы, то для приближенных расчетов можно принять 1 - a» 1. Тогда выражение закона Оствальда упрощается: Кд = СМ × a2, откуда
Если в растворе электролита АХ степень его диссоциации равна a, то концентрации ионов А+ и Подставив значение a из выражения закона разбавления, находим [А+] = [ Задача 697 Раствор, содержащий 2,1 г гидроксида калия в 250 г воды, кристаллизуется при 0,52 °С. Определить кажущуюся степень диссоциации КОН ( Решение: Находим понижение температуры замерзания раствора без учета диссоциации электролита (∆tзам. выч.): Dtзам. выч. = m1×Кк×1000/М×m2 = 1,86×2,1×1000/56×250 = 0,28 °С. Вычисляем изотонический коэффициент:
Находим кажущуюся степень диссоциации: КОН = К + + ОН– (k = 2), a = i-1/k-1 = 1,86-1/2-1 = 0,86 или 86 %. Задача 711 Кажущаяся степень диссоциации карбоната натрия в растворе, содержащем 1,06 г Nа2СО3 в 200 г H2O, равна 0,70. Определить температуру замерзания этого раствора ( Решение: Находим изотонический коэффициент i из формулы a = i-1/k-1, i = 1+a(k-1). Na2CO3 = 2 Na++ СО32– (k = 3, a = 0,70 в долях единицы, i=1 + 0,7× (3-1) = 2,4
Вычисляем понижение температуры замерзания раствора
Dtзам р-ра= Dtзам воды - Dtзам=0-0,22=-0,22°С. Задача 722 Раствор, содержащий 10 г хлорида натрия в 100 г воды, кипит при температуре 101,6 oC. Определить кажущуюся степень диссоциации NaCl ( Решение: Находим повышение температуры кипения раствора без учета диссоциации электролита (∆tкип. выч.):
tкип. р-ра = tкип. р-теля + ∆tкип; ∆tкип. эксп = 101,6o – 100o = 1,6o.
Вычисляем изотонический коэффициент:
Находим кажущуюся степень диссоциации: NaCl = Na+ + Cl– (k = 2)
Задача 738 Найти степень диссоциации и концентрацию ионов Н+ сероводородной кислоты по первой ступени в 0,1М растворе, если константа диссоциации для этой ступени равна 1,1×10-7. Решение: Сероводородная кислота очень слабая, диссоциирует по уравнению H2S = Н+ + HS–. Используя упрощенное выражение закона разбавления Оствальда, вычисляем степень диссоциации:
a = 1,05×10-3×100 = 0,105 %.
Концентрация ионов [Н+] = См × a = 0,1×1,05×10–3 = 1,05×10–4 моль/л.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 601; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.012 с.) |

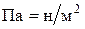 .
. ,
, ,
, .
.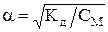 .
. в растворе одинаковы и могут быть найдены по формуле [А+] = [Х-] = a × СМ.
в растворе одинаковы и могут быть найдены по формуле [А+] = [Х-] = a × СМ. .
. = 1,86).
= 1,86).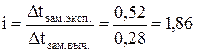 .
. = 106 г/моль),
= 106 г/моль),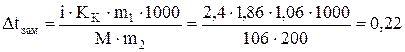 ,
, = 0,516°).
= 0,516°). oC,
oC, .
. или 82 %.
или 82 %. ;
;


