
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Газовые законы. Простейшие стехиометрическиеСодержание книги
Поиск на нашем сайте ЗАКОНЫ Взаимозависимые параметры состояния газов Если энергия притяжения между молекулами меньше их кинетической энергии, то совокупность таких молекул будет существовать в виде газа. Индивидуальное вещество в газообразном состоянии характеризуется следующими величинами: Р – давлением; Т или t – температурой, измеряемой в Кельвина или градусах Цельсия; J - объемом, m – массой всего газа; М – грамм-молекулярной массой. Газовые законы устанавливают взаимосвязь между этими величинами. Вначале были установлены законы, справедливые для постоянной массы данного газа (т.е. m = const и М = const), и, кроме того, одна из оставшихся величин (Р, J, Т) также поддерживается постоянной. 1. Т = const (изотермический процесс). Взаимосвязь между изменением Р и J выражается законом Бойля-Мариотта: Р1J1 = Р2J2 или РJ = const. 2. Р = const (изобарический процесс). Взаимосвязь между изменением J и t выражается законом Гей-Люссака: Jt = Jo (1 + at), где a – коэффициент удельного объемного расширения, равный для всех газов a = 1/273 град-1. Если это значение подставить в уравнение и температуру выразить в шкале Кельвина, то закон Гей-Люссака запишется так:
3. J = const (изохорический процесс). Взаимосвязь между Р и t выражается законом Шарля: Рt = Po (1 + at) где a = 1/273 град-1. В более удобной форме можно записать так:
На основе трех частных законов можно вывести объединенный газовый закон:
После того как было установлено экспериментально, что грамм-молекула любого газа при нормальных условиях (Р = 1 атм = 1,013×105 н/м2 = 101325 Па; t = 0 оС или Т = 273 К) занимает объем – 22,4 л (кг – молекула – 22,4×10-3 м3), объединенный газовый закон можно записать так: PJ = RT, где R - универсальная газовая постоянная. Численное значение R зависит от единиц измерения величин, ее определяющих: R = 62360 мм.рт.ст./К×моль = 0,082 л×атм/К×моль = 8,314 Па×м3/К×моль = = 8,314 Дж/К×моль = 8,414×103 кДж/К×моль = 1,987 кал/к×моль. Уравнение PJ = nRT, где n = m/M, называется уравнением Менделеева-Клапейрона, оно выражает взаимосвязь между всеми величинами, характеризующими газ, а поэтому является наиболее общим в приближении к модели идеального газа. Примеры составления условий задач и их решения Задача 139 Определить, какое давление разовьет газ СО2 (0,1 кг) в баллоне емкостью 10 л при температуре 300 К. Решение: Данные задачи выразим в единицах Си (m = 0,1 кг; J = 10 л = 10×10-3м3; Т = 300 К; М = 44,01×10-3 кг/моль) и подставим их в уравнение Менделеева-Клапейрона
Чтобы не ошибиться в размерности полученного результата, производим вычисления с указанием размерности каждой величины. Напомним, что Дж = Па×м3.
Задача 154 Газовая смесь приготовлена из 2 л кислорода (Р = 100 кПа) и 4 л сернистого газа (Р = 100 кПа). Объем смеси равен 6 л. Определить парциальные давления газов в смеси и общее давление газовой смеси. Решение: Парциальным давлением газа в смеси называется давление, которое производил бы этот газ, занимая при тех же физических условиях объем всей газовой смеси. Объем кислорода после смешения увеличился в 3 раза (6:2=3), а объем сернистого газа – в 1,5 раза (6:4=1,5). Во столько же раз уменьшились парциальные давления газов (РJ = const). Следовательно,
В задачах (138–144) определить, какое давление разовьет газ (0,1 кг) в баллоне емкостью 10 л при температуре 300 К
В задачах (145–152) вычислить мольную массу газа по заданному объему
В задачах (153–159) определить парциальные давления отдельных газов в смеси и общее давление газовой смеси по следующим данным:
Химические эквиваленты Эквивалентом элементов называется количество, соединяющееся с 8 массовыми частями кислорода или 1,0078 массовой частью водорода или замещающее те же количества кислорода или водорода в их соединениях. Эквивалент элемента (простого вещества) рассчитывают по формуле: Э = А/В, где Э – эквивалент элемента, г/моль; А – относительная атомная масса элемента, В – валентность элемента. Так эквивалент серы при получении SO2: S + O = SO2 равен ЭS = 32: 4 = 8. Эквивалентом сложного вещества называется такое его массовое количество, которое взаимодействует без остатка с одним эквивалентом водорода или кислорода или вообще с одним эквивалентом любого вещества. Эквивалент сложного вещества определяют по формуле Э = М/В×n, где М – относительная молекулярная масса вещества; В – валентность (заряд) функциональных групп; n – число функциональных групп. Функциональные группы: для кислоты – ионы Н+; для основания – ионы ОН–; для соли – ионы Ме+.
Эквивалент сложного вещества, так же как и эквивалент элемента, может иметь различные значения и зависит от того, в какую реакцию обмена вступает это вещество. Эквивалент H2SO4 в реакции H2SO4 + KOH = KHSO4 + H2O равен
Примеры составления условия задач и их решения Задача 185 Вычислить эквивалентную массу металла, зная, что его хлорид содержит 79,78 % хлора и 20,22 % металла. Решение: Согласно закону эквивалентов отношение количества металла и хлора в соединении должно быть равно отношению их эквивалентных масс:
Задача 190 Вычислить эквивалентную массу оксида и металла, если на восстановление 1,80 г оксида израсходовано 0,833 л водорода (н.у.). Решение: В тех случаях, когда одно из реагирующих веществ находится в твердом состоянии, а второе – в газообразном, закон эквивалентов может быть выражен так:
Эквивалентная масса оксида равна сумме эквивалентных масс элемента, образующего оксид, и кислорода: ЭМеО = ЭМе + ЭО; ЭМе = ЭМеО + ЭО = 24,20 – 8 = = 16,20 г/моль. Эквивалентная масса металла равна 16,20 г/моль. Задача 196 При растворении 0,5 г метана в кислоте выделилось 0,189 л водорода при температуре 294 К и давлении 101,325 кПа. Вычислить эквивалентную массу металла. Решение: Необходимо объем газа привести к нормальным условиям.
Из закона эквивалентов вытекает, что
подставив значение величин из условия, получим
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 432; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.007 с.) |

 или
или  .
. или
или  .
. или
или  .
.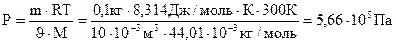 .
. = 100/3 = 33,3 кПа,
= 100/3 = 33,3 кПа,  = 100/1,5 = = 66,7 кПа. Согласно закону парциальных давлений общее давление смеси газов, не вступающих друг с другом в химическое взаимодействие, равно сумме парциальных давлений газов, составляющих смесь:
= 100/1,5 = = 66,7 кПа. Согласно закону парциальных давлений общее давление смеси газов, не вступающих друг с другом в химическое взаимодействие, равно сумме парциальных давлений газов, составляющих смесь: кПа.
кПа. г/моль;
г/моль; 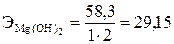 ;
;  .
. , а в реакции H2SO4 + Mg = MgSO4 + H2 равен
, а в реакции H2SO4 + Mg = MgSO4 + H2 равен  . Эквивалент Al(OH)3 в реакции Al(OH)3 + HCl = Al(OH)2Cl + H2O равен
. Эквивалент Al(OH)3 в реакции Al(OH)3 + HCl = Al(OH)2Cl + H2O равен 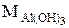 , а в реакции (Al(OH)3 + 3 HNO3 = = Al(NO3)3 + 3 H2O равен
, а в реакции (Al(OH)3 + 3 HNO3 = = Al(NO3)3 + 3 H2O равен 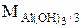 .
. ;
;  г/моль.
г/моль. =
= 
 ;
; 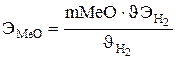 .
. – эквивалентный объем газа – это объем, который занимает 1 эквивалент вещества при данных условиях. Значение эквивалентного объема можно найти, исходя из того, что мольный объем любого газа при нормальных условиях равен 22,4 л/моль. При нормальных условиях эквивалентный объем водорода равен 11,2 л/моль:
– эквивалентный объем газа – это объем, который занимает 1 эквивалент вещества при данных условиях. Значение эквивалентного объема можно найти, исходя из того, что мольный объем любого газа при нормальных условиях равен 22,4 л/моль. При нормальных условиях эквивалентный объем водорода равен 11,2 л/моль: г/моль.
г/моль. л.
л. ,
, г/моль.
г/моль.


