
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В задачах (258–266) вычислить, сколько молей веществ, подчеркнутых в уравнениях реакций, прореагировало или образовалось в результате химических превращений, если при этом выделилось 2500 кдж теплаСодержание книги
Поиск на нашем сайте
В задачах (267–276), используя термодинамические величины веществ, вычислить для химических реакций изменения энтальпии, энтропии и энергии Гиббса. Определить, в каком направлении возможно протекание реакций
В задачах (277–284) рассчитать приблизительно температуру, при которой устанавливается равновесие в обратимых химических реакциях
Скорость химических реакций и химическое равновесие
Химическая кинетика изучает скорость и молекулярный механизм химических реакций. Различают среднюю и истинную (или мгновенную) скорость реакции. Скорость гомогенной химической реакции измеряется изменением концентрации одного из веществ, участвующих в процессе, за единицу времени. Реакция в гетерогенной системе осуществляется на поверхности раздела между фазами. Скорость гетерогенной реакции не зависит от площади поверхности раздела между фазами, как и скорость гомогенной реакции не зависит от объема системы. Для реакции аА + bВ → mМ + nN математическое выражение закона действия масс (1867 г. К.М. Гульдберг, И. П. Вааге) имеет вид
где V– скорость реакции; k – коэффициент пропорциональности, называемый константой скорости химической реакции (при СA = CB =1 моль/л k численно равна V); СA и CB - концентрации реагентов А и В; а, b - стехиометрические коэффициенты в уравнении реакции. Так как скорость химической реакции зависит от температуры, то k – величина постоянная только при данной температуре. Закон действия масс справедлив только для наиболее простых по своему механизму взаимодействий, протекающих в газах или в разбавленных растворах. Сложные реакции могут быть совокупностью параллельно или последовательно протекающих процессов. Закон действия масс справедлив для каждой отдельной стадии реакции, но ни для всего взаимодействия в целом. Та стадия процесса, скорость которой минимальная, лимитирует скорость реакции в общем. Поэтому математическое выражение закона действия масс, записанное для самой медленной (лимитирующей) стадии процесса, приложимо одновременно и ко всей реакции в целом. Например, запись аА + bВ → АаВb может быть суммарным уравнением сложного взаимодействия, протекающего по стадиям: А + В →АВ – самая медленная стадия процесса, (а – I)А + АВ → АаВ, АаВ + (b-1)В → АаВb. Закон действия масс запишется так: V = k СА∙СВ. Это соотношение представит зависимость от концентрации реагентов А и В не только скорости первой стадии реакции, но и всего процесса. Химическая реакция не всегда «доходит до конца», другими словами, исходные вещества не всегда полностью превращаются в продукты реакции. Это происходит потому, что по мере накопления продуктов реакций могут создаться условия для протекания реакции в противоположном направлении. Химические реакции, которые при одних и тех же условиях могут идти в противоположных направлениях, называются обратимыми. Состояние, в котором скорость обратной реакции становится равной скорости прямой реакции, называется химическим равновесием. Для обратимой химической реакции, записанной в общем виде mA + nB ↔ qD + pC, константа равновесия выразится уравнением
Уравнение представляет собой математическое выражение закона действия масс при химическом равновесии. Равновесие обратной реакции может быть нарушено воздействием внешних условий, например изменением концентрации, давления или температуры. Все разнообразные эффекты внешних воздействий на изменение равновесия могут быть обобщены в виде следующего правила, впервые сформулированного в 1884 г. французским химиком Ле-Шателье. Внешнее воздействие (изменение концентрации, давления или температуры) на систему, находящуюся в состоянии равновесия, вызывает сдвиг равновесия в том направлении, при котором частично компенсируется влияние этого воздействия. Это правило называется принципом Ле-Шателье, или принципом подвижного равновесия.
Примеры составления условий задачи и их решение Задача 290 Определить константу равновесия обратимой химической реакции СН4 (г) + H2O(г) ↔ 3 Н2 (г) + СО(г) при температуре 1000 К. Как будет смещаться равновесие при повышении температуры и давления? Решение: Константа равновесия химической реакции связана со стандартной энергией Гиббса уравнением ΔGo = -RTln Kp = -2,3 RTlg Kp. Откуда lg Kp = - ΔGo/2,3 RT. ΔGox.p. = ΔHox.p.- TΔSox.p.
СН4 (г) + Н2O(г) ↔ 3 H2 (г) + СО(г) ΔНообр., кДж/моль - 74,86 - 241,84 О - 110,52 Sо, Дж/моль·К 186,44 188,72 126,04 197,54 Находим ΔНох.р. ΔНох.р. = - 110,52 – [-74,86 +(-241,84)] = 206,18 кДж/моль = 206180 Дж/моль, Вычисляем ΔSо реакции ΔSо = (3·126,04 + 197,54) – (186,44+188,72) = 200,5 Дж/моль·К, Находим ΔGо реакции ΔGо = ΔНо - ТΔSо = 206180 - 298·200,5=146431 Дж/моль,
откуда К = 2,19·10-8. Большой положительной величине ΔGо соответствует малая константа равновесия. Направление, в котором сместилось равновесие, определяется по принципу Ле-Шателье: 1) так как реакция эндотермическая (Δ Н > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; 2) при повышении давления равновесие будет смещаться в сторону образования меньшего числа молекул, в сторону обратной реакции (
Задача 309 В системе А(г) + 2 В(г) = С(г) равновесные концентрации равны: [A] = 0,06 моль/л; [B] = 0,12 моль/л; [C] = 0,216 моль/л. Найти константу равновесия реакции и исходные концентрации веществ А и В. Решение: Константа равновесия данной реакции выражается уравнением
Подставляя в него данные задачи, получаем
Для нахождения исходных концентраций веществ А и В учтем, что согласно уравнению реакции из 1 моля А и 2 молей В образуется I моль С. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моля вещества С, то при этом было израсходовано 0,216 моля А и 0,216×2=0,432 моля В. Таким образом, исходные концентрации равны: [A0] = 0,06 + 0,216 = 0,276 моль/л, [Во] = 0,12 + 0,432 = 0,552 моль/л. Задача 315 Константа скорости некоторой реакции при 313 К равна 1,816×10-4сек-1, а при 333 К - 3,996×10-4 сек-1. Вычислить энергию активации. Решение: Каждая реакция характеризуется определенным энергетическим барьером; для его преодоления необходима энергия активации - некоторая избыточная энергия (по сравнению со средней энергией молекул при данной температуре), которой должны обладать молекулы для того, чтобы их столкновение было эффективным, т.е. привело бы к образованию нового вещества. Энергию активации вычисляем по уравнению Аррениуса:
Задача 322 Температурный коэффициент скорости реакции равен 3. Во сколько раз возрастает скорость реакции при повышении температуры от 283 до 383 °С? Решение: Простейшая зависимость скорости реакции от температуры выражаетсяэмпирическим правилом Вант-Гоффа: Vt+10 / Vt= kt+10 / kt= γ. Здесь Vt и kt - скорость и константа скорости реакции при температуре t 0С; Vt+10 и kt+10- те же величины при температуре (t+ 10 °С); γ- температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2-4. В общем случае, если температура изменилась на Dt °С, последнее уравнение преобразуется к виду Vt+Dt / Vt= kt+Dt / kt= γDt/10.
Отсюда При повышении температуры на 100 0C скорость реакции увеличится в 59 020 раз. Задача 325 Энергия активации распада метана в отсутствии катализатора равна 331,0 кДж/моль, а с катализатором – 230,0 кДж/моль. Во сколько раз возрастет скорость реакции в присутствии катализатора, если реакция протекает при 1 000 К? Решение: Скорость химической реакции возрастает в присутствии катализатора. Действие катализатора объясняется тем, что при его участии возникают нестойкие промежуточные соединения (активированные комплексы), распад которых приводит к образованию продуктов реакции. При этом энергия активации реакции понижается и активными становятся некоторые молекулы, энергия которых была недостаточна для осуществления реакции в отсутствии катализатора. Обозначим энергию активации реакции без катализатора через Еа, а с катализатором - через
Таким образом, снижение энергии активации на 101 кДж привело к увеличению скорости реакции в 186 тысяч раз. При выполнении заданий рекомендуется использовать методические указания [1; 3].
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 520; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.27.153 (0.007 с.) |

 ,
,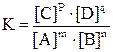 .
. ,
, ).
).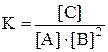 .
. .
.

 ;
;  .
. .
. ; соответствующие константы скорости реакции обозначим через k и
; соответствующие константы скорости реакции обозначим через k и  . Используя уравнение Аррениуса, находим
. Используя уравнение Аррениуса, находим .
. Получим
Получим . Окончательно находим
. Окончательно находим  .
.


