
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молекулярно-ионные уравнения обменных реакций между растворами электролитовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Поскольку электролиты в растворах чаще всего образуют ионы, то для отражения сущности реакции в них используют часто так называемые ионные уравнения реакций. Написанием ионных уравнений подчеркивается тот факт, что согласно теории диссоциации в растворах происходят реакции не между молекулами, а между их ионами. Ионное уравнение в отличие от молекулярного уравнения относится не к одной какой-нибудь реакции между определенными, конкретными веществами, но может охватывать целую группу аналогичных реакций. В этом его большая практическая ценность и значение, например благодаря этому широко используются качественные реакции на различные ионы. Обменные реакции между электролитами практически необратимы и идут до конца в случае образования малорастворимых, малодиссоциирующих и газообразных соединений. При составлении молекулярно-ионных уравнений реакций малорастворимые, малодиссоциирующие, газообразные вещества и неэлектролиты записывают в виде молекул, а сильные электролиты в виде ионов, на которые они диссоциируют. Иногда встречаются и такие процессы, при которых труднорастворимые соединения находятся как среди исходных, так и конечных продуктов реакции: BaCO3↓ + K2SO4 ↔ BaSO4 ↓ + K2CO3. В подобных реакциях равновесие смещается в сторону образования того вещества, которое менее растворимо. Так как ВаСО3 более растворим (8,95·10-5 г-экв/л), чем BaSO4 (9,34·10-6 г-экв/л), то равновесие смещено слева направо. Примеры составления задач и их решения Задача 789 Напишите в молекулярной и ионно-молекулярной формах реакции взаимодействия между следующими веществами: a) BaCI2 и Nа2SO4; б) Na2SO3 и НCl; в) K2CO3 и НNО3. Решение: Сильными электролитами являются почти все растворимые соли (кроме СиС12, Рb(СН3СОО)2, Fe(CNS)3), щелочи и сильные кислоты (HCI, НВг, НI, НNO3, Н2SO4, НClO4, НМnO4). Поэтому можно записать: a) BaCI2 +Na2SO4 = BaSO4¯ + 2 NaCI Ва2++ 2Сl– + 2Na+ + SO42– = BaSO4¯ + 2Na+ + 2Сl– Ba2+ + SO42– = BaSO4¯
б) Na2SO3 + 2 HCI = 2NaCI + H2SO3 2Na+ + SO32- + 2 H+ + 2Сl– = 2Na+ + 2Сl– + H2SO3 2 H+ + SO32– = H2SO3
в) К2СO3 + 2 HNO3 = Н2O + СO2 + 2 KNO3 2 К+ + СО32– + 2 Н+ + 2NO3– = Н2O + СО2 + 2 К+ + 2NO3– 2 Н+ + СО32– = Н2O + СO2
В задачах 776–797 напишите в молекулярной и молекулярно-ионной форме уравнения реакций взаимодействия следующих веществ:
Произведение растворимости В насыщенном растворе малорастворимого электролита устанавливается равновесие между осадком электролита и ионами электролита в растворе.
Например: BaSO4 ↔ Ва2+ + SO42–. в осадке в растворе
В растворах электролитов состояние ионов определяется их активностями, поэтому константа равновесия процесса выразится следующим уравнением: К= α (Ва2+) · α (SO42-) / α (ВаSO4). Активность твердого сульфата бария есть величина постоянная, отсюда следует, что произведение активностей ионов Ва2+ и SO42– есть постоянная величина, называемая произведением растворимости, и обозначается α Ва2+ · α SO42- = ПР ВаSO4. Если электролит очень мало растворим, то произведение активностей ионов можно заменить произведением их концентраций
Если молекула электролита при диссоциации образует два и несколько одинаковых ионов, то концентрации этих ионов должны быть возведены в соответствующие степени, например:
Условием образования осадка является превышение произведения концентраций ионов малорастворимого электролита над его произведением растворимости. Растворение же осадка малорастворимого электролита происходит при условии, что произведение концентраций его ионов меньше значения произведения растворимости. Исходя из значений ПР, можно вычислять растворимость малорастворимых электролитов в воде и растворах, содержащих другие электролиты.
Примеры составления задач и их решения Задача 798 Вычислить произведение растворимости фосфата серебра, если его растворимость равна 0,0065 г/л. Решение: Находим растворимость Ag3PO4. Молярная масса Ag3PO4 равна 418,6 г/моль. Растворимость: S = 6,5·10-3 / 418,6 = 1,6·10-5 моль/л. При диссоциации Ag3PO4 образуется три иона Ag+ и один ион РO43– : АgзРO4 = 3 Ag+ + PO43–, поэтому [PO43–] равна растворимости Ag3PO4 , а концентрация иона Ag+ в 3 раза больше, т.е. [РO43–] = 1,6·10-5 моль/л; [Ag+]=3·1,6·10-5 =4,8 · 10 -5 моль/л. Произведение растворимости Ag3PО4:
Задача 824 Произведение растворимости иодида свинца при 20 oC равно 8·10–9. Вычислить растворимость соли (в моль/л и в г/л) при указанной температуре. Решение: Обозначим искомую растворимость через S (моль/л). Тогда в насыщенном растворе PbI2 содержится S моль/л ионов Pb2+ и 2S моль/л ионов I–. Отсюда:
Поскольку мольная масса PbI2 равна 461 г/моль, то растворимость PbI2, выраженная в г/л, составит 1,3∙10–3∙461 = 0,6 г/л. В задачах 798–812 вычислить произведение растворимости малорастворимых электролитов
В задачах 813-824 вычислить растворимость электролита по величине произведения растворимости (прил. табл.8)
Гидролиз солей Гидролиз солей относится к обменным реакциям, поскольку процесс идет без изменения степени окисления реагирующих веществ. Сущность реакций гидролиза состоит во взаимодействии ионов соли с ионами водыс образованием слабых электролитов. В процессе гидролиза один из ионов воды связывается в слабый электролит, а другой, как правило, накапливается в растворе. Тот ион, который накапливается в растворе, определяет реакцию среды. Если накапливаются ионы Н+, то среда будет кислой, если группы ОН – щелочной. При образовании одинаковых по силе электролитов среда может быть и нейтральной. Последний случай встречается редко. Уравнения гидролиза пишутся аналогично другим ионным уравнениям: малодиссоциированные (в том числе и вода) и малорастворимые, а также газообразные вещества пишутся в виде молекул, сильные электролиты записываются в виде ионов. Уравнения гидролиза солей многоосновных кислот и многокислотных оснований записываются по ступеням, аналогично ступенчатой диссоциации. Гидролиз солей, или их обменное взаимодействие с водой, происходит лишь в тех случаях, когда ионы, образующиеся в результате электролитической диссоциации соли–катион, анион или оба вместе, способны образовывать с ионами воды Н+ и ОН– – малодиссоциированные сочетания. Гидролизу подвергаются соли, образованные: слабыми кислотами и сильными основаниями; слабыми основаниями и сильными кислотами; слабыми кислотами и слабыми основаниями. Если процесс гидролиза необходимо усилить, то следует разбавить раствор и повысить температуру. Если необходимо уменьшить гидролиз солей, то к раствору добавляют кислоту или щелочь в зависимости от типа гидролизуемой соли.
Примеры составления задач и их решения Задача 858 Какие из перечисленных ниже солей подвергаются гидролизу: NH4I, Na2S, Al(CH3COO)3, CaCl2? Решение: Иодид аммония - соль, образованная сильной кислотой и слабым основанием. Гидролиз соли: гидролизу подвергается катион соли. Реакция раствора кислая: рН<7.
NH4I + HOH «NH4OH + HI. Или в ионном виде: NH4+ + HOH «NH4OH + H+.
Сульфид натрия – соль, образованная сильным основанием и слабой кислотой. При растворении солей многоосновных кислот гидролиз протекает ступенчато: Na2S + H2O «NaHS + NaOH.
Или в ионной форме: S2– + H2O «HS– + OH–. Гидролизу подвергается анион соли. Процесс отражает гидролиз по первой стадии. Чтобы гидролиз соли многоосновной кислоты прошел полностью, как правило, увеличивают температуру процесса:
или в ионной форме: Раствор такой соли проявляет щелочную реакцию рН>7. Ацетат алюминия – соль, образованная слабым основанием и слабой кислотой. Гидролизу подвергается как катион, так и анион соли: Al(CH3COO)3 + H2O «AlOH(CH3COO)2 + CH3COOH. Параллельно идут два процесса: Al3+ + H2O «AlOH2+ + H+, CH3COO– + H2O «CH3COOH + OH–. В этом случае реакция раствора зависит от относительной силы кислоты и основания, образующих соль. Для гидролиза А1(СН3С00)3 реакция полученного раствора будет слабокислотной, поскольку константа диссоциации А1(OН)3 (К=1,38×10-9) меньше константы диссоциации уксусной кислоты (К=I,75×10-5). Хлорид кальция - соль, образованная сильным основанием и сильной кислотой. Взаимодействие с водой можно представить таким образом: CaCl2 + 2H2O «Ca(OH)2 + 2HCl, H2O «H+ + OH–. Однако единственным малодиссоциирующим соединением в реакции остается сама вода, следовательно, равновесие реакции полностью смещено влево - гидролиз не идет. Раствор соли проявляет нейтральную среду. Реакция гидролиза представляет собой эндотермический процесс. Поскольку гидролиз является обычным равновесным процессом, то он зависит от всех тех факторов, которые влияют на равновесие реакций, и к нему применимо правило Ле-Шателье.
Задача 864 Вычислить константу гидролиза NН4Сl. Решение: Гидролиз соли, образованной слабым основанием и сильной кислотой, характеризуется константой гидролиза:
где Из табл. 7 приложения находим Отсюда
Задача 880 Вычислить степень гидролиза ZnCl2 по 1 ступени в 0,5 М растворе. Решение: Ионное уравнение гидролиза Zn2+ + H2O «ZnOH+ + H+,
Степень гидролиза вычисляем по формуле:
Степень гидролиза соли тем больше, чем меньше ее концентрация; иначе говоря, при разбавлении раствора гидролизующейся соли степень ее гидролиза возрастает. При выполнении заданий рекомендуется использовать методические указания [8]. При решении задач по гидролизу использовать данные констант диссоциации некоторых электролитов, приведенные в табл. 7 приложения.
В задачах 825–858 указать, какие из перечисленных ниже солей подвергаются гидролизу. Для каждой из гидролизующихся солей написать в молекулярной и ионной форме уравнения гидролиза, указать реакцию водного раствора соли
|
|||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 1392; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.255.122 (0.01 с.) |

 = [Bа2+ ] · [SO42– ].
= [Bа2+ ] · [SO42– ]. = [Cа2+ ] · [F– ]2.
= [Cа2+ ] · [F– ]2. = [Ag+]3 · [ PO43–] = (4,8·10-5)3 · 1,6·10-5=1,77·10 - 18.
= [Ag+]3 · [ PO43–] = (4,8·10-5)3 · 1,6·10-5=1,77·10 - 18.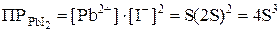 ;
; .
. ,
, .
. ,
, - ионное произведение воды; Косн – константа диссоциации основания.
- ионное произведение воды; Косн – константа диссоциации основания. = 1,8 × 10-5.
= 1,8 × 10-5. .
. = 1,5×10-9.
= 1,5×10-9. (0,36 %).
(0,36 %).


