
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В задачах 859–868 вычислить константу гидролизаСодержание книги
Поиск на нашем сайте
В задачах 869–880 вычислить степень гидролиза
СТРОЕНИЕ АТОМА Вся совокупность сложных движений электрона в атоме описывается четырьмя квантовыми числами: главным n, побочным ℓ, магнитным mℓ и спиновым mS. Главное квантовое число n определяет общую энергию электрона на данной орбитали и его удаленность от ядра. Оно может принимать любые целые значения, начиная с единицы: 1,2,3,4... ¥. Под главным квантовым числом, равным ¥, подразумевают, что атому сообщена энергия, достаточная для полного отделения электрона от ядра (ионизация атома). N = 2n2 – максимальное число электронов, которое находится на каждом энергетическом уровне. Энергетические уровни представляют собой совокупность некоторых энергетических подуровней. Существование различий в энергетическом состоянии электронов отражается побочным (орбитальным) квантовым числом ℓ. Это квантовое число может принимать целочисленное значение от 0 до n-1 (ℓ = 0, 1, 2... n - 1). Численные значения ℓпринято обозначать буквенными символами:
В этом случае говорят о s, p, d, f, g, – состояниях электронов, или s, p, d, f, g –орбиталях. Орбиталь – совокупность положений электрона в атоме, т.е. область пространства, где энергетически выгоднее всего находиться электрону. ℓ – определяет форму электронного облака, а также орбитальный момент – момент количества движения электрона при его вращении вокруг ядра (отсюда и второе название этого квантового числа – орбитальное). Если ℓ = 0 (s -орбиталь), то электронное облако имеет сферическую форму и не обладает направленностью в пространстве. При ℓ = 1(р -орбиталь) электронное облако имеет форму гантели, т.е. форму тела вращения, полученного из "восьмерки". При ℓ = 2 (d- орбиталь) электронное облако имеет четырехлепестковую фигуру. Формы f и g электронных облаков намного сложнее. Максимальное число электронов на подуровне рассчитывается по формуле 2(2 ℓ + 1). Ориентация электронного облака в пространстве не может быть произвольной. Она определяется значением третьего, так называемого магнитного квантового числа mℓ. mℓ может принимать значения любых целых чисел, как положительных так и отрицательных от -1до +1, включая 0, т.е. всего (2 ℓ + 1) значений. Например, при l = 0 mℓ = 0; при ℓ = 1 mℓ равно -1, 0, +1; при ℓ, равном 3, mℓ имеет семь значений (2 ℓ + 1 = 2∙3 + 1 = 7): -3, -2, -1, 0, +1,+2,+3 – семь различных ориентаций f электронных облаков в пространстве. mS – спиновое квантовое число определяет собственное состояние электрона, результат вращения электрона вокруг своей оси. Спиновое квантовое число может иметь два значения: +1/2 или -1/2. Итак, состояние электронов можно описать набором четырех квантовых чисел, но для объяснения строения электронных оболочек атомов нужно знать еще три основных положения: принцип Паули, правило Хунда, принцип наименьшей энергии. Принцип Паули. В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми. Правило Хунда. При данном значении ℓ (то есть в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным. Принцип наименьшей энергии – правило Клечковского: в атоме каждый электрон располагается так, чтобы его энергия была минимальна (что отвечает наибольшей его связи с ядром). Энергия электрона в основном определяется главным квантовым числом n и побочным числом ℓ, поэтому сначала заполняются те подуровни, для которых сумма значений n + ℓ является меньшей (энергия электрона на подуровне 4 s меньше, чем на подуровне 3 d, так как n + ℓ = 4 + 0 = 4 для 4 s и n + ℓ = 3 + 2 = 5 для 3 d. Когда для двух подуровней суммы n + ℓ равны, сначала идет заполнение с меньшим значением n (на подуровнях 3d, 4p, 5s n + ℓ = 5 – в этом случае происходит заполнение подуровней сначала с меньшим значением n, т.е. 3 d ® 4 p ® 5 s).
Примеры составления условий задач и их решения Задача 889 Составить электронную формулу атомов Be, As в стабильном и возбужденном состояниях и изобразить орбитали внешнего энергетического уровня. Решение: Атом бериллия Be. Стабильное состояние
После Sp –гибридизации строение возбужденного атома бериллия
Атом мышьяка As.
Возбужденное состояние
Задача 893 Определить, какие частицы Mg, Si, Al+, S2– являются изоэлектронными, то есть содержащими одинаковое число электронов. Написать электронные формулы данных частиц. Решение: Изоэлектронными являются частицы Mg и Al+. Их электронные формулы следующие:
Возбужденное состояние
Задача 897 Пользуясь правилом Гунда, распределить электроны по квантовым ячейкам, отвечающим низшему и высшему энергетическим состояниям атомов мышьяка As, кобальта Co, стронция Sr. Решение: Низшее энергетическое состояние:
Валентность равна трем _____________________________________________________________________
Валентность равна трем _____________________________________________________________________
Валентность равна нулю ___________________________________________________________________ Высшее энергетическое состояние:
Валентность равна пяти ___________________________________________________________________
Валентность равна пяти _____________________________________________________________________
Валентность равна двум При выполнении заданий рекомендуется использовать учебное пособие [9].
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 405; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.217.100 (0.007 с.) |

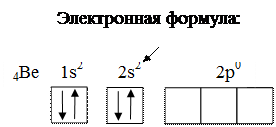




 Электронная формула: Стабильное состояние
Электронная формула: Стабильное состояние
 Стабильное состояние
Стабильное состояние Возбужденное состояние
Возбужденное состояние









