
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: приготовление растворов заданной концентрацииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Цель: формирование умений приготовления растворов различной концентрации из сухой соли или более концентрированного раствора. Время выполнения: 2 часа Теоретический материал Растворы играют важную роль в живой и неживой природе, а также в науке и технике. Большинство физиологических процессов в организмах человека, животных и в растениях, различных промышленных процессов, биохимических процессов в почвах и т.п. протекают в растворах. Раствор – это гомогенная многокомпонентная система, в которой одно вещество распределено в среде другого или других веществ. Растворы могут быть в газообразном (воздух), жидком и твердом (сплавы, цветные стекла) агрегатных состояниях. Чаще всего приходится работать с жидкими растворами. Содержание данного вещества в единице массы или объема раствора называется концентрацией раствора. На практике наиболее часто пользуются следующими способами выражения концентрации: 1. Массовая доля – отношение массы данного компонента в растворе к общей массе этого раствора. Массовая доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных долях (млнˉ1). Массовая доля данного компонента, выраженная в процентах, показывает, сколько граммов данного компонента cодержится в 100 г раствора. 2. Массовая концентрация – отношение массы компонента, содержащегося в растворе, к объему этого раствора. Единицы измерения массовой концентрации ‑ кг/м3, г/л. 3. Титр Т – число граммов растворенного вещества в 1 мл раствора. Единицы измерения титра – г/мл, кг/см3. 4. Молярная концентрация с – отношение количества вещества (в молях), содержащегося в растворе, к объему раствора. Единицы измерения - моль/м3, (моль /л). Раствор, имеющий концентрацию 1 моль/л, обозначают 1 М; 0,5 моль/л, обозначают 0,5 М. 5. Молярная концентрация эквивалентов с эк (нормальная концентрация) – это отношение количества вещества эквивалентов (моль) к объему раствора (л). Единица измерения нормальной концентрации моль/л. Например, с эк(KOH) = 1 моль/л, с эк(1/2H2SO4) = 1 моль/л, с эк(1/3 AlCl3) = 1 моль/л. Раствор в 1 л которого содержится 1 моль вещества эквивалентов, называют нормальным и обозначают 1 н. 6. Моляльность b - это отношение количества растворенного вещества (в молях) к массе m растворителя. Единица измерения моляльности - моль/кг. Например, b (HCl/H2O) = 2 моль/кг.
7. Молярная доля – отношение числа молей растворенного вещества к общему числу молей вещества и растворителя. Молярная доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных долях (млн-1). Для приготовления растворов определенной концентрации, для точного измерения объемов применяют мерную посуду: мерные колбы, пипетки и бюретки. Экспериментальная часть Опыт 1. Приготовление раствора хлорида натрия с заданной массовой долей соли (%) разбавлением концентрированного раствора. Как известно, плотность – это масса вещества в единице объема, ρ = m / v. Зная плотность, можно по таблице определить массовую долю (%) раствора. Определить плотность раствора можно многими способами. Из них наиболее простой и быстрый – с помощью ареометра. Его применение основано на том, что плавающее тело погружается в жидкость до тех пор, пока масса вытесненной им жидкости не станет, равна массе самого тела (закон Архимеда). В расширенной нижней части ареометра помещен груз, на узкой верхней части – шейке - нанесены деления, указывающие плотность жидкости, в которой плавает ареометр. Концентрацию исследуемого раствора находят, пользуясь табличными данными о плотности в зависимости от концентрации раствора. Плотность водных растворов хлорида натрия приведена в таблице 1. Выполнение опыта. В мерный цилиндр наливают раствор хлорида натрия и ареометром определяют его плотность. По таблице 1 находят концентрацию исходного раствора [в % (масс) ]. Таблица 1 – Плотность и процентное содержание растворов хлорида натрия
Рассчитывают, сколько миллилитров исходного раствора и воды следует взять для приготовления 250 мл 5% раствора. Воду отмерить цилиндром и вылить в мерную колбу объемом 250мл. Исходный раствор поваренной соли отмеряют цилиндром на 100 мл и вливают в колбу с водой. Раствор в колбе перемешивают. Цилиндр ополаскивают небольшим объемом раствора из колбы, который затем присоединяют к общей массе раствора в колбе. Проверить плотность и концентрацию полученного раствора. Рассчитать относительную ошибку δотн
где С – заданная концентрация, С 1- полученная концентрация. Сделайте расчет молярной концентрации молярной концентрации эквивалентов и титра, приготовленного раствора. Результаты запишите в таблицу 2. Таблица 2 – Опытные данные
Пример 1. Приготовить 0,5 л 20% раствора H2SO4, исходя из концентрированного раствора, плотность которого 1,84 г/см3. По таблице находим, что плотности 1,84 г/см3 соответствует кислота с содержанием 96% H2SO4, а 20% раствору соответствует кислота с плотностью 1,14 г/см3. Вычислим количества исходной кислоты и воды, требующиеся для получения заданного объема раствора. Масса его составляет 500 Вычислим, в каком объеме исходной 96% кислоты содержится 114 г H2SO4: 1 мл исходной кислоты содержит Таким образом, для приготовления 500мл 20% раствора H2SO4 необходимо взять 64,6 мл 96% раствора. Количество воды определяется как разность весов полученного исходного раствора, а именно Опыт 2. Приготовление раствора заданной концентрации смешиванием растворов более высокой и более низкой концентрации. Раствор можно готовить, непосредственно вводя рассчитанное количество вещества в растворитель, или путем разбавления более концентрированных растворов до требуемого значения концентрации.
Пример 2. Приготовить 100г 36% раствора H3PO4, смешав 44% и 24% растворы этой кислоты. Обозначим через х количество граммов 44% раствора, которое следует добавить к (100-х) граммам 24% раствора для получения 100г 36% раствора H3PO4. Составим уравнение: откуда Следовательно, необходимо взять 60г 44% раствора Выполнение опыта. Приготовить 250 мл 10 % раствора хлорида натрия, имея в своем распоряжении 15 % и 5 % раствор NaCl. Учитывая плотности приготовляемого и исходных растворов рассчитать объемы 15 % и 5 % раствора (см. пример 2). Отмерить вычисленные объемы исходных растворов, слить в колбу на 250 мл, закрыть колбу пробкой и тщательно перемешать раствор, перевернув колбу несколько раз вверх дном. Отлить часть раствора в цилиндр, измерить ареометром плотность приготовленного раствора и по табл.1 найти его концентрацию (в %). Установить расхождение практически полученной концентрации с заданной. Рассчитать относительную ошибку δотн. Опыт 3. Приготовление водного раствора хлорида натрия. определение массовой доли и расчет навески. Получить навеску соли хлорида натрия у преподавателя. При помощи воронки перенести данную навеску в мерную колбу емкостью 250 мл. Промывалкой обмыть внутреннюю часть воронки небольшим количеством воды. Растворить соль в воде. Затем, добавляя воду небольшими порциями, довести уровень воды в колбе до метки, закрыть колбу пробкой и тщательно перемешать, переворачивая вверх дном. Замерить плотность полученного раствора ареометром. Для этого раствор перелить в мерный цилиндр. Уровень жидкости должен быть ниже края цилиндра на 3-4 см. Осторожно опустите ареометр в раствор. Ареометр не должен касаться стенок цилиндра. Отсчет плотности по уровню жидкости производите сверху вниз. По таблице 1 найдите и запишите массовую долю (в %) раствора, отвечающую этой плотности. Рассчитать количество хлорида натрия взятого для приготовления 250 мл раствора.
Пример 3. Пусть плотность приготовленного раствора хлорида натрия ρ=1,0053г/см3. Это соответствует 1% концентрации раствора. Следовательно, в100г раствора содержится 1г NaCl. Определим массу 250 мл раствора Исходя из того, что в 100г раствора содержится 1г NaCl, узнаем, сколько грамм NaCl содержится в 201,315г раствора: 100 г раствора - 1 г NaCl 201,315 г раствора - х г NaCl х = Таким образом, была взята навеска NaCl массой 2,0131 г.
Контрольные вопросы: 1. Что такое разбавленный раствор; концентрированный раствор? 2. Что называется массовой долей растворенного вещества? По какой формуле рассчитывается? 3. Что показывает молярная концентрация раствора? По какой формуле рассчитывается? Рекомендуемая литература: 1.1 – 1.5, 2.1 -2.9 Лабораторное занятие №2
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 996; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.195.30 (0.008 с.) |


 1,14 = 570 г, а содержание в нем H2SO4 равно
1,14 = 570 г, а содержание в нем H2SO4 равно г.
г. г H2SO4
г H2SO4 х мл исходной кислоты содержит 114 г H2SO4
х мл исходной кислоты содержит 114 г H2SO4 мл
мл мл
мл

 и 100 - х = 40г 24% раствора.
и 100 - х = 40г 24% раствора.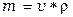

 г NaCl
г NaCl


