
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные правила по технике безопасности при выполнении лабораторных работСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение «тюменский государственный нефтегазовый университет» Институт кибернетики, информатики и связи отделение Информационных технологий и вычислительной техники
Химия Методические рекомендации для лабораторно-практических занятий студентов специальностей 230115 Программирование в компьютерных системах 230401 Информационные системы (по отраслям) на базе основного общего образования
Тюмень ТюмГНГУ Утверждено на заседании
Составитель: Петрова Татьяна Александровна, преподаватель химии высшей квалификационной категории
© Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Тюменский государственный нефтегазовый университет», 2011г.
Содержание Введение Методические рекомендации для лабораторно-практических занятий составлены в соответствии с программой учебной дисциплины «Химия» для студентов, обучающихся по специальностям 230115 «Программирование в компьютерных системах», 230401 «Информационные системы (по отраслям)» на базе основного общего образования. Проведение лабораторно-практических занятий направлено на: - углубление, систематизацию и закрепление полученных теоретических знаний по темам данной дисциплины; - формирование умения работать с различными источниками информации; - формирование умений применять полученные знания на практике; - формирование умений решать задачи; - выработку профессионально значимых качеств при решении поставленных задач: самостоятельности, ответственности, точности, логического мышления. При подготовке к занятиям необходимо повторить теоретический материал, представленный по каждой теме. В результате выполнения лабораторно-практических работ студент должен: знать: - теоретические основы общей химии; - методику проведения и анализа экспериментов; уметь: - формировать отчетную документацию по результатам работ; - проводить эксперименты по заданной методике, анализировать результаты. Методические рекомендации для лабораторно-практических занятий состоят из введения, критериев оценки работы студента, общих требований к выполнению и оформлению лабораторно-практических работ, основных правил по технике безопасности, содержания лабораторно-практических занятий, которые снабжены основными теоретическими положениями, заданиями и контрольными вопросами и списком литературы. На выполнение каждого занятия отводится определенное количество часов в соответствии с тематическим планом программы учебной дисциплины «Химия». Методические рекомендации для лабораторно-практических занятий окажут помощь преподавателям в организации и управлении работой студентов в процессе занятий, а также студенты могут использовать их как пособие для повторения изученного материала, подготовке к зачету. Критерии оценки лабораторно-практических работ студентов Оценка «отлично» ставится, если студент: 1) правильно определил цель опыта; 2) выполнил работу в полном объеме с соблюдением необходимой последовательности проведения опытов и измерений; 3) самостоятельно и рационально выбрал и подготовил для опыта необходимое оборудование, все опыты провел в условиях и режимах, обеспечивающих получение результатов и выводов с наибольшей точностью; 4) научно грамотно, логично описал наблюдения и сформулировал выводы из опыта. В представленном отчете правильно и аккуратно выполнил все записи, таблицы, рисунки, чертежи, графики, вычисления и сделал выводы; 5) проявлял организационно-трудовые умения (поддерживал чистоту рабочего места и порядок на столе, экономно использовал расходные материалы). 6) эксперимент осуществлял по плану с учетом техники безопасности и правил работы с материалами и оборудованием. Оценка «хорошо» ставится, если студент выполнил требования к оценке "5", но: 1) опыт проводил в условиях, не обеспечивающих достаточной точности измерений; 2) или было допущено два-три недочета; 3) или не более одной негрубой ошибки и одного недочета, 4) или эксперимент проведен не полностью; 5) или в описании наблюдений из опыта допустил неточности, выводы сделал неполные. Оценка «удовлетворительно» ставится, если студент: 1) правильно определил цель опыта; работу выполнил правильно не менее чем наполовину, однако объём выполненной части таков, что позволяет получить правильные результаты и выводы по основным, принципиально важным задачам работы; 2) или подбор оборудования, объектов, материалов, а также работы по началу опыта провел с помощью преподавателя; или в ходе проведения опыта и измерений были допущены ошибки в описании наблюдений, формулировании выводов; 3) опыт проводился в нерациональных условиях, что привело к получению результатов с большей погрешностью; или в отчёте были допущены в общей сложности не более двух ошибок (в записях единиц, измерениях, в вычислениях, графиках, таблицах, схемах, анализе погрешностей и т.д.) не принципиального для данной работы характера, но повлиявших на результат выполнения; или не выполнен совсем или выполнен неверно анализ погрешностей; 4) допустил грубую ошибку в ходе эксперимента (в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с материалами и оборудованием), которая исправляется по требованию преподавателя. Оценка «неудовлетворительно» ставится, если студент: 1) не определил самостоятельно цель опыта; выполнил работу не полностью, не подготовил нужное оборудование и объем выполненной части работы не позволяет сделать правильных выводов; 2) или опыты, измерения, вычисления, наблюдения производились неправильно; 3) или в ходе работы и в отчете обнаружились в совокупности все недостатки, отмеченные в требованиях к оценке "3"; 4) допущены две (и более) грубые ошибки в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые не может исправить даже по требованию преподавателя. Общие требования
Ход работы: - изучить теоретический материал; - выполнить задания; - описать ход выполнения заданий; - ответить на контрольные вопросы. Выполнение лабораторно-практических занятий должно быть оформлено в тетради для лабораторно-практических работ и включать в себя: - номер и тему занятия; - заполненные таблицы; - схемы и структуры; - условия задач; - решения задач; - необходимые выводы; - краткие ответы на контрольные вопросы. При химических ожогах При ожогах кислотой кожу быстро промывают большим количеством воды (струей из-под крана), затем насыщенным раствором гидрокарбоната натрия, после чего смазывают обожженное место водным раствором глицерина. При попадании кислоты в глаза необходимо промыть их немедленно как можно большим количеством воды, обработать тампоном, смоченным раствором гидрокарбоната натрия и вновь промыть водой. Пострадавшего немедленно направить к врачу. Если кислота попала на ткань одежды, ее промывают раствором гидрокарбоната натрия, а затем водой. При ожогах щелочью кожу быстро промывают большим количеством воды, а затем раствором уксусной или борной кислот и снова промывают водой. При ожоге глаз щелочью необходимо быстро промыть их большим количеством воды, затем обработать тампоном, смоченным раствором борной кислоты, и вновь промыть водой. Пострадавшего немедленно отправить к врачу. При попадании щелочи на ткань одежды, ее промывают 5%-ным раствором уксусной кислоты, а затем большим количеством воды. При ожогах фенолом пораженное место быстро промывают этиловым спиртом (либо другим растворителем), а затем теплой водой с мылом. После этого накладывают повязку с водным раствором глицерина, либо с борным вазелином. При ожогах бромом кожу быстро промывают большим количеством спирта или бензола и смазывают обожженное место раствором глицерина.
При раздражении дыхательных путей осторожно вдыхают 5%-ный раствор аммиака. Пострадавшего выводят на свежий воздух.
В случае возгорания одежды на пострадавшего накидывают кошму, одеяло и др. для прекращения доступа кислорода. В помещении, где проводятся работы с ядовитыми и огнеопасными веществами, должно находиться не менее двух человек. При перерыве в подаче воды немедленно перекройте все краны. При перерыве в подаче электроэнергии выключите все электронагревательные приборы. Уходя из лаборатории, необходимо выключить воду, газ, свет.
Практическое занятие № 1 Тема:Основные понятия и законы Цель: формирование умений применять основные законы для вычислений по химическим уравнениям, используя алгоритм решения задач на нахождение относительной молекулярной массы, определение массовой доли химических элементов в сложном веществе. Время выполнения: 2 часа Теоретический материал 1. Закон сохранения массы веществ: «Масса всех веществ, которые вступают в химическую реакцию, равна массе всех продуктов реакции». 2. Молярная масса вещества M выражается в г/моль. Она численно равна относительной молекулярной массе этого вещества 3. Количество вещества где n – количество вещества, моль; m – масса вещества, г; M – молярная масса, г/моль или где V – объем вещества, V 4. Масса исходного вещества Объем исходного вещества 5. Молярный объем любого газа при нормальных условиях (н.у.) равен 22,4 л/моль.
Алгоритм решения задач 1. Прочитайте текст задачи. 2. Запишите условие и требование задачи с помощью общепринятых обозначений. 3. Составьте уравнение реакции. 4. Подчеркните формулы веществ, о которых идет речь в условии задачи. 5. Надпишите над подчеркнутыми формулами исходные данные. 6. Рассчитайте молярные массы веществ, о которых идет речь в условии задачи. 7. Рассчитайте количество данного по условию задачи вещества. 8. Определите соотношение веществ в данной реакции (по коэффициентам). 9. Составьте пропорцию, рассчитайте количество определяемого вещества. 10. Используя формулу (3), вычислите массу исходного вещества. Используя формулу (4), вычислите объем исходного вещества. 11. Запишите ответ. Примеры решения задач Задача №1. Какая масса воды образуется при сгорании 1 г глюкозы
Решение. Составим уравнение данной реакции:
Запишем информацию, которую дает это уравнение:
1 моль 6 моль 180 г 6 х 18 = 108 г Следовательно: при сгорании 180 г при сгорании 1 г Отсюда: Ответ: при сгорании 1 г глюкозы образуется 0,6 г воды.
Задача №2. Какая масса магния Mg вступает в реакцию с серной кислотой Решение. Запишем уравнение реакции и ту информацию, которую оно дает:
1 моль 1 моль 24 г 22,4 л 22,4 л 5,6 л Отсюда:
Ответ: 5,6 л
Если в условии задачи даются массы или объемы двух исходных веществ, то начинать решение этой задачи следует с выяснения того, какое исходное вещество дано в избытке, а какое – в недостатке.
Задача №3. Смешано 7,3 г Уравнение реакции: Решение. Определяем, какое вещество находилось в избытке, какое в недостатке. Для этого рассчитаем данное число молей
Уравнение реакции показывает, что 1 моль 1 моль 0,2 моль
Рассчитаем молярную массу
Рассчитаем, сколько граммов
Ответ: образуется 10.7 г
Задания для самостоятельной работы Решите представленные задачи, используя алгоритм решения.
1. Составьте уравнение реакции горения магния и вычислите массу оксида магния 2. В реакцию с водой вступило 28 г оксида кальция 3. Рассчитайте, какая масса кислорода образуется при разложении 54 г воды. 4. Рассчитайте массу оксида меди 5. В реакцию с азотной кислотой 6. Рассчитайте объем водорода (н.у.), образующегося при разложении 54 г воды. 7. Какой объем водорода (н.у) потребуется для полного восстановления меди из оксида меди 8. Составьте уравнение реакции горения фосфора (при этом получается оксид фосфора (V) Контрольные вопросы: 1. Как формулируется закон сохранения массы веществ? 2. Чем объясняется сохранение массы веществ в химических реакциях? 3. Что такое химическое уравнение? 4. Как называются числа перед формулами веществ в химических уравнениях? 5. Что показывают коэффициенты перед формулами веществ в уравнениях химических реакций? Рекомендуемая литература: 1.1 – 1.5, 2.1 -2.9
Практическое занятие № 2 Теоретический материал Химические реакции можно классифицировать по следующим признакам: изменению степени окисления атомов, входящих в состав реагирующих веществ (окислительно-восстановительные реакции); числу и составу исходных и образующихся веществ (реакции соединения, разложения, замещения, обмена); тепловому эффекту (экзотермические и эндотермические реакции); признаку обратимости (обратимые и необратимые реакции).
Лабораторное занятие №1 Теоретический материал Растворы играют важную роль в живой и неживой природе, а также в науке и технике. Большинство физиологических процессов в организмах человека, животных и в растениях, различных промышленных процессов, биохимических процессов в почвах и т.п. протекают в растворах. Раствор – это гомогенная многокомпонентная система, в которой одно вещество распределено в среде другого или других веществ. Растворы могут быть в газообразном (воздух), жидком и твердом (сплавы, цветные стекла) агрегатных состояниях. Чаще всего приходится работать с жидкими растворами. Содержание данного вещества в единице массы или объема раствора называется концентрацией раствора. На практике наиболее часто пользуются следующими способами выражения концентрации: 1. Массовая доля – отношение массы данного компонента в растворе к общей массе этого раствора. Массовая доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных долях (млнˉ1). Массовая доля данного компонента, выраженная в процентах, показывает, сколько граммов данного компонента cодержится в 100 г раствора. 2. Массовая концентрация – отношение массы компонента, содержащегося в растворе, к объему этого раствора. Единицы измерения массовой концентрации ‑ кг/м3, г/л. 3. Титр Т – число граммов растворенного вещества в 1 мл раствора. Единицы измерения титра – г/мл, кг/см3. 4. Молярная концентрация с – отношение количества вещества (в молях), содержащегося в растворе, к объему раствора. Единицы измерения - моль/м3, (моль /л). Раствор, имеющий концентрацию 1 моль/л, обозначают 1 М; 0,5 моль/л, обозначают 0,5 М. 5. Молярная концентрация эквивалентов с эк (нормальная концентрация) – это отношение количества вещества эквивалентов (моль) к объему раствора (л). Единица измерения нормальной концентрации моль/л. Например, с эк(KOH) = 1 моль/л, с эк(1/2H2SO4) = 1 моль/л, с эк(1/3 AlCl3) = 1 моль/л. Раствор в 1 л которого содержится 1 моль вещества эквивалентов, называют нормальным и обозначают 1 н. 6. Моляльность b - это отношение количества растворенного вещества (в молях) к массе m растворителя. Единица измерения моляльности - моль/кг. Например, b (HCl/H2O) = 2 моль/кг.
7. Молярная доля – отношение числа молей растворенного вещества к общему числу молей вещества и растворителя. Молярная доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных долях (млн-1). Для приготовления растворов определенной концентрации, для точного измерения объемов применяют мерную посуду: мерные колбы, пипетки и бюретки. Экспериментальная часть Опыт 1. Приготовление раствора хлорида натрия с заданной массовой долей соли (%) разбавлением концентрированного раствора. Как известно, плотность – это масса вещества в единице объема, ρ = m / v. Зная плотность, можно по таблице определить массовую долю (%) раствора. Определить плотность раствора можно многими способами. Из них наиболее простой и быстрый – с помощью ареометра. Его применение основано на том, что плавающее тело погружается в жидкость до тех пор, пока масса вытесненной им жидкости не станет, равна массе самого тела (закон Архимеда). В расширенной нижней части ареометра помещен груз, на узкой верхней части – шейке - нанесены деления, указывающие плотность жидкости, в которой плавает ареометр. Концентрацию исследуемого раствора находят, пользуясь табличными данными о плотности в зависимости от концентрации раствора. Плотность водных растворов хлорида натрия приведена в таблице 1. Выполнение опыта. В мерный цилиндр наливают раствор хлорида натрия и ареометром определяют его плотность. По таблице 1 находят концентрацию исходного раствора [в % (масс) ]. Таблица 1 – Плотность и процентное содержание растворов хлорида натрия
Рассчитывают, сколько миллилитров исходного раствора и воды следует взять для приготовления 250 мл 5% раствора. Воду отмерить цилиндром и вылить в мерную колбу объемом 250мл. Исходный раствор поваренной соли отмеряют цилиндром на 100 мл и вливают в колбу с водой. Раствор в колбе перемешивают. Цилиндр ополаскивают небольшим объемом раствора из колбы, который затем присоединяют к общей массе раствора в колбе. Проверить плотность и концентрацию полученного раствора. Рассчитать относительную ошибку δотн
где С – заданная концентрация, С 1- полученная концентрация. Сделайте расчет молярной концентрации молярной концентрации эквивалентов и титра, приготовленного раствора. Результаты запишите в таблицу 2. Таблица 2 – Опытные данные
Пример 1. Приготовить 0,5 л 20% раствора H2SO4, исходя из концентрированного раствора, плотность которого 1,84 г/см3. По таблице находим, что плотности 1,84 г/см3 соответствует кислота с содержанием 96% H2SO4, а 20% раствору соответствует кислота с плотностью 1,14 г/см3. Вычислим количества исходной кислоты и воды, требующиеся для получения заданного объема раствора. Масса его составляет 500 Вычислим, в каком объеме исходной 96% кислоты содержится 114 г H2SO4: 1 мл исходной кислоты содержит Таким образом, для приготовления 500мл 20% раствора H2SO4 необходимо взять 64,6 мл 96% раствора. Количество воды определяется как разность весов полученного исходного раствора, а именно Опыт 2. Приготовление раствора заданной концентрации смешиванием растворов более высокой и более низкой концентрации. Раствор можно готовить, непосредственно вводя рассчитанное количество вещества в растворитель, или путем разбавления более концентрированных растворов до требуемого значения концентрации.
Пример 2. Приготовить 100г 36% раствора H3PO4, смешав 44% и 24% растворы этой кислоты. Обозначим через х количество граммов 44% раствора, которое следует добавить к (100-х) граммам 24% раствора для получения 100г 36% раствора H3PO4. Составим уравнение: откуда Следовательно, необходимо взять 60г 44% раствора Выполнение опыта. Приготовить 250 мл 10 % раствора хлорида натрия, имея в своем распоряжении 15 % и 5 % раствор NaCl. Учитывая плотности приготовляемого и исходных растворов рассчитать объемы 15 % и 5 % раствора (см. пример 2). Отмерить вычисленные объемы исходных растворов, слить в колбу на 250 мл, закрыть колбу пробкой и тщательно перемешать раствор, перевернув колбу несколько раз вверх дном. Отлить часть раствора в цилиндр, измерить ареометром плотность приготовленного раствора и по табл.1 найти его концентрацию (в %). Установить расхождение практически полученной концентрации с заданной. Рассчитать относительную ошибку δотн. Опыт 3. Приготовление водного раствора хлорида натрия. определение массовой доли и расчет навески. Получить навеску соли хлорида натрия у преподавателя. При помощи воронки перенести данную навеску в мерную колбу емкостью 250 мл. Промывалкой обмыть внутреннюю часть воронки небольшим количеством воды. Растворить соль в воде. Затем, добавляя воду небольшими порциями, довести уровень воды в колбе до метки, закрыть колбу пробкой и тщательно перемешать, переворачивая вверх дном. Замерить плотность полученного раствора ареометром. Для этого раствор перелить в мерный цилиндр. Уровень жидкости должен быть ниже края цилиндра на 3-4 см. Осторожно опустите ареометр в раствор. Ареометр не должен касаться стенок цилиндра. Отсчет плотности по уровню жидкости производите сверху вниз. По таблице 1 найдите и запишите массовую долю (в %) раствора, отвечающую этой плотности. Рассчитать количество хлорида натрия взятого для приготовления 250 мл раствора.
Пример 3. Пусть плотность приготовленного раствора хлорида натрия ρ=1,0053г/см3. Это соответствует 1% концентрации раствора. Следовательно, в100г раствора содержится 1г NaCl. Определим массу 250 мл раствора Исходя из того, что в 100г раствора содержится 1г NaCl, узнаем, сколько грамм NaCl содержится в 201,315г раствора: 100 г раствора - 1 г NaCl 201,315 г раствора - х г NaCl х = Таким образом, была взята навеска NaCl массой 2,0131 г.
Контрольные вопросы: 1. Что такое разбавленный раствор; концентрированный раствор? 2. Что называется массовой долей растворенного вещества? По какой формуле рассчитывается? 3. Что показывает молярная концентрация раствора? По какой формуле рассчитывается? Рекомендуемая литература: 1.1 – 1.5, 2.1 -2.9 Лабораторное занятие №2 Теоретический материал Практически каждое неорганическое вещество можно определить с помощью характерных реакций. Эти реакции называются качественные. Принадлежность неорганического вещества к определенным классам соединений, их строение, степень чистоты устанавливаются с помощью элементного и функционального анализа. Качественный элементный анализ позволяет определить качественный состав молекул неорганического соединения; количественный элементный анализ устанавливает элементный состав соединения и простейшую формулу. Структура неорганического соединения может считаться окончательно доказанной, если осуществлен встречный синтез; проведен систематический химический анализ, включающий в себя: предварительные испытания, качественные реакции на функциональные и нефункциональные группы, получены различные производные; проведены спектральные методы анализа. Функциональный анализ и идентификация неорганических веществ начинаются с предварительных испытаний, включающих в себя: определение физических констант, пробу на сожжение, растворимость в воде и органических растворителях, качественный анализ. Принадлежность к классам неорганических веществ можно установить по их отношению к реагентам Опыт №1. Взаимодействие щелочных металлов с водой. Налить в фарфоровую чашку немного воды, опустить в нее кусочек натрия и быстро накрыть чашку воронкой. После окончания реакции прилить к полученному раствору 2-3 капли фенолфталеина. Составить уравнения протекающих реакций и сделать вывод относительно свойств щелочных металлов.
Опыт №2. Действие воды на металлический магний. Поместить в пробирку стружку металлического магния. Добавить немного воды и 2-3 капли фенолфталеина. Обратить внимание на то, что цвет практически не изменится. Затем следует нагреть пробирку. Отметить изменение окраски раствора. Сделать вывод относительно щелочных свойств магния и написать уравнения протекающих реакций. Опыт №3. Амфотерность металлического алюминия. Поместить кусочек металлического алюминия в пробирку, прилить немного воды и 2-3 капли фенолфталеина. Убедиться в том, что ни в обычных условиях, ни при нагревании алюминий с водой не взаимодействует. Затем поместить в две другие пробирки по кусочку алюминия. В одну из них прилить разбавленную соляную кислоту, в другую – раствор крепкой щелочи NaOH. Пробирки нагреть. При этом наблюдается взаимодействие алюминия, как с кислотой, так и со щелочью. Написать уравнения протекающих реакций и сделать вывод о свойствах алюминия. Опыт №4. Неметаллические свойства серы. Кусочек серы поместить в пробирку и налить немного воды. Прибавить сначала 2-3 капли фенолфталеина, а затем столько же метилоранжа. Отметить, что сера не взаимодействует с водой в обычных условиях. Нагреть пробирку. Отметить что после нагревания взаимодействие серы с водой не происходит. Кусочек серы положить на железную ложечку, поджечь и опустить в коническую колбу, в которой было налито немного воды (не касаясь поверхности воды). После сгорания серы закрыть колбу пробкой и встряхнуть. Полученный раствор разделить на 3 пробирки и испытать различными индикаторами.
Опыт №5. Амфотерные свойства гидроксида олова (II). Поместить в пробирку 8-10 капель раствора Экспериментальная часть 1 этап. Проведите анализ состава каждого вещества Оборудование и реактивы.
фенолфталеин, гидроксид натрия, синяя лакмусовая бумажка, нитрат серебра, хлорид бария, пробирки. 2 этап. Выберите пути распознавания веществ. При помощи, каких реактивов вы будете определять эти вещества. 3 этап. Определите последовательность ваших действий. 4 этап. Правила ТБ. 5 этап. Выполнение экспериментальной части. Результаты работы внесите в таблицу 3. Таблица 3 – Результаты работы
6 этап. Сделайте вывод, используя ПОПС – формулу. «Я считаю, что…….» «Потому, что………»
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 494; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.64.210 (0.011 с.) |

 цикловой комиссии
цикловой комиссии 

 (для молекул)
(для молекул)  , (для атомов)
, (для атомов)  .
. , (1)
, (1) , (2)
, (2) - молярный объем, л/моль.
- молярный объем, л/моль. . (3)
. (3) . (4)
. (4) , если реакция протекает по схеме:
, если реакция протекает по схеме:

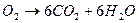
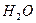 ;
;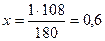
 , если в результате реакции выделяется 5,6 л водорода
, если в результате реакции выделяется 5,6 л водорода  при н.у.?
при н.у.?
 ;
;
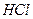 с 4,0 г
с 4,0 г  . сколько г
. сколько г 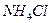 образуется?
образуется?

 значит 0,2 моль
значит 0,2 моль  моль
моль  (
( =
=  .
. (
(
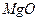 , который получится при сгорании 6 г металла.
, который получится при сгорании 6 г металла. . Рассчитайте массу образовавшегося вещества.
. Рассчитайте массу образовавшегося вещества. , образующегося при разложении 49 г гидроксида меди
, образующегося при разложении 49 г гидроксида меди  .
. вступило 20 г гидроксида натрия
вступило 20 г гидроксида натрия  . Рассчитайте массу образовавшейся соли.
. Рассчитайте массу образовавшейся соли. ) и вычислите, хватит ли 10 г кислорода на сжигание 6,2 г фосфора.
) и вычислите, хватит ли 10 г кислорода на сжигание 6,2 г фосфора.
 1,14 = 570 г, а содержание в нем H2SO4 равно
1,14 = 570 г, а содержание в нем H2SO4 равно г.
г. г H2SO4
г H2SO4 х мл исходной кислоты содержит 114 г H2SO4
х мл исходной кислоты содержит 114 г H2SO4 мл
мл мл
мл

 и 100 - х = 40г 24% раствора.
и 100 - х = 40г 24% раствора.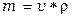

 г NaCl
г NaCl , добавить несколько капель
, добавить несколько капель 



