
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общие правила проведения лабораторных работСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Общие правила проведения лабораторных работ Каждому работающему в лаборатории предоставляется место, которое необходимо содержать в порядке и чистоте. Запрещается загромождать рабочее место лишними предметами. При выполнении лабораторных работ следует строго соблюдать определенные правила. 1. Перед занятиями необходимо заранее ознакомиться с ходом работы по учебному пособию, уяснить цели и задачи, обдумать каждое действие. Приступать к выполнению работы можно только после сдачи предварительного отчета (краткого описания хода эксперимента) и собеседования. О допуске к работе в лаборатории ведущий преподаватель делает отметку в рабочем журнале. 2. Работающий должен знать основные свойства используемых и получаемых веществ, их действие на организм, правила работы с ними и на основе этого принять все меры для безопасного проведения работ. 3. Запрещено проводить эксперимент в грязной посуде, а также пользоваться веществами из склянок без этикеток или с неразборчивой надписью. 4. Нельзя выливать избыток реактива из пробирки обратно в реактивную склянку. Сухие соли набирают чистым шпателем или ложечкой. 5. Нельзя путать пробки от разных склянок. Чтобы внутренняя сторона пробки оставалась чистой, пробку следует класть на стол внешней поверхностью. 6. Нельзя уносить реактивы общего пользования на рабочее место. 7. Выполнение лабораторной работы и каждого отдельного эксперимента требует строгого соблюдения всех указаний, содержащихся в описании работы. Эксперимент следует проводить тщательно, аккуратно и без спешки. 8. Запрещается без разрешения преподавателя проводить какие-либо опыты, не относящиеся к данной работе, или изменять их последовательность. 9. Если работа не может быть закончена за одно занятие, то необходимо заранее обсудить с преподавателем, на каком этапе работа должна быть прервана и когда можно будет ее закончить. Правила техники безопасности При работе в химической лаборатории соблюдают основные правила техники безопасности. 1. В лаборатории категорически запрещается работать одному, так как даже небольшая незамеченная неисправность оборудования или ошибка в выполнении эксперимента может привести к тяжелым последствиям.
2. Необходимо избегать лишних движений и разговоров в лаборатории, непосредственных контактов кожи, глаз и дыхательных путей с реактивами. На занятиях следует постоянно носить лабораторный халат. 3. Все работы с ядовитыми и сильнопахнущими веществами, с концентрированными растворами кислот, щелочей, а также упаривание их растворов следует проводить только в вытяжном шка-фу. Створки шкафа во время работы должны быть опущены до 18 — 20 см от его рабочей поверхности. 4. Измельчение твердых веществ, дающих едкую пыль (извести, иода и др.), разбавление концентрированных кислот и щелочей, приготовление хромовой смеси нужно проводить в фарфоровой посуде в вытяжном шкафу, защитив глаза очками, а руки перчат-
5. С легковоспламеняющимися жидкостями нельзя работать вблизи нагревательных приборов. Запрещается нагревать летучие легковоспламеняющиеся вещества на открытом пламени. Для этого необходимо использовать водяную или масляную баню. 6. Пробирки при нагревании закрепляют либо в штативной лапке, либо в пробиркодержателе ближе к отверстию. Отверстие пробирки необходимо направлять от себя и окружающих во избежание поражения при выбросе веществ из пробирки. 7. Отбирать в пипетку любые вещества следует, пользуясь только сифоном или резиновой грушей. 8. Особенно внимательно нужно проводить сборку установок из стекла. Нельзя зажимать стеклянные изделия в лапки штативов без соответствующей мягкой подкладки. Особенно осторожно следует обращаться с тонкостенной посудой, термометрами, холодильниками. 9. В лаборатории запрещается принимать пишу, курить.
10. Нельзя класть на лабораторные столы посторонние предметы, а также находиться в лаборатории в верхней одежде. 11. О любом происшествии в лаборатории, даже самом незначительном, необходимо сообщить преподавателю или лаборанту. ЛАБОРАТОРНАЯ МЕБЕЛЬ Вхимических лабораториях все работы проводят на рабочих столах специальной конструкции, которая зависит от характера работ. Используют также сборные лабораторные столы, это позволяет моделировать их в зависимости от необходимости. Лабораторные столы, как правило, располагают у стен. Ящики лабораторного стола должны быть обозначены надписями. Посуду и инвентарь следует хранить в строгом порядке.
Необходимо соблюдать правила содержания лабораторного стола. Не загромождать его, содержать в чистоте. По окончании работы необходимо привести в порядок лабораторный стол. Для работы в лаборатории используют специальные лабораторные табуреты или стулья. Для установки приборов, сушильных шкафов, муфельных печей необходимы столы со специальным покрытием. Специальные столы необходимы также для весовых помещений и установок для титрования. Различают следующие виды лабораторных столов: пристенные (с полками, с полками и дверцами), приборные (с блоком розеток), приставки, с мойками, островные, весовые, вспомогательные, тумбы. Рабочими поверхностями столов наиболее часто служат: • ламинированная плита, стойкая к кратковременному воздействию концентрированных кислот, щелочей и органических растворителей. Выдерживает кратковременное воздействие повышенных температур до 170 °С; • нержавеющая сталь с бортиками, стойкая к кратковременному действию концентрированных кислот (кроме соляной), щелочей и органических растворителей; легко моется; • керамическая плита (из специальной лабораторной керамики), стойкая к действию концентрированных кислот (кроме плавиковой), щелочей и органических растворителей, а также высоких температур; • столешница из композиционного материала на основе эпоксидных смол (Durcon), особо стойкого к большинству химических реактивов, кислот, щелочей, растворителей, при длительном термоконтакте, негигроскопичного, не подверженного возгоранию, повышенно устойчивого к механическим воздействиям по сравнению с обычной керамикой. Выдерживает температуры до 300 °С;
Каркас большинства лабораторных столов из стальной профильной трубы покрыт химически стойкой эпоксидной порошковой краской. Нерабочие поверхности могут быть изготовлены из стального листа, покрытого эпоксидной краской, либо из других материалов (меламин и др.). ЛАБОРАТОРНАЯ ПОСУДА, МЕТАЛЛИЧЕСКОЕ ОБОРУДОВАНИЕ, ЛАБОРАТОРНЫЙ ИНСТРУМЕНТ Стеклянная посуда Посуда общего назначения — постоянно имеющаяся в лаборатории для проведения большинства работ — пробирки, воронки простые и делительные, химические стаканы, плоскодонные колбы, кристаллизаторы, конические колбы, колбы Бунзена и др. Посуда специального назначения — использующаяся для определенных целей (например, аппарат Киппа — для получения водорода, склянки Тищенко — для высушивания газов, пикнометры — для определения плотности). Мерная посуда — мерные цилиндры и колбы, мензурки, пипетки, бюретки. Основные требования, предъявляемые к лабораторным изделиям из стекла — химическая и термическая стойкость: к разрушающему действию воды, щелочей и кислот, к резким колебаниям температуры. Мерой термической стойкости стекла является максимальная разность температур, которую оно выдерживает, не разрушаясь. Кварцевое стекло инертно к действию большинства химических реагентов. Органические и минеральные кислоты (за исключением плавиковой и фосфорной) не влияют на него.
Посуда общего назначения. Пробирки — цилиндрические сосуды разных размеров со скругленным дном. Различают простые, градуированные, остродонные пробирки (рис. 1.1). Последние часто применяют для проведения капельных реакций в полумикроанализе. Для размещения пробирок используют штативы. Воронки служат для переливания жидкостей, пересыпания твердых веществ, для фильтрования. Воронки для фильтрования всегда изготовляют с углом 60° и срезанным длинным концом. Химические воронки выпускают разных форм, типов и размеров (рис. 1.2). Делительные воронки (рис. 1.3, а, б) применяют для разделения несмешивающихся жидкостей. Капельные воронки (рис. 1.3, в)
отличаются от делительных тем, что они, как правило, имеют меньший объем и более длинный конец. Их применяют при работах, когда вещество добавляют в реактор небольшими порциями. Перед работой с делительной или капельной воронкой шлиф стеклянного крана необходимо смазать глицерином или вазелином.
Химические стаканы — тонкостенные цилиндры разной емкости из термо- и химически стойкого стекла (рис. 1.4). Колбы. Плоскодонные колбы выпускают разной емкости со шлифом и без шлифа на горлышке. Различают круглые и конические плоскодонные колбы. Конические колбы (Эрленмейера) широко используют в аналитической практике при объемном анализе (рис. 1.5, а). Для фильтрования под вакуумом используют толстостенные конические колбы с отводом (колбы Бунзена, рис. 1.5, б), к которому присоединяют водоструйный насос для создания разряжения (рис. 1.6). В горлышко колбы помещают специальную воронку с отверстиями (воронка Бюхнера) со вставленным в нее фильтром (рис. 1.7). Холодильники прямые (Либиха), обратные (шариковые, змееви-ковые и т.д.) (рис. 1.8) применяют для охлаждения и конденсации паров при перегонке (ректификации). Обратные холодильники устанавливают только в вертикальном положении. Посуда специального назначения. Колбы. Круглодонные колбы разной емкости, со шлифом на горлышке и без него (рис. 1.9) применяют для нагревания жидкостей. Для перегонки жидкостей используют специальные колбы для дистилляции (рис. 1.10). Двух- и трехгорлые колбы особенно удобны, когда в процессе перегонки необходимо добавление какого-либо вещества или присоединения дополнительного оборудования. Переходники и аллонжи (рис. 1.11) используют для подсоединения к установке для дистилляции термометров, холодильников, приемников, мешалок и т.д.
Эксикаторы применяют для медленного охлаждения и хранения гигроскопичных веществ (рис. 1.12). Эксикаторы закрывают крышками, края которых притерты к верхней части цилиндра. В эксикатор помещают осушитель и фарфоровую вкладку, на которую ставят сосуд с веществом. Вакуум-эксикаторы (рис. 1.12, б) в крышке имеют кран для соединения с вакуумным насосом. Промывалки (рис. 1.13) и склянки Тищенко используют для очистки и осушки газов. Капельницы (рис. 1.14) — сосуды для жидкостей, расходуемых по каплям. В них чаще всего хранят растворы индикаторов и органических реагентов. Мерная посуда. Мерные цилиндры, мензурки — стеклянные толстостенные сосуды с делениями на наружной стенке, указывающими объем в миллилитрах (рис. 1.15). Пипетки для жидкостей (пипетки Мора) — стеклянные трубки определенного объема — от 1 до 100 мл. В градуированных пипетках нанесены деления с ценой 0,1 мл (рис. 1.16). Применяют пипетки в аналитической химии для точного отбора проб. Для заполнения пипетки следует применять резиновую «грушу». Жидкость набирают так, чтобы она поднялась на 2 — 3 см выше метки, затем быстро закрывают верхнее отверстие указательным пальцем пра-
вой руки, придерживая пипетку большим и средним пальцами. Объем пипетки равен объему пробы до метки по нижнему мениску. Специальными пипетками отбирают вредные, ядовитые жидкости. Обычными пипетками можно отмерять жидкости, плотность которых немного отличается от плотности воды. Пипетки должны быть всегда чисто вымыты, хранить их надо в специальных штативах. После работы пипетку несколько раз ополаскивают дистиллированной водой. Дозаторы используют для отбора малых объемов жидкостей емкостью от нескольких микрометров до нескольких миллилитров. Они могут быть как фиксированного, так и изменяемого объема. Бюретки применяют для титрования, измерения точных объемов. Объемные бюретки — стеклянные трубки с краном или вытянутым нижним концом. На наружной стенке бюретки по всей длине нанесены деления с ценой 0,1 мл (рис. 1.17). Бюретку устанавливают на лабораторных штативах (рис. 1.18) в лапках или специальных держателях. После работы бюретку промывают водой и помещают в штатив, перевернув открытым концом вниз. У бюреток с краном нужно вынуть кран, обернуть фильтровальной бумагой и снова вставить в бюретку. Бюретки заполняют жидкостью через воронку, затем заполняют часть бюретки ниже крана или зажима, чтобы удалить пузыри воздуха. Уровень жидкости в бюретке устанавливают по ее нижнему мениску. Иногда применяют бюретки с автоматической установкой уровня. В таких бюретках титрованный раствор поднимается до верхней метки, а избыток его сливается обратно в бутыль через специальную отводную трубку. Если требуется получить очень точные результаты, в бюретку помещают стеклянный поплавок, увеличивающий точность отсчета уровня жидкости.
Цена деления микробюреток 0,01 мл. Для их заполнения закрывают основной кран и открывают кран на боковой трубке. Когда жидкость заполнит микробюретку выше нулевой отметки, боковой кран закрывают, осторожно открывают сливной кран и устанавливают уровень жидкости точно на нулевой отметке.
Мерные колбы — необходимая для аналитических работ посуда. Это стеклянные плоскодонные колбы разной емкости с притертыми стеклянными или тщательно подобранными резиновыми или полиэтиленовыми пробками (рис. 1.19). Мерные колбы изготовляют узкогорлыми и широкогорлыми. На горле колбы имеется кольцевая метка, до которой необходимо довести уровень раствора, чтобы получить требуемый объем, указанный непосредственно на колбе в миллилитрах. Мерные колбы используют для приготовления растворов точной концентрации. Для приготовления раствора сначала в колбу количественно переносят растворяемое вещество, затем наполняют ее водой до половины, осторожно перемешивают до полного растворения и доводят водой до метки. Последние капли растворителя добавляют осторожно, из пипетки. Нагревание мерных колб недопустимо. Раствор в колбе нужно осторожно перемешать многократным переворачиванием, предварительно убедившись в том, что колба плотно закрыта пробкой. Градуировка мерной посуды. Химическую посуду градуируют следующим образом: в мерную колбу (пипетку) набира- ют дистиллированную воду до метки, а затем взвешиванием на аналитических весах определяют массу жидкости. Пользуясь справочными данными о плотности воды при разных температурах, I рассчитывают объем взвешенной жидкости. После этого необходимо пересчитать объем жидкости к объему, ею занимаемому при температуре 20 "С. Следует учитывать, что химическое стекло при изменении температуры расширяется или сжимается. Результаты взвешивания также необходимо корректировать, так как в процессе взвешивания на навеску действует сила Архимеда, несколько уменьшающая результат взвешивания. Такая же сила действует и на гири весов. В итоге возникает ошибка взвешивания, которую необходимо учесть. На плечо весов, помимо силы тяжести навески массой На гири весов действует сила— масса и объем гирь весов. Поскольку коромысло весов находится в положении равновесия, то справедливо следующее равенство:
или
где рг — плотность материала гирь. Обычно делают расчет для латунных гирь Продолжая преобразования, получим объем навески воды:
Необходимо учесть изменение плотности воздуха и гирь с температурой: где г— температура окружающего воздуха. ный коэффициент расширения латунных гирь; р^° — плотность материала гирь при 20 "С. Для воздуха:
где давление, мм рт. ст; В табл. 1.2 приведены объемы 1000 г воды при разных температурах, давлениях и поправки на температурное расширение стекла и воды.
Фарфоровая посуда по сравнению со стеклянной более прочная и термостойкая. В ней можно выпаривать растворы досуха и сжигать вещества Корундизовые изделия (с корундовым черепком) предназначены для лабораторных плавок металлов (до 1800 °С). Устойчивость фарфора к кислым и щелочным средам также выше, чем у стекла. Однако в фарфоровой посуде нельзя проводить сплавление со щелочами и работать с плавиковой кислотой. В лабораторной практике используют: фарфоровые стаканы (тех же видов и емкостей, что и стеклянные); тигли (рис. 1.20, а); вы-паривательные чашки (рис. 1.20, б); ступки (рис. 1.20, в) для измельчения твердых веществ. Тигли для прокаливания выпускают разных размеров по высоте и диаметру. Их применяют для прокаливания, сжигания неорганических и органических веществ. Если приходится работать с большим количеством тиглей, то их нумеруют специальной краской. Воронки Бюхнера имеют в основании перегородку с отверстиями. Их применяют совместно с колбой Бунзена для фильтрования под вакуумом. ПРАВИЛА БЕЗОПАСНОСТИ РАБОТЫ При выборе насоса необходимо учитывать характеристику сети, т. е. трубопровода и аппаратов, через которые будет перекачиваться жидкость. Данные расчеты проводят инженеры-технологи, механики на стадии проектирования предприятия, лаборатории. Насос должен быть выбран так, чтобы обеспечить требуемую производительность и наибольший КПД. При работе с насосами следует выполнять правила техники безопасности. Порядок пуска насоса, выхода на рабочий режим, остановки насоса проводится строго по инструкции. В лабораторной практике для проведения многих операций — фильтрования с отсасыванием, вакуумной перегонки, сушки в вакууме требуется создать разрежение. Для этого используют водоструйные насосы, позволяющие получать разрежение в пределах 0,8 — 2,6 кПа (6 — 20 мм рт. ст.); механические вакуумные насосы (масляные насосы) разных типов применяют для достижения остаточного давления 70—400 Па (0,5 — 3,0 мм рт. ст.). Для работ, требующих высокого вакуума порядка 0,133 — 0,133- 10-2 Па (10-3— 10-5 мм рт. ст.) используют диффузионные паромасляные и парор-тутные насосы. Опасность работы с вакуумными системами связана с возможностью взрыва стеклянной аппаратуры. Последствиями взрывов вакуумных установок могут быть не только травмы, но и попадание в атмосферу горючих и ядовитых, едких веществ.
1) любые работы, связанные с использованием вакуума, следует проводить в защитных очках или маске; 2) вся вакуумная установка должна быть экранирована проволочной сеткой или органическим стеклом. Вакуум-эксикаторы и колбы Бунзена перед работой помещают в специальные матерчатые чехлы или обвертывают полотенцем; 3) все стеклянные детали вакуум-установки нужно предварительно проверить; должны отсутствовать трещины, пузыри и другие видимые дефекты. Шлифы и краны необходимо тщательно очистить и смазать тонким слоем вакуумной смазки; 4) цельнопаянные высоковакуумные установки должны изготовлять квалифицированные мастера-стеклодувы; 5) для сборки вакуумных установок нельзя использовать плоскодонные колбы и склянки, не предназначенные для работ при пониженном давлении; 6) перед началом работы вновь собранную установку необходимо испытать на герметичность и прочность при максимальном рабочем разрежении, приняв меры предосторожности; 7) при необходимости нагрева или охлаждения частей установки следует сначала создать необходимое разрежение, а затем осторожно вести нагрев или охлаждение. Запрещается обогревать стеклянные детали работающей вакуумной установки открытым пламенем. Категорически запрещается использовать для охлаждения жидкий кислород или жидкий воздух. Контрольные вопросы 1. Дайте классификацию насосов. 2. Какие приборы испытывают для измерения избыточного и остаточного давления? 3. Расскажите о правилах техники безопасности при работе с системами повышенного давления и вакуума. Глава 5 ОСНОВНЫЕ ЛАБОРАТОРНЫЕ ОПЕРАЦИИ 5.1. ИЗМЕЛЬЧЕНИЕ И СМЕШИВАНИЕ Твердые вещества измельчают вручную или механически. Для ручного измельчения твердых веществ используют ступки: стальные, чугунные, латунные, фарфоровые, агатовые. Выбор ступки зависит от твердости вещества и его химических свойств. Твердость материала ступки должна быть больше твердости измельчаемого вещества. Агатовые ступки бывают разных размеров и рассчитаны на измельчение от 0,1—5,0 г вещества. Они обладают большой твердостью и служат очень долго. Фарфоровые ступки (см. рис. 1.20, в) широко применяют при измельчении большинства веществ. Перед работой ступку хорошо моют и высушивают. Вещество, которое необходимо измельчить, насыпают в ступку на треть ее объема. Пестиком разбивают крупные куски, затем растирают круговыми движениями. Во время измельчения вещество счищают со стенок ступки и с пестика шпателем. Измельченное до заданной степени дисперсности вещество переносят в банку или в реактор. Ступку и пестик после работы моют. Если внутренняя сторона ступки и пестика не очищается, то в ступке растирают немного поваренной соли, а затем удаляют. Если это не помогает, то ступку обрабатывают разбавленной соляной кислотой, затем обмывают водой и сушат. Пылящие и вредные вещества измельчают в вытяжном шкафу, закрыв ступку чехлом. Для механического измельчения твердых веществ используют дробилки разных модификаций, например, щековые, молотковые, валковые. Для более тонкого измельчения применяют шаровые мельницы. Шаровая мельница — закрытый фарфоровый или металлический барабан с фарфоровыми или стальными шарами определенного диаметра. Твердое вещество в шаровой мельнице измельчается и перемешивается во время вращения мельницы на валках. В мельницу нельзя загружать слишком много вещества, так как это затруднит движение шаров, но и малое количество измельчаемого вещества загружать невыгодно.
Для измельчения вещества до частиц размером 1,0 — 0,1 мкм используют коллоидные мельницы и вибромельницы. Последние бывают периодического и непрерывного действия, для сухого и мокрого помола и способны измельчать вещества до частиц размером 1 мкм. Для измельчения веществ, которые могут налипать на детали мельниц, используют вихревые мельницы. Принцип ее работы — удар струи жидкости о поверхность измельчаемого вещества. Весьма распространенными являются струйные мельницы. Частицы вещества, подлежащего измельчению, подхватываются встречными струями газа (воздуха или инертного газа), движущимися с большой скоростью. При столкновении частицы соударяются и измельчаются. В сепараторе частицы разделяются: мелкие собираются в сборник, а крупные поступают на повторное измельчение. Смешивание — один из наиболее часто используемых в лабораторной практике приемов. Механическое смешивание твердых веществ можно проводить в ступках, шаровых мельницах и смесителях с одновременным истиранием. Жидкости смешивают вручную и механически. При смешивании малых объемов применяют стеклянные палочки, вращая их по часовой стрелке. При перемешивании в колбе ее вращают или переворачивают. Для смешивания жидкостей используют цилиндры с пробками. Объем жидкости для смешивания должен составлять не более 3/4 емкости цилиндра. При смешивании органических веществ с низкой температурой кипения необходимо периодически открывать пробку цилиндра для удаления избыточного давления, создаваемого парами легколетучих веществ. Для механического перемешивания используют мешалки с электроприводом и электромагнитные мешалки. Форму мешалок выбирают с учетом вязкости жидкости. Принцип действия электромагнитной мешалки заключается в том, что на дно сосуда (реактора) помещают якорь, запаянный в стеклянную или полимерную ампулу, и электромагнит приводит в движение ампулу с необходимой скоростью вращения. Электромагнитные мешалки могут быть с подогревом и без. Иногда перемешивают жидкости в режиме барботажа, т. е. пропуская через них воздух или инертный газ под небольшим давлением. Барботирование воздухом можно применять лишь в том случае, если он не взаимодействует с жидкостью. Перемешивание гомогенных и гетерогенных сред широко применяют в химической промышленности для приготовления эмульсий, суспензий и растворов, а также для интенсификации химических процессов. Приготовление растворов Приготовление растворов заданной концентрации начинается с расчетов, затем взвешивания навески, переноса навески в мерную колбу, разбавления, перемешивания и доведения раствора до метки. Например, необходимо приготовить 1 л 1 М раствора (106,0000 г) мерную колбу, затем в колбу наливают дистиллированную воду на 2/з объема. Закрывают колбу пробкой и растворяют соль при перемешивании. Нагревание мерных колб для ускорения растворения навесок не допускается, так как приводит к изменению их нормированного объема (даже после охлаждения). Затем объем раствора доводят до 1 л, аккуратно добавляя дистиллированную воду до мет-
Для приготовления растворов с процентной концентрацией рассчитывают массу растворяемого вещества и массу растворителя. Пример. Сколько необходимо взять соли и воды для приготовления 1,5 кг 10%-го раствора хлорида натрия? Расчет проводят по пропорции: 100:10 = 1500:х, откуда х = = 1500-10/100= 150 г. Таким образом, соли нужно взвесить 150 г, а воды нужно взять 1500 - 150 = 1350 г. Если требуется получить 1,5 л того же раствора, то узнают плотность раствора из справочных таблиц и рассчитывают массу 1,5 л раствора хлорида натрия. Плотность 10%-го раствора NaCl равна 1,174 г/см3, масса 1500-1,174 = 1761 г, и тогда из пропорции 100:10 = 1761 :х раствора определяют
Следовательно, для приготовления 1,5 кг и 1,5 л раствора требуются разные количества вещества. Массу кристаллогидрата рассчитывают с учетом кристаллизационной воды. Пример. Сколько граммов Na2S04- 10H2O необходимо взять для приготовления 1 кг 10%-го раствора Na2S04. Молярная масса Na2S04 равна 142,04 г/моль, a Na2S04- 10H2O составляет 322,20 г/моль. Расчет ведут сначала на безводную соль по пропорции 100:10 = = 1000: х:
Массу кристаллогидрата находят из пропорции 142,04:322,20 = = 100:х:
Воды в этом случае нужно взять:
Готовить и разбавлять растворы веществ можно в мерной посуде (химические стаканы с делениями, мерные бутыли). Так готовят растворы с приблизительной концентрацией. Для приготовления растворов с точной концентрацией используют мерные колбы и химически чистые (х.ч.) реактивы. При необходимости точную концентрацию раствора определяют объемным методом, используя известное из курса аналитической химии уравнение для закона эквивалентов:
где Для быстрого приготовления растворов веществ (кислот, щелочей, солей) с точной концентрацией применяют фиксаналы — стеклянные ампулы, запаянные с двух сторон, содержащие вещества, необходимые для приготовления 1 л растворов с молярной концентрацией эквивалента, указанной на ампуле. Для приготовления раствора содержимое ампулы переносят в мерную колбу, наливают до половины ее объема дистиллированной воды и осторожно встряхивают до полного растворения вещества. После чего доводят объем до метки. В лабораторной практике приготовление растворов — одна из самых часто повторяющихся операций. Уметь рассчитать, правильно приготовить растворы неорганических и органических веществ — один из обязательных навыков, которым должен владеть химик. ЭКСТРАКЦИЯ И ВЫСОЛИВАНИЕ Экстракция (в системе жидкость—жидкость) — извлечение вещества, растворенного в жидкости другой жидкостью, практически не смешивающейся с первой. При этом извлекаемый компонент переходит из одной жидкой фазы в другую. Главная характеристика любого экстракционного процесса — коэффициент распределения, определяемый отношением концентрации экстрагируемого вещества в органической фазе к концентрации вещества в водной фазе после наступления равновесия:
Чтобы определить, какая часть вещества перешла в органическую фазу, следует пользоваться другой характеристикой — коэффициентом извлечения, равным доле вещества, перешедшей в органическую фазу. Существует связь между коэффициентом распределения и коэффициентом извлечения:
где Из уравнения видно, что чем больше объем органической фазы, тем больше коэффициент извлечения, т.е. тем больше вещества переходит в органическую фазу. Коэффициент извлечения является важным аналитическим параметром, так как при разработке аналитической методики всегда необходимо знать полноту извлечения определяемого вещества. Если нельзя полностью извлечь вещество за одну операцию, то это можно сделать гораздо эффективнее несколькими последовательными процедурами с меньшими суммарными затратами эк-страгента. Поясним сказанное на примере. Допустим, используется экстракционная система со следующими параметрами: денному уравнению коэффициент извлечения будет равен 0,8. Очевидно, что этот показатель мал. Чтобы хотя бы 99 % вещества перешло в органическую фазу надо взять не 1 мл экстрагента, а 25 мл. Подобного результата можно достичь, если провести трехкратную экстракцию, используя каждый раз свежую порцию экстрагента объемом 1 мл. Коэффициент суммарного извлечения процедуры можно рассчитать по уравнению:
где п — число экстракционных процедур. В рассматриваемом случае
Следует обратить внимание на то, что использование меньших объемов экстрагента предпочтительнее, так как концентрация анализируемого вещества в экстрагенте получается выше. Это важно для последующих аналитических операций. Говоря о коэффициенте распределения D как о константе, характеризующей свойства экстракционной системы, необходимо сделать важное уточнение. Коэффициент распределения постоянен только в том случае, если концентрация экстрагента существенно превосходит концентрацию экстрагируемого вещества, так как коэффициент распределения является частным случаем термодинамической константы равновесия. Рассмотрим общий случай, когда исследуемое вещество А образует соединение с несколькими молекулами экстрагента S в органической фазе:
Константа равновесия будет иметь следующий вид:
| |||||||||||||||||||||||
|
| Поделиться: |

 ками. Разбавляя концентрированные кислоты, особенно серную, осторожно вливают кислоту в воду, но не наоборот.
ками. Разбавляя концентрированные кислоты, особенно серную, осторожно вливают кислоту в воду, но не наоборот.




 • стеклопластик на основе эпоксидной смолы, стойкий к действию большинства реагентов. Выдерживает температуры до 180 °С.
• стеклопластик на основе эпоксидной смолы, стойкий к действию большинства реагентов. Выдерживает температуры до 180 °С.







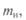 действует выталкивающая сила, равная весу воздуха
действует выталкивающая сила, равная весу воздуха 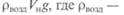 плотность воздуха;
плотность воздуха; 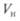 — объем навески;
— объем навески;  — ускорение свободного падения. Таким образом, вес навески будет составлять
— ускорение свободного падения. Таким образом, вес навески будет составлять 





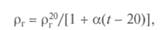
 — объем-
— объем-
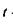 — температура окружающего воздуха,
— температура окружающего воздуха,  — атмосферное
— атмосферное — плотность воздуха в нормальных условиях.
— плотность воздуха в нормальных условиях.


 Фарфоровая посуда
Фарфоровая посуда

 Безопасность работы с вакуумными установками может быть обеспечена при соблюдении правил:
Безопасность работы с вакуумными установками может быть обеспечена при соблюдении правил:


 Для сухого и мокрого дробления и измельчения в открытом и замкнутом циклах хрупких материалов любой прочности и твердости: алмазов, твердых сплавов, керамики, стройматериалов, отходов электроники, компонентов лекарств, растительных материалов используют универсальные инерционные дробилки.
Для сухого и мокрого дробления и измельчения в открытом и замкнутом циклах хрупких материалов любой прочности и твердости: алмазов, твердых сплавов, керамики, стройматериалов, отходов электроники, компонентов лекарств, растительных материалов используют универсальные инерционные дробилки. (молярная масса
(молярная масса  равна 106г/моль). Взвешивают 1 моль
равна 106г/моль). Взвешивают 1 моль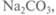 переносят с помощью воронки в литровую
переносят с помощью воронки в литровую
 ки по нижнему мениску. Колбу закрывают пробкой, снова перемешивают, делают надпись специальным карандашом по стеклу.
ки по нижнему мениску. Колбу закрывают пробкой, снова перемешивают, делают надпись специальным карандашом по стеклу.
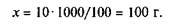
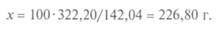


 — объем титрованного раствора (титранта), мл;
— объем титрованного раствора (титранта), мл;  — нормальность титрованного раствора (титранта);
— нормальность титрованного раствора (титранта); 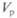 — объем рабочего раствора, мл;
— объем рабочего раствора, мл;  — нормальность рабочего раствора.
— нормальность рабочего раствора.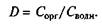

 — объем водной фазы;
— объем водной фазы;  — объем органической фазы.
— объем органической фазы. Согласно вышеприве-
Согласно вышеприве-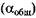 такой
такой
 так как
так как 
 Таким образом, вместо 25 мл мы использовали 3 мл.
Таким образом, вместо 25 мл мы использовали 3 мл.
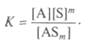



 Если воспользоваться уравнением для коэффициента распределения, то
Если воспользоваться уравнением для коэффициента распределения, то


