
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Виды концентраций. Приготовление растворовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Взависимости от растворителя различают водные и неводные растворы. Неводные растворы — это растворы веществ в органических растворителях. По точности выражения концентрации растворы делят на растворы приблизительной и точной концентрации. Массовая доля — отношение массы данного компонента системы к общей массе этой системы:
Часто массовую долю выражают в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных долях (млн-1). Молярная доля — отношение количества вещества (в моль) компонента, содержащегося в данной системе, к общему количеству вещества системы (в моль):
Молярная концентрация — отношение количества вещества л(Х), содержащегося в системе (например, в растворе), к объему системы V(X) и имеет размерность моль/м3 (в СИ) или, чаще, моль/л:
Молярность раствора записывается числовым значением молярной концентрации растворенного вещества в моль/л с последующей буквой М или словом «молярный». Например, 1 М или одномолярный раствор, 0,1 М или деци-молярный, 0,01 М или сантимолярный, 0,001 М или миллимо-лярный растворы. Еще пример. Масса моля серной кислоты равна 98,08 г, значит, в литре 1 М раствора серной кислоты содержится 98,08 г H2S04 , а в литре 0,1 М раствора — соответственно 9,808 г H2S04. Молярная концентрация эквивалента — отношение числа моль-эквивалентов в системе к объему этой системы:
где масса эквивалента вещества; Фактор эквивалентности стицы вещества Согласно рекомендации Международного союза теоретической и прикладной химии лент вещества мальным раствором этого вещества и обозначать символом «н.» с указанием Молярная масса эквивалента вещества X равна произведению фактора эквивалентности
Моляльная концентрация творенного вещества X (в молях) к массе т растворителя Y (в килограммах):
Термином моляльность предпочтительнее пользоваться в случае реакций, протекающих в неизотермических условиях. Массовая концентрация р(Х) — отношение массы компонента, содержащегося в системе (растворе), к объему этой системы (раствора). Для растворов: Плотность раствора — отношение массы раствора к его объему:
Связь между плотностью раствора, массовой долей и молярной концентрацией выражается уравнениями:
Титр раствора или 1 мл раствора:
На практике (г/мл). Связь между титром раствора и другими видами концентраций выражается уравнениями:
Титр раствора, г/мл, по определяемому компоненту (веществу) — отношение массы определяемого компонента (вещества)
показывает, какая масса определяемого компонента (вещества) X реагирует с 1 мл стандартного раствора реагента Y. Связь между титром по определяемому компоненту (веществу) и другими видами концентраций выражается уравнениями:
где уравнении реакции:
Приготовление растворов Приготовление растворов заданной концентрации начинается с расчетов, затем взвешивания навески, переноса навески в мерную колбу, разбавления, перемешивания и доведения раствора до метки. Например, необходимо приготовить 1 л 1 М раствора (106,0000 г) мерную колбу, затем в колбу наливают дистиллированную воду на 2/з объема. Закрывают колбу пробкой и растворяют соль при перемешивании. Нагревание мерных колб для ускорения растворения навесок не допускается, так как приводит к изменению их нормированного объема (даже после охлаждения). Затем объем раствора доводят до 1 л, аккуратно добавляя дистиллированную воду до мет-
Для приготовления растворов с процентной концентрацией рассчитывают массу растворяемого вещества и массу растворителя. Пример. Сколько необходимо взять соли и воды для приготовления 1,5 кг 10%-го раствора хлорида натрия? Расчет проводят по пропорции: 100:10 = 1500:х, откуда х = = 1500-10/100= 150 г. Таким образом, соли нужно взвесить 150 г, а воды нужно взять 1500 - 150 = 1350 г. Если требуется получить 1,5 л того же раствора, то узнают плотность раствора из справочных таблиц и рассчитывают массу 1,5 л раствора хлорида натрия. Плотность 10%-го раствора NaCl равна 1,174 г/см3, масса 1500-1,174 = 1761 г, и тогда из пропорции 100:10 = 1761 :х раствора определяют
Следовательно, для приготовления 1,5 кг и 1,5 л раствора требуются разные количества вещества. Массу кристаллогидрата рассчитывают с учетом кристаллизационной воды. Пример. Сколько граммов Na2S04- 10H2O необходимо взять для приготовления 1 кг 10%-го раствора Na2S04. Молярная масса Na2S04 равна 142,04 г/моль, a Na2S04- 10H2O составляет 322,20 г/моль. Расчет ведут сначала на безводную соль по пропорции 100:10 = = 1000: х:
Массу кристаллогидрата находят из пропорции 142,04:322,20 = = 100:х:
Воды в этом случае нужно взять:
Готовить и разбавлять растворы веществ можно в мерной посуде (химические стаканы с делениями, мерные бутыли). Так готовят растворы с приблизительной концентрацией. Для приготовления растворов с точной концентрацией используют мерные колбы и химически чистые (х.ч.) реактивы. При необходимости точную концентрацию раствора определяют объемным методом, используя известное из курса аналитической химии уравнение для закона эквивалентов:
где Для быстрого приготовления растворов веществ (кислот, щелочей, солей) с точной концентрацией применяют фиксаналы — стеклянные ампулы, запаянные с двух сторон, содержащие вещества, необходимые для приготовления 1 л растворов с молярной концентрацией эквивалента, указанной на ампуле. Для приготовления раствора содержимое ампулы переносят в мерную колбу, наливают до половины ее объема дистиллированной воды и осторожно встряхивают до полного растворения вещества. После чего доводят объем до метки. В лабораторной практике приготовление растворов — одна из самых часто повторяющихся операций. Уметь рассчитать, правильно приготовить растворы неорганических и органических веществ — один из обязательных навыков, которым должен владеть химик.
|
||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 966; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.206.19 (0.008 с.) |


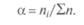

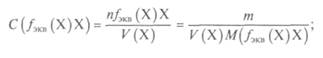





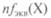 — число моль-эквивалентов;
— число моль-эквивалентов;  — молярная
— молярная — масса одного моль-эквивалента этого вещества, равная произведению фактора эквивалентности
— масса одного моль-эквивалента этого вещества, равная произведению фактора эквивалентности 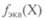 на молярную массу вещества
на молярную массу вещества 
 обозначает долю реальной ча-
обозначает долю реальной ча- эквивалентной одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции.
эквивалентной одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции.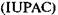 раствор, содержащий 1 моль-эквива-
раствор, содержащий 1 моль-эквива- можно называть нор-
можно называть нор- в скобках фактора эквивалентности, например,
в скобках фактора эквивалентности, например, 
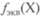 на молярную массу вещества М(Х):
на молярную массу вещества М(Х): и имеет размерность молярной массы.
и имеет размерность молярной массы. — отношение количества рас-
— отношение количества рас-
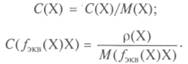


 — масса вещества
— масса вещества  содержащегося в 1 см3
содержащегося в 1 см3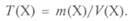
 обычно выражают в граммах на миллилитр
обычно выражают в граммах на миллилитр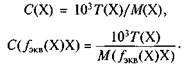
 к эквивалентному объему
к эквивалентному объему 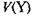 стандартного раствора:
стандартного раствора:

 — стехиометрические коэффициенты веществ X и Y в
— стехиометрические коэффициенты веществ X и Y в
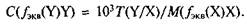
 (молярная масса
(молярная масса  равна 106г/моль). Взвешивают 1 моль
равна 106г/моль). Взвешивают 1 моль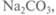 переносят с помощью воронки в литровую
переносят с помощью воронки в литровую
 ки по нижнему мениску. Колбу закрывают пробкой, снова перемешивают, делают надпись специальным карандашом по стеклу.
ки по нижнему мениску. Колбу закрывают пробкой, снова перемешивают, делают надпись специальным карандашом по стеклу.
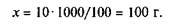
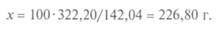


 — объем титрованного раствора (титранта), мл;
— объем титрованного раствора (титранта), мл;  — нормальность титрованного раствора (титранта);
— нормальность титрованного раствора (титранта); 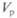 — объем рабочего раствора, мл;
— объем рабочего раствора, мл;  — нормальность рабочего раствора.
— нормальность рабочего раствора.


