
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Приготовление растворов заданной концентрации.Содержание книги
Поиск на нашем сайте
Глава 4. РАСТВОРЫ Раствором называют однородную смесь, состоящую из двух или более веществ (компонентов), состав которой в определенных пределах может непрерывно изменяться. Как правило, компоненты раствора подразделяют на растворитель и растворенные вещества. Растворителем называют то вещество, которое в чистом виде находится в той же фазе, что и раствор. Так, при растворении в жидкости твердого или газообразного вещества, растворителем считают жидкость. Если же одна жидкость растворяется в другой, то растворителем обычно считается та, которой в растворе больше. Наряду с давлением и температурой важным параметром состояния раствора является его состав. Количественный состав раствора выражается с помощью концентраций. Под концентрацией понимают относительное содержание компонентов в растворе. Рассмотрим наиболее часто применяемые способы выражения концентрации. 1. Массовая доля (wi) или массовое содержание (wi, %) данного компонента, выраженное в процентах, – отношение массы растворенного вещества к общей массе раствора, выраженное в долях единицы или в процентах:
где 2. Объемная доля (
где 3. Молярная концентрация (
где 4. Молярная концентрация эквивалента вещества (нормальная концентрация) (
где 5. Моляльность (С m, i) - количество i -го компонента в молях в 1000 г растворителя, измеряется в моль/1000 г или моль/кг растворителя:
где 6. Молярная доля (
где 5. Титр (Т) - число граммов растворенного вещества в 1 см3 (или в 1 мл) раствора, г/ см3 или г/мл:
где m – масса вещества в г, V – объем раствора в см3 или мл. Перейти от одних единиц концентраций к другим можно, составив уравнения связи между ними. Приведем в качестве примера уравнения связи между единицами концентраций для двухкомпонентного (бинарного) раствора, содержащего в объеме V литров Связь между молярностью
между моляльностью
между молярной долей
между титром Т и процентами по массе
между молярностью
между моляльностью
Работа 4.1. Приготовление раствора из фиксанала.
Фиксаналы (стандарт-титры) – запаянные в стеклянную ампулу точно отвешенные количества различных твердых веществ или точно отмеренные объемы титрованных растворов, необходимые для приготовления 1 л раствора точно известной концентрации (нормальности или молярности). Использование других методик такой точности не дает, так как большинство веществ, из которых готовят растворы, трудно получить химически чистыми. Например, серная кислота Н2SO4 всегда содержит воду, гидроксид натрия NaOH – гигроскопическую воду и некоторое количество Na2CO3 вследствие поглощения СО2 из воздуха.
Экспериментальная часть
Необходимое оборудование: мерная колба на 1 л, боек, промывалка с дистиллированной водой, стеклянная воронка. Необходимые реактивы: фиксанал раствора или твердого вещества (по заданию преподавателя), дистиллированная вода.
Экспериментальная часть
Необходимое оборудование: мерная колба на 100 (200, 250) мл, мерный цилиндр (10 мл). Необходимые реактивы: 20 % серная кислота, дистиллированная вода.
Методика проведения эксперимента
Рассчитайте объем 20 %-го раствора серной кислоты плотностью 1,14 г/мл, который необходим для приготовления 100 (200, 250) мл раствора серной кислоты заданной молярной концентрации (0.05 – 0.2 М, по указанию преподавателя). В соответствующую мерную колбу влейте примерно на 1/3 часть ее объема дистиллированной воды и отмеренный при помощи цилиндра рассчитанный объем 20 %-й серной кислоты. Перемешайте раствор и, постепенно приливая дистиллированную воду, доведите объем раствора в колбе до метки, закройте ее пробкой и тщательно перемешайте. На колбу с готовым раствором наклеивают этикетку с названием и концентрацией раствора.
Экспериментальная часть Необходимое оборудование: лабораторные электронные весы, шпатель, бюкс, мерная колба (100, 200, 250 мл), воронка, мерная посуда. Необходимые реактивы: соль по заданию преподавателя, дистиллированная вода.
Методика проведения эксперимента
Рассчитывают массу навески соли, необходимую для приготовления 100 (200 или 250) мл раствора соли заданной концентрации. Рассчитанную навеску соли взвешивают в бюксе. В мерную колбу наливают дистиллированной воды на 1/3 ее объема. Осторожно переносят в нее через воронку навеску соли. Для этого бюкс медленно наклоняют над воронкой и не допускают рассыпания и распыления вещества. Остатки вещества в бюксе и на стенках воронки смывают в колбу. При непрерывном перемешивании растворяют все кристаллы соли. Затем доводят объем раствора в колбе до метки дистиллированной водой, закрывают ее пробкой и еще раз тщательно перемешивают раствор, переворачивая колбу несколько раз вверх дном. На колбу с готовым раствором наклеивают этикетку с названием и концентрацией раствора. Далее этот раствор используют как концентрированный для приготовления раствора меньшей концентрации (указывается преподавателем). Рассчитывают объем концентрированного раствора, необходимый для приготовления заданного объема разбавленного раствора. Отмеряют рассчитанный объем исходного раствора и через воронку вливают его в мерную колбу соответствующего объема. Воронку ополаскивают и вынимают из горлышка колбы. Доводят объем раствора в колбе дистиллированной водой до метки, закрывают ее пробкой и тщательно перемешивают раствор. На колбу с готовым раствором наклеивают этикетку с названием и концентрацией раствора. Экспериментальная часть Необходимое оборудование: лабораторные электронные весы, шпатель, часовое стекло или бюкс, коническая колба (100, 200, 250 мл), воронка, мерный цилиндр. Необходимые реактивы: соль по заданию преподавателя, дистиллированная вода.
Методика проведения эксперимента
Первая часть работы состоит в приготовлении раствора соли с заданным массовым процентом. Масса раствора (50 – 100 г) или его объем (100 – 250 мл) задается преподавателем. Получив у преподавателя задание, рассчитывают, сколько потребуется соли и воды для приготовления раствора заданной концентрации. Плотность раствора, необходимая для расчета, определяется по справочным таблицам или указывается преподавателем. В бюксе или на часовом стекле взвешивают навеску соли (с точностью до 0,01 г), используя метод “взятия навески по разности”. Навеску соли высыпают через воронку в коническую колбу. Затем отмеряют цилиндром необходимое количество воды и вливают в колбу с солью (воду необходимо приливать постепенно, все время перемешивая раствор). Колбу закрывают пробкой и наклеивают этикетку с названием и концентрацией раствора. Во второй части работы из полученного раствора готовят раствор соли меньшей концентрации, используя метод разбавления. Концентрация разбавленного раствора задается преподавателем. Рассчитывают объемы готового раствора и дистиллированной воды, необходимые для приготовления разбавленного раствора. Отмеряют цилиндрами рассчитанные объемы исходного раствора и дистиллированной воды, вливают их в коническую колбу и тщательно перемешивают полученный раствор. Колбу закрывают пробкой, и наклеивают этикетку с названием и концентрацией раствора.
Экспериментальная часть
Необходимое оборудование: пикнометр, аналитические весы, разновесы, термометр, химический стакан, мензурка, воронка, пипетка, стеклянная палочка. Необходимые реактивы: реактивы по заданию преподавателя.
Методика выполнения работы
Работа состоит из двух частей: приготовление раствора с заданным процентом по массе и определение его плотности. После получения задания от преподавателя готовят раствор заданной концентрации по методике, описанной в работах № 4.3 или 4.4. Далее определяют плотность раствора. Для этого взвешивают на аналитических весах пустой сухой пикнометр, пикнометр с водой и пикнометр с исследуемым раствором. Измеряют температуру воды и исследуемого раствора, они должны быть одинаковыми. Заполнение пикнометра жидкостями производится до метки. Капли жидкости выше метки необходимо удалить фильтровальной бумагой. Перед заполнением пикнометра исследуемым раствором его следует ополоснуть этим раствором. Глава 4. РАСТВОРЫ Раствором называют однородную смесь, состоящую из двух или более веществ (компонентов), состав которой в определенных пределах может непрерывно изменяться. Как правило, компоненты раствора подразделяют на растворитель и растворенные вещества. Растворителем называют то вещество, которое в чистом виде находится в той же фазе, что и раствор. Так, при растворении в жидкости твердого или газообразного вещества, растворителем считают жидкость. Если же одна жидкость растворяется в другой, то растворителем обычно считается та, которой в растворе больше. Наряду с давлением и температурой важным параметром состояния раствора является его состав. Количественный состав раствора выражается с помощью концентраций. Под концентрацией понимают относительное содержание компонентов в растворе. Рассмотрим наиболее часто применяемые способы выражения концентрации. 1. Массовая доля (wi) или массовое содержание (wi, %) данного компонента, выраженное в процентах, – отношение массы растворенного вещества к общей массе раствора, выраженное в долях единицы или в процентах:
где 2. Объемная доля (
где 3. Молярная концентрация (
где 4. Молярная концентрация эквивалента вещества (нормальная концентрация) (
где 5. Моляльность (С m, i) - количество i -го компонента в молях в 1000 г растворителя, измеряется в моль/1000 г или моль/кг растворителя:
где 6. Молярная доля (
где 5. Титр (Т) - число граммов растворенного вещества в 1 см3 (или в 1 мл) раствора, г/ см3 или г/мл:
где m – масса вещества в г, V – объем раствора в см3 или мл. Перейти от одних единиц концентраций к другим можно, составив уравнения связи между ними. Приведем в качестве примера уравнения связи между единицами концентраций для двухкомпонентного (бинарного) раствора, содержащего в объеме V литров Связь между молярностью
между моляльностью
между молярной долей
между титром Т и процентами по массе
между молярностью
между моляльностью
Приготовление растворов заданной концентрации.
Растворы определенной концентрации готовят следующими методами: 1) из фиксаналов; 2) растворением известной навески твердого вещества в определенной массе или объеме растворителя или раствора; 3) разбавлением концентрированных растворов. При приготовлении и разбавлении растворов часто приходится переходить от одних способов выражения концентраций к другим. Методику таких расчетов покажем на следующем примере. Пример 1. Имеется водный раствор Al2(SO4)3 c концентраций w = 10 % и плотностью r = 1,105 г/мл. Каковы молярность, нормальность, титр, моляльность и молярная доля вещества этого раствора? Решение. 1. При переходе от процентной концентрации к молярной или нормальной необходимо учитывать плотность раствора. Как известно, масса тела (m), его плотность (r) и объем (V) связаны соотношением m = r× V или V = m /r. Тогда, масса 1 л раствора равна m р = rр× V р = 1,105×1000 = 1105 г. По определению массового процента, в 100 г раствора содержится 10 г соли, следовательно, в 1105 г (т. е. в 1 л) соответственно (1105×10)/100 = 110,5 г Al2(SO4)3. Молярная масса Al2(SO4)3 М (Al2(SO4)3) = 342 г/моль. Таким образом, в 1 л раствора содержится n = 110,5/342 = 0.32 моля Al2(SO4)3 и молярная концентрация раствора С равна 0,32 моль/л, или 0,32 М. 2. Эквивалент молекулы Al2(SO4)3 Э (Al2(SO4)3) = 1/6Al2(SO4)3. Соответственно 1 моль эквивалента составляет 1/6 часть моля Al2(SO4)3. Следовательно, в одном моле Al2(SO4)3 содержится 6 молей эквивалента Al2(SO4)3, а в 1 л раствора – n экв = 0,32×6 = 1,92 молей эквивалента Al2(SO4)3 (n экв = n × z, где n экв – число молей эквивалента вещества, n – число молей вещества, z – эквивалентное число, в данном случае z = 6). Молярная концентрация эквивалента вещества С экв. (или нормальность) равна 1,92 моль/л или 1,92 н. 3. Поскольку выше было найдено, что в 1000 мл раствора содержится 110,5 г растворенного вещества, то в 1 мл находится 110,5/1000 = 0,1105 г Al2(SO4)3 и титр раствора Т = 0,1105 г/мл. 4. По условию в 100 г раствора содержится 10 г Al2(SO4)3 и 90 г Н2О. Тогда на 1000 г воды приходится (1000×10)/90 = 111,11 г Al2(SO4)3. Это составляет 111,11/342 = 0,325 моля. Следовательно, в 1000 г растворителя содержится 0,325 молей растворенного вещества, и моляльность раствора С m, по определению, равна 0,325 моль/1000 г Н2О. 5. Из данных п. 1 следует, что в 1 л раствора содержится 1105-110,5 = 994,5 г воды. Это составляет 994,5/18 = 55,25 молей воды. Откуда молярная доля Al2(SO4)3 в растворе x = 0,32/(0,32 + 55,25) = 0,058.
|
||||
|
Последнее изменение этой страницы: 2016-06-19; просмотров: 3895; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.10.139 (0.013 с.) |

 ,
,  %,
%,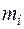 - масса i -го компонента, кг, г;
- масса i -го компонента, кг, г;  - сумма масс компонентов раствора, кг или г.
- сумма масс компонентов раствора, кг или г.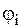 ) или объемное содержание (
) или объемное содержание ( ,
,  %,
%, - объем i -го компонента,
- объем i -го компонента, 
 , л или мл;
, л или мл;  - объем компонентов раствора,
- объем компонентов раствора,  ) – количество (число молей) i -го компонента к объему раствора, выраженная в моль/м3, моль/дм3, моль/см3 или моль/л:
) – количество (число молей) i -го компонента к объему раствора, выраженная в моль/м3, моль/дм3, моль/см3 или моль/л: ,
,
 – число молей растворенного вещества, моль, V - объем раствора, м3, дм3, см3 или л. В том случае, когда объем раствора выражается в литрах, молярную концентрацию называют молярностью.
– число молей растворенного вещества, моль, V - объем раствора, м3, дм3, см3 или л. В том случае, когда объем раствора выражается в литрах, молярную концентрацию называют молярностью. , С (1 /z В)) – количество (число молей эквивалента) i -го компонента к объему раствора, выраженная в моль/м3, моль/дм3, моль/см3 или моль/л:
, С (1 /z В)) – количество (число молей эквивалента) i -го компонента к объему раствора, выраженная в моль/м3, моль/дм3, моль/см3 или моль/л: ,
, – число молей эквивалента растворенного вещества, моль, V - объем раствора, м3, дм3, см3 или л. В том случае, когда объем раствора выражается в литрах, нормальную концентрацию называют нормальностью.
– число молей эквивалента растворенного вещества, моль, V - объем раствора, м3, дм3, см3 или л. В том случае, когда объем раствора выражается в литрах, нормальную концентрацию называют нормальностью. , или
, или  ,
, ) или молярное содержание данного компонента, выраженное в процентах - отношение числа молей i -го компонента к общему числу молей компонентов раствора:
) или молярное содержание данного компонента, выраженное в процентах - отношение числа молей i -го компонента к общему числу молей компонентов раствора: ,
,  %,
%, - общее число молей компонентов раствора,
- общее число молей компонентов раствора,  .
. ,
, молей растворителя с молярной массой
молей растворителя с молярной массой  и
и  молей растворенного вещества с молярной массой
молей растворенного вещества с молярной массой  , и плотностью r.
, и плотностью r. 
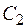 и процентами по массе
и процентами по массе  определяется соотношением:
определяется соотношением: ;
; и процентами по массе
и процентами по массе  ;
;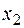 и процентами по массе
и процентами по массе 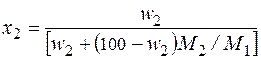 ;
;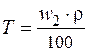 ;
;
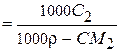 ;
; .
.


