Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Растворы, применяемые в титриметрии. Приготовление стандартных растворовСодержание книги
Поиск на нашем сайте
Раствор с точно известной концентрацией (стандартный) может быть получен растворением точной навески вещества в известном объеме, это так называемые первичные стандарты. Для их приготовления используют исходные вещества, удовлетворяющие следующим требованиям. · Вещество должно быть химически чистым. · Вещество должно иметь постоянный формульный состав при хранении в растворе, на воздухе. · Вещество должно хорошо растворяться в воде. · Желательно, чтобы вещество имело большую молярную массу.
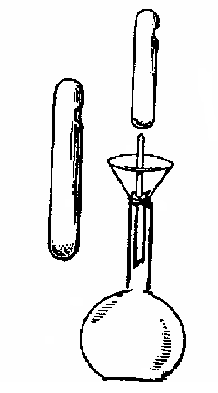 Вещества, удовлетворяющие перечисленным требованиям, называются исходными или стандартными. К ним относятся многие соли (тетраборат натрия, оксалат натрия, хлорид натрия, дихромат калия), щавелевая кислота и ряд других. Вещества, удовлетворяющие перечисленным требованиям, называются исходными или стандартными. К ним относятся многие соли (тетраборат натрия, оксалат натрия, хлорид натрия, дихромат калия), щавелевая кислота и ряд других.
Однако не всегда из точно взятой навески можно приготовить раствор с заранее точно известной концентрации. Например, растворы обычно применяемых кислот соляной, серной, азотной нельзя приготовить из точных навесок, т.к. исходные растворы кислот содержат переменные количества воды. Едкие щелочи поглощают из воздуха воду и углекислый газ, и точные навески их взять невозможно. В таких случаях проводят стандартизацию приготовленных растворов, т.е. определение концентрации титрованием по стандартным веществам (перечислены выше). Концентрация (молярная концентрация эквивалента) стандартных растворов должна быть определена с точностью до трех или четырех значащих цифр. Стандартные растворы можно готовить также из имеющихся стандарт-титров (фиксаналов). Фиксанал представляет собой стеклянную запаянную ампулу, в которой содержится определенное количество вещества в сухом виде или в виде раствора. Их изготавливают в специальных лабораториях и на химических заводах. Чтобы из фиксанала приготовить рабочий раствор, ампулу тщательно моют снаружи и с помощью специального пробивного устройства разбивают ее в воронке над мерной колбой (рис. 1.1). Затем с помощью промывалки содержимое ампулы количественно (без остатка) переносят в колбу и доводят объем дистиллированной водой до метки.
3.5. Аппаратура и техника выполнения титриметрического анализа
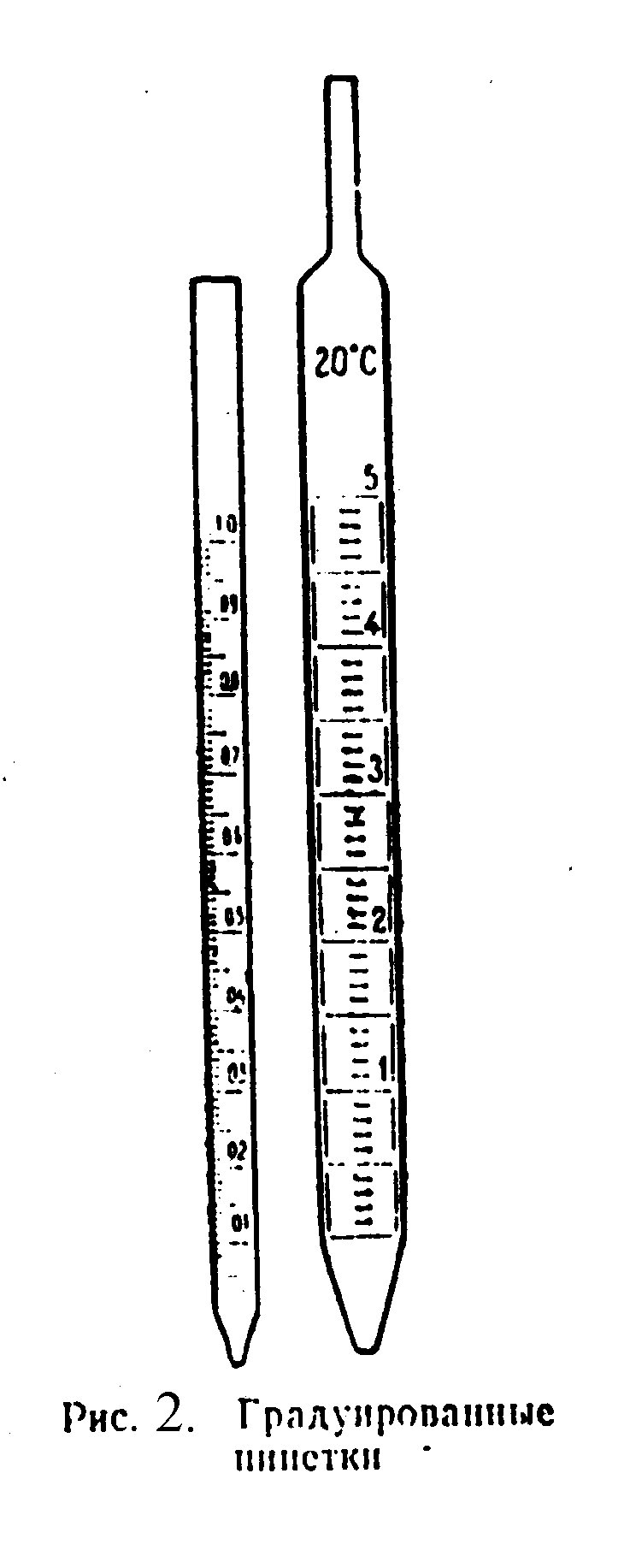
При выполнении титриметрического анализа необходимо отмерять точные объемы различных жидкостей. Для этой цели существует специальная мерная посуда – мерные колбы, пипетки и бюретки. Мерные колбы служат для приготовления рабочих растворов и разбавления жидких проб. Они представляют собой плоскодонные сосуды с узким и длинным горлышком, на котором имеется метка (рис. 1.2). Мерные колбы бывают на 25, 50, 100, 200, 250, 500, 1000 мл. На каждой мерной колбе указана та температура, при которой она имеет точно обозначенный на ней объем. Для правильного измерения объема важно, чтобы глаз наблюдателя находился на одном уровне с меткой, а нижняя часть мениска жидкости касалась бы этой черты. Понятно, что, чем меньше диаметр горлышка, тем точнее можно измерить объем. Следует отметить, что мерные колбы не предназначены для нагревания в них жидкостей. Пипетки служат для переноса определенных объемов жидкости из одного сосуда в другой. Они бывают двух видов – градуированные и неградуированные. С помощью градуированной

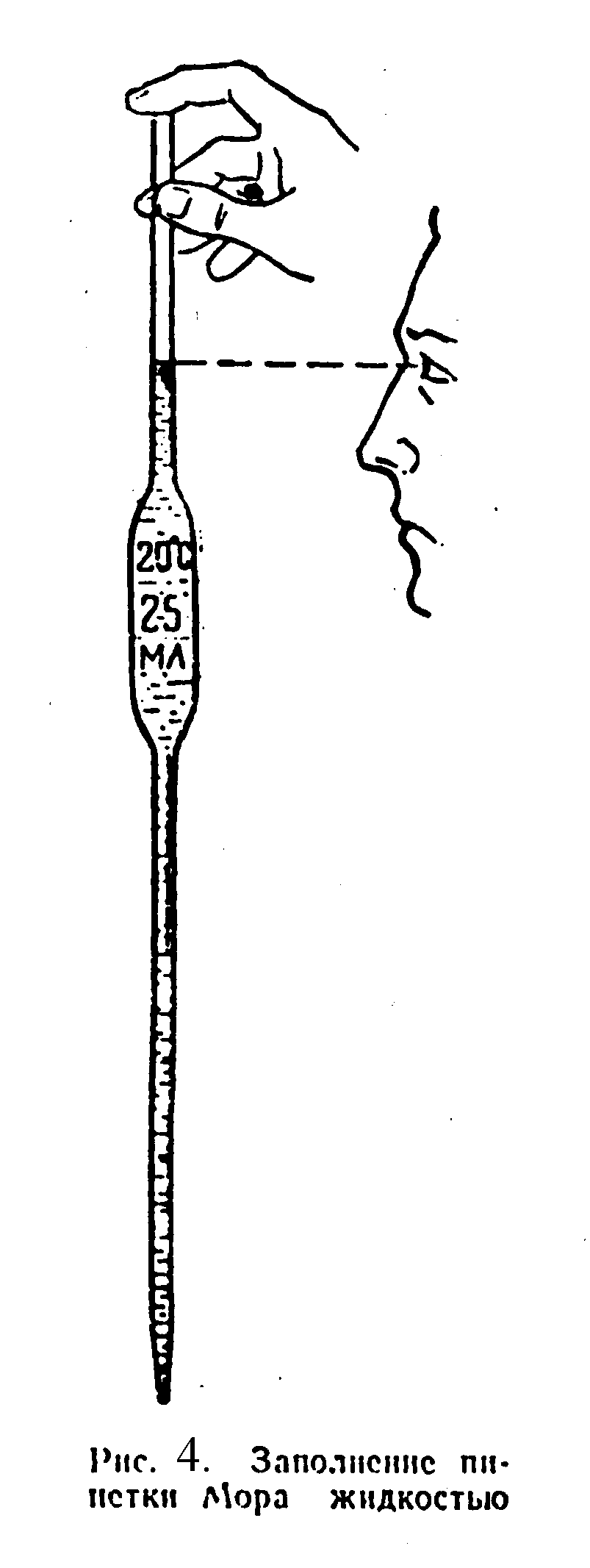
Как и мерные колбы, пипетки бывают различных размеров. В титриметрическом анализе применяют пипетки вместимостью 1, 2, 5, 10, 25 и 50 мл. Чтобы заполнить пипетку, ее берут большим и указательным пальцами и опускают нижним концом в раствор. Затем с помощью резиновой груши засасывают жидкость внутрь пипетки, причем мениск должен подняться чуть выше метки. Быстро закрывают верхнее отверстие указательным пальцем и, держа пипетку строго вертикально, постепенно ослабляют нажим, давая жидкости опуститься до метки. В этот момент нужно вновь плотно закрыть отверстие (рис. 1.5). Чтобы вылить жидкость из пипетки, прикасаются ее нижним концом к внутренней поверхности сосуда и понемногу ослабляют нажим пальца, давая жидкости медленно вытечь. После этого оставляют кончик пипетки в соприкосновении со стенкой еще 10–15 с. Остаток жидкости из пипетки выдувать нельзя, так как этот объем не учитывался при калибровке мерной посуды. Бюретки предназначены для измерения объема вытекающей из них жидкости. Они представляют собой стеклянные цилиндрические трубки с делениями на внешней поверхности. Нулевая точка шкалы находится в верхней части бюретки. Нижний конец бюретки оттянут и снабжен затвором, в качестве которого могут быть стеклянный кран, перехваченная металлическим зажимом резиновая трубка со стеклянным наконечником или стеклянный шарик, вставленный в резиновую трубку. В последнем случае при сдавливании трубки в месте расположения шарика резина растягивается и образуется щель, через которую и вытекает раствор из бюретки. Если сдавливание прекратить, то шарик вновь плотно прилегает к стенкам трубки. Перед началом титрования бюретку строго вертикально закрепляют в штативе, споласкивают рабочим раствором и заполняют ее рабочим раствором чуть выше нулевой отметки. Затем открывают затвор, дают раствору заполнить резиновую трубку и выпускают жидкость до тех пор, пока мениск не коснется нулевой черты. В коническую колбу помещают отмеренный пипеткой объем анализируемого раствора, небольшое количество индикатора и начинают титрование, т.е. медленно выпускают жидкость из бюретки в колбу (рис. 1.6). Обычно титрование проводят со скоростью 1 мл за 6–8 с. Когда по окраске индикатора будет заметно приближение точки эквивалентности, то скорость титрования уменьшают и прибавляют рабочий раствор по каплям, тщательно перемешивая содержимое колбы. За объемом вытекающей из бюретки светлой прозрачной жидкости следят по положению нижнего края мениска (рис. 1.7). При отсчете делений глаз наблюдателя должен находиться на одном уровне с мениском.
Цель работы. 1. Научиться готовить растворы с заданной массовой долей растворенного вещества (процентной концентрацией) из твердого вещества и разбавлением. 2. Освоить метод кислотно-основного титрования.
Реактивы.
Оборудование и посуда. · Бюретки. · Стаканы на 150-200 мл. · Набор ареометров. · Весы. · Цилиндры. · Пипетки на 10, 20, 25 мл. · Колбы конические для титрования на 100 или 250 мл.
Выполнение работы. Опыт №1. Приготовление раствора заданной процентной концентрации. 1.1. Приготовление раствора из твердого вещества и воды.
|
|||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1077; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.71.166 (0.006 с.) |