
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химия биогенныхs-, p- и d-элементов. Их биологическая роль и применение в медицинеСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
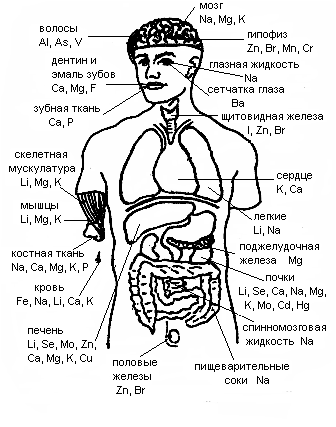
В настоящее время известно 110 химических элементов, большинство из них встречается в природе, некоторые получены искусственно (с помощью ядерных реакций).С точки зрения строения атома химические элементы делятся на s-, p-, d-, f- семейства. У s-элементов последний электрон заполняет s-орбиталь внешнего электронного слоя, у р-элементов – р-орбиталь внешнего электронного слоя. Элементы d-семейства (d-элементы) – это элементы, у которых последний электрон заполняет d-орбитальпредвнешнего электронного слоя (2-го снаружи слоя). К ним относятся элементы, находящиеся в середине больших периодов (между s- и р-элементами). Их называют также переходными элементами. Так как d-орбиталей пять, и на каждой может быть по два электрона, то всего на d-подуровне может быть 10 электронов. Им соответствуют 10 d-элементов. Например, в IV периоде к d-элементам относятся элемента от Sc (№21) до Zn (№30) включительно.d-Элементы находятся в побочных подгруппах периодической системы, все они металлы. На внешнем электронном слое у большинства из них находятся по 2 электрона. Если наблюдается «провал» («проскок») электрона с s-орбитали внешнего слоя на d-орбитальпредвнешнего слоя, то на внешнем слое остается 1 электрон, как например, у Cr и Сu (элементов IV периода). Таким образом, на внешнем электронном слое у них мало электронов, они их легко отдают и являются металлами.Валентными электронами у них могут быть не только электроны внешнего слоя (ns-электроны), но и предвнешнего слоя ((n–1)d-электроны). Поэтому подавляющее большинство из них проявляет переменную валентность. Человек – составная часть природы. В живых организмах, в том числе и в организме человека, можно обнаружить почти все те же химические элементы, которые есть в земной коре и морской воде, только в иных количествах.В результате естественного отбора основу живых систем составляют 6 элементов: C, H, O, N, P, S, получивших название органогенов. Эти элементы составляют в организме 97,4% и являются основой органических соединений. Для органогенов характерно образование водорастворимых соединений, что способствует их концентрированию в живых организмах. Существуют различные классификации химических элементов, находящихся в организме человека. По содержанию их разделяют на следующие группы. 1. Макроэлементы – это элементы, содержание которых в организме выше 10-2%. К ним относятся О (62), С (21), Н (10), N (3), Ca (2), P (1), K (0.23), S (0.16), Cl (0.1), Nа (0.08), Mg (0.027). В скобках указана массовая доля элементов в %. 2. Микроэлементы – это элементы, содержание которых в организме находится в пределах от 10-3% и ниже. К ним относятся: йод, медь, мышьяк, фтор, бром, стронций, барий, кобальт и другие. Иногда выделяют ультрамикроэлементы – это элементы, содержание которых в организме ниже 10-5%. К ним относятся: ртуть, золото, уран, торий, радий и др. Но в настоящее время их объединяют с микроэлементами в одну группу. Основателем этой классификации является В.И.Вернадский. В.В.Ковальский, исходя из значимости элементов для жизнедеятельности, подразделил их на три группы. 1. Жизненно необходимые (незаменимые) элементы. Они постоянно содержатся в организме человека, входят в состав ферментов, гормонов и витаминов: Н, О, Са, N, К, Р, Na, S, Mg, Cl, C, I, Mn, Cu, Co, Fe, Zn, Mo, V. Их дефицит приводит к нарушению нормальной жизнедеятельности человека. 2. Примесные элементы. Эти элементы постоянно содержатся в организме животных и человека: Ga, Sb, Sr, Br, F, B, Be, Li, Si, Sn, Cs, Al, Ba, Ge, As, Rb, Pb, Ra, Bi, Cd, Cr, Ni, Ti, Ag, Th, Hg, U, Se. Биологическая роль их мало выяснена или неизвестна. 3. Примесные элементы (Sc, Tl, Jn, La, Pr, Sm, W, Re, Tb и др.). Обнаружены в организме человека и животных. Данные о количестве и биологическая роль не выяснены. Элементы, необходимые для построения и жизнедеятельности различных клеток и организмов, называют биогенными элементами. Точно перечислить все биогенные элементы в настоящее время еще невозможно из-за сложности определения очень низких концентраций микроэлементов и установления их биологических функций. Для 24 элементов биогенностьустановлена надежно. Это элементы 1-ой и некоторые элементы 2-ой группы по Ковальскому. Органы человека по-разному концентрируют в себе различные химические элементы, т.е. они неравномерно распределяются между разными органами и тканями. Данные по распределению (топографии) некоторых макро- и микроэлементов в организме человека представлены на рис. 2.1. Десять металлов, жизненно необходимых для живого организма, получили название «металлы жизни». К ним относятсяCa, K, Na, Mg, Fe, Zn, Cu, Mn, Mo, Co (расположены в порядке уменьшения их содержания). Биологическая роль химических элементов в организме человека разнообразна. Главная функция макроэлементов состоит в построении тканей, поддержании постоянства осмотического давления, ионного и кислотно-основного состава. Микроэлементы участвуют в обмене веществ, процессах размножения, тканевом дыхании, обезвреживании токсичных веществ, влияют на процессы кроветворения, окисления-восстановления, проницаемость сосудов и тканей.
Рис. 2.1. Концентрирование некоторых химических элементов в органах, тканях и биожидкостях человека
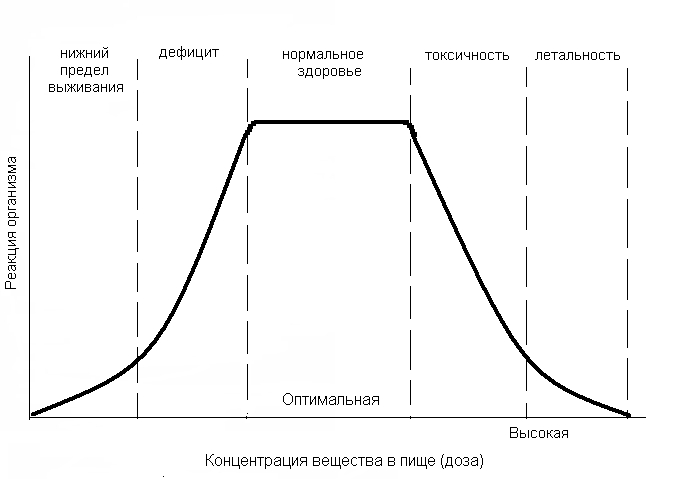
Необходимо знать, что для организма вреден не только недостаток, но и избыток биогенных элементов, так как при этом нарушается химический гомеостаз. Например, избыток Zn в пище вызывает угнетение активности железосодержащих ферментов (антагонизм Zn и Fe). На рис. 2.2 представлена кривая зависимости реакции организма от концентрации веществ в пище. Ряд элементов (Hg, Pb, Cd, и др.) считаются токсичными, так как попадание их в организм уже в микроколичествах приводит к тяжелой патологии.
Рис. 2.2. Кривая зависимости реакции организма от концентрации веществ в пище
Различные элементы и их соединения широко используются в медицинской практике при оказании помощи, в качестве лекарственных средств. Например, для приготовления антисептической повязки при термических ожогах используется 2%-ный водный раствор NaHCO3; для нейтрализации места ожога кислотами после длительного промывания его проточной водой используется 3%-ный раствор NaHCO3, 0,9%-ный раствор NaCl называется физиологическим раствором и т.д. В результате производственной и хозяйственной деятельности человека происходит загрязнение окружающей среды промышленными отходящими газами, сточными водами, твердыми отходами и т.д. Санитарная охрана окружающей среды предусматривает соблюдение предельных нормативов содержания загрязнителей в воздухе, в воде и в почве, называемых предельно допустимыми концентрациями (ПДК). ПДК – это максимальная концентрация вредного вещества в окружающей среде, практически не влияющая отрицательно на живые организмы, в том числе и на человека. Например, ПДК меди в водоемах хозяйственно-питьевого и культурно-бытового назначения составляет 1,0 мг/л, в почве 3,0 мг/кг (подвижные соединения). Наряду с заболеваниями, вызванными загрязнением окружающей среды, существуют заболевания, связанные с аномальным содержанием некоторых элементов в почве, водоемах той или иной географической зоны. Такие заболевания называются эндемическими. Например, в Белгородской области обнаружен дефицит йода, избыток кальция, много железа, особенно в районах добычи железной руды. Биогенные s- и р-элементы К s-элементам относятся первые два элемента каждого периода. Электронная формула внешнего слоя ns1–ns2. К ним относятся элементы главной подгруппы I группы (IА группы) – водород, щелочные металлы (Li, Na, K, Rb, Cs, Fr), а также элементы главной подгруппы II группы (IIA группы) – Be, Mg, Ca, Sr, Ba, Ra, и элемент VIIIА благородный газ гелий Не. Некоторые из них относятся к макроэлементам (H, Na, K, Ca, Mg), другие – к микроэлементам (например, Sr, Ba, Ra). Первые пять элементов являются жизненно необходимыми (незаменимыми), биогенными элементами. Остальные s-элементы (Li, Rb, Cs, Fr, Be, Sr, Ba, Ra) являются примесными элементами. К р-элементам относятся последние 6 элементов II–VI периодов (VII период не завершен). Электронная формула внешнего слоя этих элементов np1–np6. Это элементы главных подгрупп III–VIII групп (кроме гелия, он s-элемент). Из них к макроэлементам относятся O, C, N, P, S, Cl, они же являются жизненно необходимыми биогенными элементами. Большинство р-элементов относятся к примесным микроэлементам. Из микроэлементов только йод (I) относится к числу незаменимых биогенных элементов. Фтор (F) также можно считать элементом, необходимым для нормального функционирования живых организмов. Некоторые исследователи относят и селен (Se) к жизненно необходимым элементам. Группа IA (водород) Пероксид водорода – это соединение водорода, элемента IА группы, который относится к s-семейству. Пероксид водорода является важным побочным продуктом метаболизма. Обычно в митохондриях идет восстановление О2 до Н2О: О20 + 4 Н+ + 4е = 2Н2О-2. При неполном восстановлении кислорода образуется пероксид водорода: О20 + 2Н+ + 2е = Н2О2-1. Пероксид водорода, как промежуточный продукт восстановления кислорода, очень токсичен для клетки. Токсичность связана с тем, что Н2О2 взаимодействует с липидным слоем клеточных мембран и выводит их из строя. Аэробные клетки могут защитить себя от вредного действия пероксида водорода с помощью фермента каталазы, под действием которой Н2О2 превращается в воду и кислород: 2Н2О2 Освободившийся кислород принимает участие в дальнейших процессах биологического окисления. Аналогичное разложение пероксида водорода можно осуществить в лабораторных условиях под действием MnO2 в качестве катализатора. 2Н2О2 В медицинской практике пероксид водорода применяют в основном как наружное бактерицидное средство. Действие Н2О2 основано на окислительной способности пероксида водорода и безвредности продукта его восстановления – воды. При обработке ран выделяющийся кислород играет двоякую роль. Во-первых, он оказывает противомикробное, дезодорирующее и депигментирующее действие, убивая микробные тела. Во-вторых, образует пену, способствуя переходу частиц тканевого распада во взвешенное состояние и очищению ран. В качестве фармакопейного препарата используется 3%-ный водный раствор пероксида водорода. 6%-ный раствор Н2О2 применяют для обесцвечивания волос. В виде 30%-ного раствора Н2О2 применяют при лечении бородавчатых форм красного плоского лишая и для удаления юношеских бородавок. Группа IA и IIА Металлы IA и IIA группы относятся к s-семейству. Гидрокарбонат натрия NaHCO3 используют при различных заболеваниях, сопровождающихся повышенной кислотностью - ацидозом (диабет и др.). Механизм снижения кислотности заключается во взаимодействии NaHCO3 с кислыми продуктами. При этом образуются натриевые соли органических кислот, которые в значительной мере выводятся с мочой, и углекислый газ, покидающий организм с выдыхаемым воздухом: NaHCO3(р) + RCOOH(р) ®RCOONa(р) + Н2О(ж) + СО2(г) Используют NaHCO3 и при повышенной кислотности желудочного сока, язвенной болезни желудка и двенадцатиперстной кишки. При приеме NaHCO3 протекает реакция нейтрализации избыточной соляной кислоты: NaHCO3(р) + HCl(р) = NaCl(р) + Н2О(ж) + СО2(г) желудоч. сок Следует иметь в виду, что применение NaHCO3 вызывает ряд побочных эффектов. Выделяющийся при реакции диоксид углерода раздражает рецепторы слизистой оболочки желудка и вызывает вторичное усиление секреции, кроме того, он может способствовать перфорации стенки желудка при язвенной болезни. Слишком большая доза NaHCO3 в результате гидролиза приводит к алкалозу, что не менее вредно, чем ацидоз. Среди оксидов элементов IIА-группы в качестве лекарственного препарата применяют оксид магния MgO. Основные свойства оксида магния и его нерастворимость в воде обуславливают его применение в качестве антацидного средства при повышенной кислотности желудочного сока: MgO(тв.) + 2HCl(желудоч. сок) = MgCl2(р) + Н2О(ж) Оксид магния имеет преимущество перед гидрокарбонатом натрия, так как при взаимодействии MgO с кислотой желудочного сока не происходит выделение диоксида углерода. Поэтому при действии оксида магния не наблюдается гиперсекреции. Образующийся при реакции хлорид магния переходит в кишечник, оказывает легкий послабляющий эффект, обусловленный осмотическим действием. Антацидным и адсорбирующим действием обладает карбонат кальция СаСО3. Его назначают внутрь при повышенной кислотности желудка, так как он нейтрализует соляную кислоту: СаСО3(тв.) + 2HCl (желудоч. сок) = CaCl2(р) + Н2О(ж) + СО2(г).
Жесткость воды Растворимые соли Са и Mg обуславливают важное свойство природной воды, называемое жесткостью (суммарное содержание солей кальция и магния). Определение жесткости воды имеет большое практическое значение и широкое применение в лабораторной практике различных производств. При стирке белья жесткая вода ухудшает качество тканей и требует повышенной затраты мыла, которое расходуется на связывание катионов Са2+ и Mg2+: 2С17Н35СОО– + Са2+ = (С17Н35СОО)2Са¯ 2С17Н35СОО– + Mg2+ = (С17Н35СОО)2Mg¯. Пена образуется лишь после полного осаждения этих катионов. Правда, некоторые синтетические моющие средства хорошо моют и в жесткой воде, так как их кальциевые и магниевые соли легко растворяются. В жесткой воде плохо развариваются овощи. Очень плохо заваривается чай, и вкус его теряется. В то же время в санитарно-гигиеническом отношении эти катионы не представляют опасности, хотя при большом содержании катионов магния Mg2+ (как в море или океане) вода горьковата на вкус и оказывает послабляющее действие на кишечник человека. Однако использование жесткой воды в качестве питьевой способствует возникновению мочекаменной и желчекаменной болезней (образованию камней). Различают жесткость временную (или устранимую) и постоянную. Временная жесткость обусловлена присутствием в воде гидрокарбонатов Ca(HCO3)2, реже Mg(HCO3)2 и иногда Fe(HCO3)2. Постоянная жесткость обусловлена присутствием других растворимых солей этих металлов (хлоридов, сульфатов и др.). При кипячении воды гидрокарбонаты разлагаются с образованием труднорастворимых соединений, выпадающих в осадок, и жесткость уменьшается. Ca(HCO3)2® CaCO3¯ + H2O + CO2 Ca2+ + 2HCO3-® CaCO3¯ + H2O + CO2 2Mg(HCO3)2® (MgOH)2CO3¯ + H2O + 3CO2 2Mg2+ + 2HCO32- ® (MgOH)2CO3¯ + H2O + 3CO2. Сохраняющаяся после кипячения воды жесткость, называется постоянной (некарбонатной). В соответствии с ГОСТ 6055-86 по значению общей жесткости (ммоль/л) различают воду: очень мягкую <1,5, мягкую 1,5–3,0, средней жесткости 3,0–6,0, жесткую 6,0–9,0, очень жесткую > 9,0. Жесткость воды хозяйственно-питьевых водопроводов не должна превышать 7 ммоль/л. Для определения жесткости воды применяют титриметрический метод (см. лабораторную работу №1). В даннойработе методом кислотно-основного титрования (метод нейтрализации) определяется временная (гидрокарбонатная) жесткость воды. Гидрокарбонаты кальция и магния титруют соляной кислотой в присутствии индикатора. Ca(HCO3)2 + 2НCl®CaCl2 + 2H2O +2CO2 HCO3– + Н+®H2O +CO2
Группа IIIA (алюминий) По содержанию в организме человека алюминий относится к примесным микроэлементам (10–5 %). Известно, что алюминий влияет на развитие эпителиальной и соединительной тканей, на регенерацию костной ткани, на обмен фосфора. Катион Al3+ способен замещать ионы Ca2+ и Mg2+, влияя тем самым на протекание ферментативных процессов. Избыток алюминия в организме тормозит синтез гемоглобина, так как благодаря довольно высокой способности к комплексообразованию ионы алюминия блокируют активные центры ферментов, участвующих в кроветворении. Алюминий – амфотерный металл, растворяется в растворах кислот и в щелочах. Амфотерными свойствами обладают оксид (Al2O3) и гидроксид алюминия (Al(OH)3). Соли алюминия и кислородсодержащих кислот растворимы в воде, за исключением фосфата алюминия AlPO4. Это следует учитывать при назначении препаратов алюминия, в частности гидроксида алюминия при повышенной кислотности желудка. В желудке гидроксид алюминия нейтрализует соляную кислоту Al(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3 + 3H+ = Al3+ + 3H2O Перешедшие в раствор ионы алюминия в кишечнике переходят в малорастворимую форму – фосфат алюминия, который выводится из организма. Таким образом, в присутствии ионов алюминия уменьшается усвоение фосфора. В медицинской практике также находят применение алюмокалиевые квасцы (KAl(SO4)2∙12H2O) и жженые квасцы (KAl(SO4)2). Эти соединения используются для наружного применения для полосканий, промываний, примочек при воспалительных заболеваниях кожи и слизистых, как кровоостанавливающее средство при порезах. Фармакологическое действие солей алюминия основано на том, что ионы Al3+ образуют с белками комплексы, выпадающие в виде гелей, что приводит к гибели микробных клеток. Группа VA (азот) Опыт 6. Получение и свойства аммиака Азот (N) – элемент VА группы (р-элемент). Из соединений азота, в которых он проявляет степень окисления –3, наибольший интерес для медиков и биологов представляет аммиак NH3 и его производные – соли аммония и аминокислоты. Аммиак NH3 в организме человека является одним из продуктов метаболизма аминокислот и белков. Причина токсического действия аммиака на мозг до конца не выяснена. В крови при рН = 7,4 аммиак почти полностью находится в виде ионов аммония. Ионы NH4+, несмотря на то, что они в крови находятся в большом избытке, не могут проникать через клеточные мембраны, в то время как нейтральные молекулы NH3 легко проходят и могут воздействовать на мозг. NH3 – бесцветный газ с резким запахом, очень хорошо растворим в воде: в 1 объеме воды при 20°С растворяется около 700 объемов аммиака (растворимость 31 моль/л). В концентрированном водном растворе массовая доля аммиака составляет 25%. В медицинской практике применяют 10%-ный раствор аммиака (нашатырный спирт) для выведения из обморочного состояния. При вдыхании аммиак оказывает возбуждающее влияние на дыхательный центр. При больших дозах наступает удушье. Группа VIA (кислород) Кислород – важнейший биогенный элемент, находится в VIА группе (р-элемент). В атмосфере Земли содержится около 21% кислорода (по объему). В промышленности кислород получают из жидкого воздуха путем ректификации – дробной перегонки, основанной на различии температур кипения кислорода (–183°С) и азота (–195,8°С). В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением 15 МПа. Лабораторным способом его получения служит электролиз водных растворов щелочей. Небольшие количества О2 можно получать взаимодействием раствора KMnO4с подкисленным раствором Н2О2 (см. опыт 4.2 в работе 8) или термическим разложением некоторых кислородсодержащих веществ, например, перманганата калия: 2KMnO4 = K2MnO4 + MnO2 + O2. Велика биологическая роль кислорода. Элемент кислород входит в состав всех жизненно важных органических веществ – белков, жиров, углеводов. Без О2 невозможны чрезвычайно важные жизненные процессы: дыхание, окисление аминокислот, жиров, углеводов. Только немногие растения, называемые анаэробными,могут обходиться без кислорода. За сутки человек фактически использует около 0,1 м3 кислорода. У высших животных О2 проникает в кровь, соединяется с гемоглобином, образуя оксигемоглобин, который поступает в капилляры различных органов. Здесь О2 отщепляется от гемоглобина и через стенки капилляров диффундирует в ткани. В тканях кислород расходуется на окисление различных веществ. Эти реакции в конечном итоге приводят к образованию углекислого газа, воды и созданию запаса энергии. Регенерация кислорода осуществляется в растениях в результате фотосинтеза. Кислород используют в медицине при затрудненном дыхании. В последние годы при лечении газовой гангрены и ряда других заболеваний, при которых накапливаются микробы в омертвевших тканях, применяют гипербарическуюоксигенацию, т.е. помещают больных в барокамеры с повышенным давлением кислорода в воздухе. При этом улучшается снабжение тканей кислородом, и во многих случаях такой способ лечения дает хорошие результаты. Группа VIIA (йод) Йод (I) находится в VIIА группе, относится к р-элементам. Он относится к числу незаменимых биогенных элементов, и его соединения играют важную роль в процессах обмена веществ. Имеются данные, что йод влияет на синтез некоторых белков, жиров и гормонов. В организме человека содержится около 25 мг йода, из них больше половины находится в щитовидной железе, причем в связанном состоянии – в виде гормонов – и только около 1% его находится в виде иодид-иона. Щитовидная железа секретирует иод-содержащие гормоны тироксин и трииодтиронин. Пониженная активность щитовидной железы (гипотиреоз) может быть связана с уменьшением ее способности накапливать иодид-ионы, а также с недостатком в пище иода (эндемический зоб). При эндемическом зобе назначают препараты иода: KJ или NaJ. В районах, где имеется дефицит иода, для профилактики эндемического зоба добавляют к поваренной соли NaJ или KJ (1-2,5 г на 100 кг). При повышенной активности щитовидной железы (гипертиреоз) вследствие избыточного синтеза тиреоидных гормонов наблюдается ненормально увеличенная скорость метаболических процессов. KJ применяют и при гипотиреозе (эндемический зоб), и при гипертиреозе. В первом случае иодид-ионы используют для синтеза гормонов, во втором случае иодид-ион тормозит иодирование тирозина иодом. При неэффективности указанных препаратов для лечения гипертиреоза применяют препарат радиоактивного иодаJ-131, излучение которого разрушает фолликулы щитовидной железы и уменьшает избыточный синтез гормонов. NaJ и KJ используют также как отхаркивающее средство при воспалительных заболеваниях дыхательных путей. Иод применяют в медицине в виде раствора в этиловом спирте (массовая доля иода 3, 5 или 10%), который является превосходным антисептическим и кровоостанавливающим средством. Кроме того, йод входит в состав ряда фармацевтических препаратов. D-элементы По содержанию в организме человека d-элементы относятся к микроэлементам (10–3 масс. % и ниже). Среди них есть жизненно необходимые (незаменимые) элементы – это Mn, Cu, Co, Fe, Zn, Mo, V (по классификации В.В. Ковальского). Другие, такие как, Cd, Cr, Ni, Ag, Hg и другие, относятся к примесным элементам, биологическая роль которых мало выяснена или неизвестна. Шесть d-элементов (Fe, Zn, Cu, Mn, Mo, Co) наряду с четырьмя s-элементами (Ca, K, Na, Mg) относятся к металлам жизни. У d-элементов сильно выражена способность к комплексообразованию (слово «комплексные» означает сложные, составные). Комплексные соединения - ярко окрашенные солеобразные вещества были известны химикам еще в XVIII веке. Одними из первых были открыты комплексные соли железа и кобальта. Многие биокатализаторы – ферменты также являются комплексными соединениями. Изучением их занимается бионеорганическая химия. Рассмотрим образование комплексной соли на конкретном примере. Если к голубому водному раствору CuSO4 прибавить раствор аммиакаNH3, то при этом раствор приобретает красивый ярко-синий цвет. Происходит реакция образования комплексной соли [Cu(NH3)4]SO4: CuSO4 + 4NH3 → CuSO4×4NH3 Строение комплексных соединений объясняет теория А. Вернера. В молекулах комплексных соединений выделяют центральный атом или ион (М) и непосредственно связанные с ним молекулы (или ионы), называемые лигандами (L), в количестве n. Центральный ион и окружающие его лиганды образуют внутреннюю сферу комплекса [MLn]. Внутренняя сфера связана электростатическими силами притяжения с внешней сферой, которая состоит из m частиц Х (молекулы или ионы). Общая запись формулы комплексного соединения имеет вид [MLn]Xm. Центральный атом координирует лиганды, геометрически правильно располагая их в пространстве. Поэтому комплексные соединения называют также координационными. Число лигандовn называется координационным числом, а внутренняя сфера – координационной. В соответствии с этим формулу комплексного соединения меди с аммиаком можно записать в виде [Cu(NH3)4]SO4, где ион меди Cu2+ – центральный ион; молекулы NH3 – лиганды; 4 – координационное число; сульфат анион SO42- – внешняя сфера. Называется данная соль сульфат тетраамминмеди (II). Комплексные соли диссоциируют на внутреннюю и внешнюю сферу по типу сильных электролитов: [Cu(NH3)4]SO4«[Cu(NH3)4]2+ + SO42-. Образующийся комплексный ион [Cu(NH3)4]2+диссоциирует как очень слабый электролит: [Cu(NH3)4]2+«Cu2+ + 4NH3. Концентрация образующихся ионов Cu2+ очень мала. Константа равновесия этого процесса называется константой нестойкости комплексного иона (комплекса):
Обратная ей величина называется константой устойчивости комплекса:
Чем больше константа устойчивости комплекса, тем более прочным он является, в меньшей степени диссоциирует на комплексообразователь и лиганды. Многие жизненно необходимые d-элементы содержатся в организме в виде комплексов с лигандами – аминокислотами, белками, нуклеиновыми кислотами, гормонами, витаминами и т.д. Так ион Fe2+ в качестве комплексообразователя входит в состав гемоглобина, Со2+ – в витамин В12. Токсичность соединений тяжелых металлов (Hg, Pb, Cd, Cr, Ni) объясняется взаимодействием катионов тяжелых металлов (МТ) с бионеорганическими комплексами. Реакция, описывающая это взаимодействие, может быть записана в виде уравнения: МБL + МТ = МБ + МТL, где МБL – комплекс иона биогенного металла МБ (Fe, Zn, Cu, Co) с биоорганическими лигандамиL (например, с порфирином); МТ – ион тяжелого металла. Если устойчивость комплекса МТL больше, чем устойчивость МБL, происходит смещение равновесия указанной обратимой реакции вправо, и в организме накапливаются токсичные соединения МТL. Свойства ионов металлов образовывать прочные связи ссеросодержащимилигандами используются и при подборе лекарств, применяемых для лечения при отравлениях. Такие лекарства имеют общее название – антидоты. Например, в нашей стране применяется отечественные препараты унитиол, сукцимер, которые образуют с ртутью прочные комплексы. В качестве антидотов при отравлении Zn, Cd, Hg применяют также комплексон этилендиаминтетрауксусную кислоту (ЭДТА) и ее натриевую соль (трилон Б). Применение комплексонов основано на том, что они, выступая в качестве лигандов, образуют более прочные комплексы с ионами металлов, чем эти ионы с серосодержащими группами белков, ферментов, аминокислот. Группа IБ IБ группу элементов составляют Cu, Ag, Au. На внешнем электронном слое атомов этих элементов содержится по одному s-электрону (ns1). В образовании химических связей могут принимать участие не только ns-электроны, но и d-электроны предвнешнего слоя: Из трех металлов группы IБ медь выполняет наиболее важную биологическую роль. Она является необходимым микроэлементом, относится к металлам жизни. Серебро – примесный микроэлемент. Золото – микроэлемент, не играющий роли для живых организмов. В организме человека медь в основном концентрируется в печени, головном мозге и крови. Известно около двадцати пяти медьсодержащих белков и ферментов. В медьсодержащих ферментах медь находится в степени окисления +1. В окислительных процессах медь окисляется до +2. Большую группу медьсодержащих белков составляют оксидазы, к которым относится важнейший дыхательный фермент цитохромоксидаза. Очень важным медьсодержащим белком является церулоплазмин, который участвует в окислении железа (Fe2+ в Fe3+), при этом медь, входящая в состав белка, восстанавливается (Cu2+ в Cu+). Церулоплазмин, образуя комплекс с ионами меди, транспортирует их в органы, регулирует баланс меди в организме и обеспечивает выведение избытка меди из организма. Медь вместе с железом участвует в кроветворении. При дефиците меди в организме нарушается обмен железом между плазмой крови и эритроцитами, что может привести к разрушению эритроцитов и развитию медьдефицитной анемии.Потребность человека в меди составляет 2–3 мг в сутки. Она полностью обеспечивается потребляемой пищей.Известна болезнь Коновалова-Вильсона, которая связана с избыточным количеством меди в организме. В больших концентрациях растворимые соли меди токсичны. Так, например, медный купорос CuSO4×5H2O массой до 2 г вызывает сильное отравление с возможным смертельным исходом. Токсическое действие меди объясняется тем, что медь образует с белками нерастворимые бионеорганические хелаты, т.е. свертывает белки. Ионы меди, имея высокое сродство к сере, образуют прочную связь с группой –SH белков, что приводит к инактивации ферментов. Медь (I) и медь (II) образуют также неорганические комплексные соединения. Координационное число меди (I) равно 2, а меди (II) равно 4 и 6. Например, гидроксид меди (II) растворяется в аммиаке, образуя комплекс, окрашивающий раствор в синий цвет (координационное число меди в этом комплексе равно 6): Cu(OH)2 + 4NH3 + 2H2O = [Cu(NH3)4(H2O)2](OH)2. Эта реакция используется для открытия (обнаружения) ионов двухвалентной меди. Группа II Б Zn, Cd и Hg составляют группу элементов IIБ. На внешнем электронном слое их атомов содержится по два s-электрона (ns2). Для них характерна постоянная валентность II и положительная степень окисления +2. Однако ртуть образует соединения, в которых она двухвалентна, а степень окисления равна +1, например, в соединении Hg2CI2 (каломель): Cl–Hg–Hg–Cl. Из трёх металлов IIБ-группы цинк выполняет наиболее важную биологическую роль и по степени своей необходимости для человека относится к металлам жизни. Считают, что кадмий и ртуть какой-либо заметной биологической функции не выполняют. Если цинк является активатором многих биохимических процессов, то кадмий и ртуть попадают в организм извне, оказывают ингибирующее (тормозящее) действие на ряд ферментов, разрушая их. Кадмий и ртуть – примесные токсичные элементы, они концентрируются в основном в почках. Цинк в организме концентрируется главным образом в мышцах, печени, поджелудочной железе, содержится также в гипофизе, половых железах, щитовидной железе. Цинк входит в состав более 40 металлоферментов, которые катализируют гидролиз пептидов, белков, некоторых эфиров и альдегидов. Одним из наиболее изученных ферментов является карбоангидраза. Этот фермент крови представляет собой бионеорганический комплекс, в котором координационное число цинка равно 4. Он влияет на процесс дыхания, газообмен в организме. Цинк входит в состав гормона инсулина, который влияет на содержание сахара в крови. Другими словами, цинк участвует в углеводном обмене. Растворимые соединения цинка, кадмия и ртути оказывают раздражающее воздействие на кожу, а при попадании внутрь организма в больших концентрациях вызывают отравление. Токсичность их увеличивается от цинка к ртути, что обусловлено усилением способности ионов этих металлов взаимодействовать с SH-группами, а это приводит к подавлению активности ферментов и свертыванию белков. Некоторые соединения цинка в небольших концентрациях нашли применение в медицинской практике. Использование их основано на вяжущем, прижигающем и небольшом антисептическом действии. Так, сульфат цинка используют для приготовления глазных капель (0,25%-ный раствор). Оксид, хлорид и сульфат цинка используют также в стоматологической практике. Цинк, как и все d-элементы, способен образовывать соединения с неорганическимилигандами. Для него координационное число 4. К числу важнейших соединений цинка относятся оксид, гидроксид, некоторые простые и комплексные соли. Оксид ZnO и гидроксид Zn(ОН)2 проявляют амфотерные свойства, растворяются не только в кислотах, но и в щелочах: ZnO + H2O + 2OН– = [Zn(OH)4]2– Zn(OH)2 + 2OН– = [Zn(OH)4]2– Гидроксид цинка получают с помощью обменной реакции при взаимодействии растворимых солей цинка со щелочами: Zn2+ + 2OН– = Zn(OH)2 Гидроксид цинка растворяется в избытке аммиака с образованием растворимых комплексных солей – аммиакатов: Zn(OH)2+ 4NH3 = [Zn(NH3)4](OH)2 Группа VIIБ Мn, Тc, Re – элементы, образующие группу VIIБ. Конфигурация валентных электронов этих элементов ns2(n-1)d5: Mn 4s23d5, Tc 5s24d5, Re 6s25d5. Из элементов этой группы наиболее распространен в природе марганец. Он относится к жизненно необходимым элементам – металлам жизни. Рений и технеций не являются биогенными элементами. Рений содержится в земной коре в незначительных количествах, технеций – радиоактивный элемент, в природе практически не встречается, получен искусственным путем. Марганец в своих соединениях проявляет степени окисления: +2, +3, +4, +6, +7. В природе наиболее распространены соединения марганца со степенью окисления +2. Из них наиболее важны оксид, гидроксид и соли. В медицинской практике из соединений марганца наиболее широко используют перманганат калия KMnO4. Перманганатами называются соли марганцевой кислоты HMnO4. В них Mn имеет высшую положительную степень окисления +7, поэтому перманганаты являются сильными окислителями. В зависимости от реакции среды они образуют различные продукты восстановления:
Как видно из уравнений, окислителями являются анионы MnO4–. Однако в таких формах марганец в биологических системах не существует. Очевидно, это связано с тем, что сильные окислители неприемлемы для организма как постоянные компоненты.
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 3320; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.135.67 (0.013 с.) |

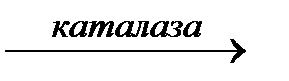 2Н2О + О2.
2Н2О + О2.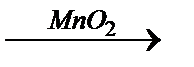 2Н2О + О2.
2Н2О + О2. .
. ; КУ = 1×1012.
; КУ = 1×1012.


