
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет рН водных растворов кислот, оснований и солейСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Для сильных кислот можно считать, что степень ионизации их в разбавленных растворах равна 1, и тогда для одноосновных кислот с(Н3O+) = с(НВ); pН = -lg c(HB) Для сильных однокислотных оснований в разбавленных растворах рОН = -lg c(B), следовательно: pН = 14 + lgc(B) При расчете рН растворов слабых кислот и оснований необходимо учитывать степень их ионизации. Для раствора слабой кислоты: с(H3O+) = Ö Ka c(HB) рН = 0,5 (рKa – lgc(HB)) Для раствора слабого основания: с(ОН-) = ÖKb c(B) рОН = 0,5 (рKb - lg с(В)) или рН = 14 - 0,5 (рKb – lg c(B)) Водные растворы солей, образованных только сильными электролитами, имеют pH 7. Водные растворы солей, образованных слабыми кислотами и сильными основаниями, имеют щелочную среду. Расчет рН раствора соли, гидролизующейся по аниону, проводят по формуле: pН = 7 + 0,5рKa +0,51g c(В-), где c(B-) - концентрация аниона, численно равная или кратная концентрации соли. Водные растворы солей, образованных сильными кислотами и слабыми основаниями, имеют кислую среду. Расчет рН раствора соли, гидролизующейся по катиону, проводят по формуле: pН = 7 - 0,5рKb - 0,51gc(HВ+), где c(HB+) - концентрация катиона, в том числе и гидратированного иона металла. Большинство реакций в организме протекает при строго контролируемых значениях рН. Поддержание на заданном уровне кислотно-основного равновесия обеспечивается на молекулярном уровне действием буферных систем. Буферная система — это равновесная система, способная поддерживать примерно на постоянном уровне какой-либо параметр при определенных внешних воздействиях. Протолитические буферные системы поддерживают постоянство рН при добавлении небольших количеств кислот и оснований. Протолитические буферные системы состоят из слабой кислоты и сопряженного с ней основания (1-й тип, например, ацетатная буферная система, состоящая из уксусной кислоты и ацетата щелочного металла) или слабого основания и сопряженной с ним кислоты (2-й тип, например, аммиачная буферная система, состоящая из аммиака и соли аммония с сильной кислотой). Раствор, содержащий одну или несколько буферных систем, называется буферным раствором. Буферные растворы можно приготовить двумя способами: 1) частичной нейтрализацией слабого электролита сильным: СН3СООН (избыток) + NaOH; NH3 (избыток) + НС1; 2) смешиванием растворов слабых электролитов с их солями (или двух солей): СН3СООН и NaСН3СОО; NH3 и NH4Cl; NaH2РO4 и Nа2НРO4. Буферные растворы имеют две главные количественные характеристики - рН и буферную емкость b. При выборе буферного раствора для проведения анализа или эксперимента руководствуются необходимой величиной рН среды и способностью ее сохранять это значение рН при внесении кислот или оснований. Если раствор содержит только одну буферную систему, то для расчета рН и b следует использовать отношение а и сумму с концентраций компонентов буферной системы НВ/В (знаки зарядов частиц НВ и В для разных типов систем разные): c(B) а = ¾¾; c = c(B) + c(HB) c(HB) Тогда рН раствора, содержащего буферную систему, определяется уравнением c(B) pH = pKa + lg ¾¾ c(HB) или pH = pKa + lga Для ацетатного буфера c(B) = с(NaCН3СОО); с(HB) = с(СН3СООН); для аммиачного буфера c(B) = с(NН3); с(HB) = с(NН4С1). Для фосфатного буфера, состоящего из кислых солей фосфорной кислоты, с(B) = с(НРО42-); с(HB) = с(Н2РO4-). Буферная емкость определяется как производная количества вещества сильной кислоты или щелочи, добавленных к 1 л буферного раствора, по изменению рН: dn b = ± ¾¾ dpH Понятно, что чем больше количество кислоты или щелочи, вызывающих одно и то же изменение рН, тем больше буферная емкость. Буферная емкость зависит не только от отношения концентраций компонентов буферной системы, но и от их общей концентрации: a b = 2,303c ¾¾¾ (a+1)2 Буферная емкость максимальна при a = 1. При малых значениях п буферная емкость одинакова как при добавлении кислоты, так и щелочи. Практически к тем или иным растворам могут добавляться значительные количества кислоты или щелочи. Тогда буферную емкость следует осмыслить как количество вещества кислоты (емкость по кислоте ba) или щелочи (емкость по основанию bb), вызывающее понижение/повышение рН на единицу. Буферные емкости bа и bb - не равные друг другу величины, определяемые уравнениями 9a ba = c¾¾¾¾¾¾ a2 + 11a + 10 9a bb = c¾¾¾¾¾¾ 10a2 + 11a + 1 Если а превышает 1, то bа еще продолжает возрастать до а = 3,16. Если а меньше 1, то bb продолжает возрастать до a = 0,316. Если величина a меньше 0,1 или больше 10, то величины b, bа и bb быстро падают, и раствор практически утрачивает буферное действие. Этим определяется зона буферного действия. Для растворов неизвестного состава буферные емкости ba и bb определяют титрованием, и проводят расчет по формуле c(1/zT)V(T) B = ¾¾¾¾¾¾ V DpH где с(1/zТ) — молярная концентрация эквивалента титранта (НС1 или КОН); V(T) - объем титранта; DрН— изменение рН буферного раствора в процессе титрования; V - объем буферного раствора, взятого для анализа. Буферная емкость будет тем больше, чем больше суммарная концентрация компонентов буферного раствора при постоянном соотношении их концентраций. При одинаковой суммарной концентрации буферная емкость больше у того раствора, у которого соотношение концентраций приближается к 1; максимальная буферная емкость будет при соотношении сb/сa = 1. Главными буферными системами организма являются гидрокарбонатная (CO2 + H2CO3/ NaHCO3), гемоглобиновая (протонированные и депротонированные формы гемоглобина и оксигемоглобина), прочие белковые системы, действующие преимущественно в плазме, фосфатные системы (H2PO4-/HPO42-, а также включающие и органические фосфаты).
Перед решением задач рекомендуется уяснить следующие основные понятия темы: 1) протолитическая теория, гидролиз солей; 2) водородный показатель (рН среды); 3) степень ионизации, константы ионизации; 4) буферные системы и растворы; 5) буферная емкость.
Уметь рассчитывать: 1) рН водных растворов кислот, оснований, солей; 2) рН буферного раствора; 3) буферную емкость.
Обратить внимание на то, что: 1) при 25 оС в кислой среде рН < 7, в щелочной среде рН >7, в нейтральной среде рН = 7; 2) рН величина безразмерная; 3) в уравнении для расчета рН буферного раствора под знаком логарифма могут стоять отношения: с осн nосн с осн исх V осн исх m осн M кисл ¾¾; ¾¾¾; ¾¾¾¾¾¾¾¾; ¾¾¾¾¾¾; с кисл n кисл с кисл исх V кисл исх M осм m кисл 4) буферную емкость по кислоте определяют по содержанию количества вещества основания буферного раствора, буферную емкость по основанию – по содержанию количества вещества кислоты буферного раствора.
Примеры решения типовых задач Пример 1 Расчет рН растворов сильных кислот Вычислите рН раствора азотной кислоты концентрации 0,001 моль/л. Решение. При решении задачи воспользуемся уравнением: pH= -lg с (HB) Подставляя известное по условию задачи значение концентрации в уравнение, вычислим: рН = - lg с (HNО3) = - lg0,001= 3 Анализ полученного ответа. Значение рН реально возможно, т.к. раствор азотной кислоты должен иметь кислую среду (рН < 7).
Пример 2 Расчет рН растворов сильных оснований Вычислите рН раствора гидроксида калия с = 0,012 моль/л. Решение. Для сильных однокислотных оснований pОH = - lg с (В), следовательно рН = 14 - pОH = 14 + lg с (В) [5.6 ] Подставляя в уравнение [5.6] известное по условию задачи значение концентрации раствора КОН, находим: рН = 14 + lg 0,012 = 14,0 – 1,92 = 12,1 Анализ полученного ответа. Значение рН = 12,1 реально возможно, т.к. раствор КОН имеет щелочную среду рН > 7. Пример 3 Расчет концентации ионов водорода по значению рН Рассчитайте концентрацию протонов в слезной жидкости, рН = 7,4. Решение. При решении задачи воспользуемся уравнением: рН = -lg с, Отсюда: с = 10-рН Ответ: с = 10-7,4 = 3,9 ×10-8 моль/л. Пример 4 Расчет рН раствора с учетом ионной силы. Принимая во внимание ионную силу раствора, вычислите рН двух растворов, каждый из которых содержит в 0,5 л по 0,63 г азотной кислоты. Один из растворов содержит также 85 мг нитрата натрия. Решение. Рассчитаем молярные концентрации электролитов по формуле: с (Х) = m (Х)/ M (Х) V с (НNO3) = 0,63 г/63 (г/ моль) × 0,5 л = 0,02 моль/л с (NаNО3) = 0,085 г/ 85 (г/ моль) × 0,5 л = 0,002 моль/л Ионную силу раствора рассчитаем по формуле: I = 0,5 [ с (Н+)×12 + с (NO3-)× (-1)2]= c = 0,02 Вычислим суммарную концентрацию нитрат-иона: с (NO3-) = с (NаNО3) + с (НNО3)= 0,002 +0,02 = 0,022 моль/л I = 0,5 [ с (Н+)×12 + с (NO3-)× (-1)2+ с (Nа+)×12]= c = 0,022 Для разбавленных растворов коэффициент активности рассчитаем по уравнению Дебая –Хюккеля: lg f = -0,5z2Ö I, а активность ионов по формуле: а = fс Для раствора азотной кислоты: lg f = -0,5×1Ö0,02 = - 0,07071 Для раствора кислоты и ее соли: lg f = -0,5×Ö0,022 = - 0,0742 Вычислим значение f и а, учитывая, что рН раствора кислоты и соли определяет только концентрация кислоты: Для раствора кислоты f = 10 – 0,07071 = 0,12; а = 0,07071 × 0,02 = 0,0024 Для раствора кислоты и соли f = 10 – 0,0742 = 0,176; а = 0,176× 0,02 = 0,00352 Рассчитаем рН раствора сильной кислоты: рН = - lg а = 2,62 Рассчитаем рН раствора кислоты и соли: рН = - lg а = 2,45 Ответ: 2,62; 2,45. Пример 5 Расчет рН растворов слабых кислот Вычислите рН раствора уксусной кислоты концентрации 0,04 моль/л. Решение. Учитывая степень ионизации слабой кислоты, воспользуемся уравнением: рН = 0,5(р Ка - lg с (НВ)), где р Ка - показатель константы ионизации слабой кислоты (табличная величина; табл.) p Ka = -lg K a Подставляя в уравнение [5.8] известное по условию задачи значение концентрации СН3СООН и определив по таблице () р Ка (СН3СООН) = 4,76, вычислим: рН = 0,5× (4,76 - lg 0,04) = 1,7 Анализ полученного ответа. Значение рН = 1,7 реально возможно, т.к. раствор уксусной кислоты имеет рН < 7.
Пример 6 Расчет рН растворов слабых оснований Вычислите рН раствора аммиака с = 0,0025 моль/л. Решение. Учитывая степень ионизации слабого основания, воспользуемся уравнением: рН = 14 – 0,5(р Кb - lg с (В)), где р Кв - показатель константы ионизации слабого основания (табличная величина; табл.). Величины р Ка и р Кb для протолитической пары связаны соотношением: р Ка + р Кb = 14. Предварительно, определив р Кb (NH3)= 14 - р Ка (NН4+)= 14 - 9,24 = 4,76, подставим известное по условию задачи значение концентрации раствора аммиака в уравнение и вычислим рН: рН = 14 – 0,5(4,76 - lg 0,0025) = 10,3 Анализ полученного ответа. Задача решена верно, т.к. рН раствора аммиака больше 7.
Пример 7 Расчет рН растворов протолитов, полученных смешением растворов одного и того же вещества Смешали два раствора HCl: объемом 50 мл с концентрацией 0,2 моль/л и объемом 300 мл с концентрацией 0,02 моль/л. Вычислите рН полученного раствора. Решение. Определим концентрацию полученного раствора: с1V 1+ с2V 2 с = ¾¾¾¾¾¾ V 1+ V 2 Для сильной одноосновной кислоты (HCl): рН = - lg с (HB) 0,2 моль/л× 0,05 л + 0,02 моль/л×0,3л с = ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾ = 0,046 моль/л 0,35 л рН = -lg 0,046 = 1,3 Анализ полученного ответа. Задача решена верно, т.к. рН полученного раствора меньше 7.
Пример 8 Расчет рН растворов протолитов, полученных смешением растворов разных веществ Вычислите рН раствора, полученного смешением равных объемов растворов с (HCl)= 0,015 моль/л и с (NaOH) = 0,03 моль/л. Решение. По условию задачи раствор кислоты прореагировал полностью. Следовательно, после протекания реакции нейтрализации среда полученного раствора будет щелочной. Определим концентрацию NаОН после завершения реакции. Для определения рН растворов сильных оснований воспользуемся уравнением. HCl + NaOH Взято: 0,015 V моль 0,0 3 V моль Осталось: 0,03 V - 0,015 V = 0,015 V, т.к. кислота и щелочь реагируют в соотношении 1: 1. Концентрация с (NaOH) после реакции = n/V = 0,015 V (моль) /2 V (л) = 0,0075 моль/л рН = 14+lg с = 14+lg 0,0075 = 11,9 Анализ полученного ответа: Задача решена верно, т.к. среда полученного раствора щелочная (11,9>7). Пример 9 Расчет рН растворов гидролизующихся солей Вычислите рН раствора NH4NO3 с концентрацией 0,1 моль/л. Решение. NH4NO3 - соль, образованная слабым основанием и сильной кислотой. Соли такого типа гидролизуются по катиону: NH4+ +Н2О Û NH3 + H3О+ При решении задачи воспользуемся уравнением: pH=7 – 0,5 (p Kb + lg c (HB+)). Предварительно, определив р Kb (табл.): р Kb = 14 - р Kа = 14 - 9,24 = 4,76, вычислим рН: рН = 7 – 0,5× (4,76 + lg 0,1) = 5,12. Анализ полученного ответа: Задача решена верно, т.к. раствор соли NH4NO3 имеет кислую среду (рН < 7). Пример 10 Расчет степени ионизации Вычислите степень ионизации фенолфталеина в растворе с рН 9,2. Решение. Для расчета степени ионизации индикатора используют формулу: a рН = р Ка + lg ¾¾-, 1 - a где a - степень ионизации индикатора. р Ка – показатель константы ионизации индикатора(табличная величина; табл.) Подставляя в данное уравнение известное по условию задачи значение рН раствора и определив по таблице () р Ка (фенолфталеина) = 9,37, вычислим a: a 9,2 = 9,37 + lg ¾¾- 1 - a a = 0,4034 Ответ: 0,4034. Пример 11 Расчет константы протолитического равновесия Силовые показатели щавелевой кислоты по первой и второй ступеням равны 1,25 и 4,27, соответственно. Вычислите константу равновесия процесса: НООС-СООН Û 2Н+ + -ООС-СОО- Решение. Запишем процесс диссоциации кислоты по ступеням: Н2С2О4 Û Н+ + НС2О4- НС2О4- Û Н+ + С2О42- Запишем выражение для константы суммарного процесса: с2 (Н+) с (НС2О4-) с (С2О42-) с (Н2С2О4) с (НС2О4-)
Учитывая, что Ка = 10- р Ка , вычислим константу равновесия процесса: НООС-СООН Û 2Н+ + -ООС-СОО- К= Ка1Ка2 = 10-1,25×10-4,27 = 3,019 ×10-6. Ответ: 3,019 ×10-6. Пример 12 Расчет рН буферных растворов При определении альбумина по реакции с бромкрезоловым зеленым применяют ацетатный буфер. Уксусную кислоту объемом 50 мл смешивают с 13,2 мл раствора гидроксида натрия (концентрация каждого раствора равна 1 моль/л) и объем доводят дистиллированной водой до 1 л. Вычислите рН используемого раствора. Решение. При смешении двух растворов протекает реакция: CH3COOH + NaOH = CH3COONa + H2О, а1 b2 b1 а2 в результате которой образуется ацетатный буферный раствор. Вычислив концентрации компонентов буферного раствора, воспользуемся уравнением: рН = р Kа + lg с осн/ с кисл где р Kа - табличная величина, (табл.). Для ацетатного буфера с b = с (СН3СООNа); са = с (СН3СООН). CH3COOH + NaOH = CH3COONa + H2О Было:50 ммоль 13,2 ммоль Осталось: (50 - 13,2) ммоль с (СН3СООН) после смеш. = с (CH3COONa) после смеш. = Для расчета рН буферного раствора воспользуемся уравнением, подставив в него известные значения: 13,2 ммоль/л pH=4,76 + lg ¾¾¾¾¾¾¾¾¾ (50 – 13,2) ммоль/л рН = 4,32 Ответ: рН буферного раствора равен 4,32. Пример 13 Расчет масс веществ для приготовления буферного раствора с заданными параметрами Вычислите массу хлорида аммония, которую следует добавить к раствору аммиака с концентрацией 0,137 моль/л и объемом 2 л, чтобы получить буферный раствор с рН 10,34. Решение. Запишем протолитическое равновесие: NH3 + Н2О = NH4+ + ОН- b1 а2 a1 b2 При решении задачи воспользуемся уравнением. Для аммиачного буфера, состоящего из аммиака и хлорида аммония сb = с (NH3); сa = с (NH4+) Концентрацию NH4+ выразим: m(NH4Cl) с (NH4+) = ¾¾¾¾¾¾¾ M(NH4Cl) V Тогда уравнение примет вид: с (NH3) M(NH4Cl) V рН = р Ка + lg ¾¾¾¾¾¾¾¾¾¾¾ m(NH4Cl) Преобразуем данное выражение: с (NH3) M(NH4Cl) V ¾¾¾¾¾¾¾¾¾ = 101,1 m(NH4Cl)
с (NH3)M(NH4Cl) V ¾¾¾¾¾¾¾¾¾ = 12,59 m(NH4Cl) Подставив в полученное выражение известные величины, вычислим m: 0,137 моль/л × 53,5 г/моль × 2л ¾¾¾¾¾¾¾¾¾¾¾¾¾ = 1,16 12,59 m = 1,16 Ответ: для получения буферного раствора с рН 10,34 необходимо взять 1,16 г хлорида аммония.
Пример 14 Расчет массы одного из компонентов буферного раствора с заданными параметрами Имеется 100 мл раствора уксусной кислоты, в котором степень ее диссоциации равна 1,9 %. Вычислите массу ацетата калия, которую следует добавить в этот раствор для получения буферного раствора с рН 4,0. Решение. Связь между степенью диссоциации и константой диссоциации слабых электролитов описывается уравнением Оствальда: a2 с К = ¾¾ 1 - a Расчет объемов веществ для приготовления буферного раствора с заданными параметрами a<< 1, величиной a в знаменателе можно пренебречь, т.к. 1 - a @ 1 и уравнение примет более простой вид: К = a2с K 1,74·10-5 Откуда с = ¾¾¾ = ¾¾¾ = 0,0482 моль/л a2 (0,019)2 Для ацетатного буфера с b = с (СН3СООК); са = с (СН3СООН). Для расчета массы соли воспользуемся уравнением [5.13], подставив в него известные значения: m (СН3СООК) рН = р Ка + lg ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾, с (СН3СООН) V (СН3СООН) M (СН3СООК) где р Kа - табличная величина, (табл.). m (СН3СООК) 4,0 = 4,76 + lg ¾¾¾¾¾¾¾¾¾¾¾¾¾¾ 0,0482 моль/л × 0,1 л × 98 г/моль Откуда m (СН3СООК) = 0,0821 г Ответ: для приготовления ацетатного буфера с рН 4,0 следует взять 0,0821 г ацетата калия.
Пример 15 Расчет объемов веществ для приготовления буферного раствора с заданными параметрами Вычислите объемы растворов гидрофосфата натрия с концентрацией 0,1 моль/л и дигидрофосфата натрия с концентрацией 0,15 моль/л для приготовления буферного раствора объемом 1 л с рН =7,0. Решение. Запишем протолитическое равновесие: H2PO4- + H2O = H3O+ + HPO42- а1 b2 а 2 b1 Найдем отношение концентраций солей в буферном растворе, который надо приготовить: с (HPO42-) рН = р Ка + lg ¾¾¾¾¾¾, где с (H2PO4-) р Ка - табличная величина (табл.). р Ка (H2PO4-) = 7,21. Обозначим объем раствора гидрофосфата натрия за х (л), тогда объем раствора дигидрофосфата натрия (1-х) (л). Количества веществ этих солей в приготовленном растворе будет равно соответственно 0,1 х (моль) и 0,15(1-х) (моль). Поскольку эти количества веществ находятся в одном и том же объеме, отношение концентраций можно заменить отношением количеств веществ: с (HPO42-) 7,0 = 7,21 + lg ¾¾¾¾¾ = - 0,21 с (H2PO4-) с (HPO42-) ¾¾¾¾¾ =0,617 с (H2PO4-)
x = 0,48 л, т.е. V (Na2HPO4) = 0,48 л; V (NaH2PO4) = 0,52 л Ответ: для приготовления раствора нужно взять 480 мл раствора гидрофосфата натрия и 520 мл дигидрофосфата натрия.
Пример 16 Какое максимальное и минимальное количество вещества муравьиной кислоты можно добавить к 5,6 г гидроксида калия, чтобы после растворения смеси в воде получился буферный раствор. Решение. При смешении двух растворов протекает реакция: НСООН + КОН Û НСООК + Н2О a 1 b 2 b 1 a 2 в результате которой образуется формиатный буферный раствор. Взято: х моль 0,1 моль Осталось: (х-0,1) 0,1, т.к. кислота и щелочь реагируют в соотношении 1:1. Буферное действие наблюдается, если концентрация одного из компонентов превышает другую не более, чем в 10 раз. n(НСООК) 0,1 < ¾¾¾¾¾ < 10 n(НСООН) Подставим в это неравенство значения количеств веществ компонентов буферного раствора: 0,1 0,1< ¾¾¾ < 10 х-0,1 Решая неравенство, получим: 0,11< х < 0,9 Ответ: для получения буферного раствора необходимо минимальное количество муравьиной кислоты 0,11 моль, максимальное - 0,9 моль.
Пример 17 Выявление буферных свойств раствора на основании анализа количеств веществ его компонентов Серия растворов приготовлена смешением двух растворов: А) гидроксида натрия и уксусной кислоты с =0,1 моль/л; V =10 мл с =0,05 моль/л; V =5 мл; Б) гидроксида натрия и уксусной кислоты с= 0,05 моль/л; V =5 мл с =0,1 моль/л; V =10 мл; В) ацетата натрия и соляной кислоты с =0,1 моль/л; V =10 мл с =0,05 моль/л; V =5 мл; Г) ацетата натрия и уксусной кислоты с=0,1 моль/л; V =10 мл с =0,01 моль/л; V =5 мл; Д) гидроксида натрия и ацетата натрия с=0,1 моль/л; V =10 мл с =0,01 моль/л; V =5 мл. Решение. Только компоненты раствора Г могут образовать буферную систему, т.е. протолитическую пару слабая кислота-сопряженное основание. В растворах А, Б, В подобные пары могут образоваться в результате обменных реакций. Однако необходимо сделать расчет, т.к. в избытке может оказаться и слабый электролит (пара образуется), и сильный (пары не образуется). Раствор Д не содержит компоненты, отвечающие данным условиям, и они не могут образоваться в результате реакций. Раствор Д однозначно не обладает буферным действием. Рассчитаем, какие компоненты останутся после протекания реакции в растворах А, Б, В. Для этого рассчитаем количества вступающих в реакции веществ(в ммоль): А) n(NаОН) = 0,1×10 = 1 ммоль и n(СН3СООН) = 0,05× 5 = 0,25 ммоль Поскольку кислота прореагирует полностью, то по окончании реакции в растворе останутся NаОН и СН3СООН; протолитическая пара не образуется. Б) n(NаОН) = 0,05×5 = 0,25 ммоль и n(СН3СООН) = 0,1×10 = 1 ммоль Поскольку щелочь прореагирует полностью, по окончании реакции в растворе будут СН3СООН (1 – 0,25 =0,75 ммоль) и СН3СООNа (0,25 ммоль); протолитическая пара образуется. В) n(СН3СООNа) = 0,1×10 = 1 ммоль и n(НСl) = 0,05×5 = 0,25 ммоль Поскольку кислота прореагирует полностью, по окончании реакции в растворе будут СН3СООН (0,25 ммоль) и СН3СООН (1 – 0,25 = 0,75 ммоль); протолитическая пара образуется. Для окончательного ответа на вопрос надо выяснить, отвечает ли соотношение компонентов в растворах Б, В, Г зоне буферного действия: Б) В) Г) с b 0,25 0,75 10 × 0,1 ¾¾ = ¾¾¾ = 0,33; ¾¾¾ = 3; ¾¾¾¾ = 20 с а 0,75 0,25 5 × 0,01 Соотношение компонентов только в растворах Б и В отвечает зоне буферного действия. Ответ: буферным действием обладают растворы Б и В.
Пример 18 Сравнение буферной емкости растворов Буферные растворы приготовлены смешением растворов: аммиака и хлорида аммония
Расположите растворы в порядке возрастания их буферной емкости. Ответ подтвердите расчетом. Решение. Рассчитаем для каждого раствора количества вещества основания (NH3) и кислоты (NH4+).
Приведенные расчеты показывают, что отношения количеств веществ во всех растворах одинаково. Следовательно,этот фактор в данной задаче не может быть использован для ответа на вопрос.Поэтому необходимо рассмотреть влияние другого фактора: суммарной концентрации. Суммарное количество веществ для всех растворов также одинаково: 0.15+ 0,05 = 0,20 ммоль. Однако это количество вещества находится в разных объемах:
Чем меньше объем приготовленного буферного раствора, тем больше суммарная концентрация его компонентов и больше буферная емкость. В порядке убывания объема растворы располагаются следующим образом: Г, Б, В, А. В этой последовательности и будет возрастать буферная емкость.
Пример 19. Сравнение буферной емкости растворов Буферные растворы приготовлены смешением растворов: муравьиной кислоты и формиата натрия
Расположите буферные растворы в порядке возрастания их буферной емкости по кислоте. Решение. В формиатном буфере, приготовленном смешением растворов муравьиной кислоты и формиата натрия, сb = с (НСООNа); са = с (НСООН). Рассчитаем количество формиата натрия в каждом буферном растворе. Чем больше количество HCOONa в буферном растворе, тем больше буферная емкость по кислоте. А) ν (HCOONa) = с V = 5 · 0,04 = 0,200 ммоль Б) ν (HCOONa) = 2,5· 0,12 =0,300 ммоль В) ν (HCOONa) = 7,5· 0,03 =0,225 ммоль Г) ν (HCOONa) = 5,0· 0,05 =0,250 ммоль Ответ: Расположим буферные раствора порядке возрастания их буферной емкости по кислоте: А, В, Г, Б.
Пример 20 Расчет параметра титранта по величине буферной емкости Буферная емкость раствора по кислоте равна 40 ммоль/л. Вычислите, какой объем раствора серной кислоты с молярной концентрацией 0,2 моль/л можно добавить к 150 мл этого раствора, чтобы сместить рН не более, чем на 0,5 единицы? Решение. Буферную емкость по кислоте рассчитывают по формуле: с (1/z) V (Т) В= ¾¾¾¾ V буф.р.DрН Подставив известные величины в это уравнение, вычислим объем раствора серной кислоты. Фактор эквивалентности двухосновной кислоты равен ½. с (1/2Н2SО4) = 2 с (Н2SО4) 0,4(моль/л)× V (Н2SО4) 0,04= ¾¾¾¾¾¾¾¾¾ 0,15 л × 0,5 Откуда V (Н2SО4) = 0,0075 л = 7,5 мл Ответ: 7,5 мл.
Домашнее задание:
1. Приведите формулы трех органических монокарбоновых кислот:
__________________________________________________________________________________________________________________________________________________________________________ _____________________________________________________________________________________
рН раствора этой кислоты, с(Х)=0,12 моль/л, равен. __________________________________________________________________________________________________________________________________________________________________________ _____________________________________________________________________________________
2. Приведите формульный состав трех буферных систем:
__________________________________________________________________________________________________________________________________________________________________________ _____________________________________________________________________________________
рН раствора, содержащего данную буферную систему (концентрация сопряженного основания вдвое превышает концентрацию сопряженной кислоты), равен __________________________________________________________________________________________________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии». 5.16; 5.52; 5.53; 5.60; 5.67; 5.69; 5.70; 5.72; 5.75 5.102; 5.106; 5.107; 5.120; 5.126; 5.128; 5.129; 5.131; 5.135
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 6889; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.62 (0.018 с.) |

 ® Na Cl + Н2О
® Na Cl + Н2О / V буф.р-ра = (50 – 13,2) ммоль/1 л
/ V буф.р-ра = (50 – 13,2) ммоль/1 л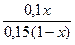 = 0,617
= 0,617 Какая из приведенных кислот является наиболее сильной? Ответ объясните, используя справочные данные.
Какая из приведенных кислот является наиболее сильной? Ответ объясните, используя справочные данные. Какая из приведенных буферных систем способна поддерживать в растворе большее значение рН? (при с(B) = с(HB)). Ответ объясните, используя справочные данные.
Какая из приведенных буферных систем способна поддерживать в растворе большее значение рН? (при с(B) = с(HB)). Ответ объясните, используя справочные данные.


