
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обучающая Лабораторная тетрадьСодержание книги
Поиск на нашем сайте
ПО КУРСУ ОБЩЕЙ ХИМИИ
СТУДЕНТА_____________________ ГРУППЫ __________________________ФАКУЛЬТЕТА __________________________ОТДЕЛЕНИЯ ФАМИЛИЯ _____________________________ ИМЯ ___________________________________ ОТЧЕСТВО _____________________________ ПРЕПОДАВАТЕЛЬ ______________________ Учебный год Москва
ОСНОВНЫЕ ПРАВИЛА РАБОТЫ В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ И ТЕХНИКА ВЫПОЛНЕНИЯ ХИМИЧЕСКОГО ЭКСПЕРИМЕНТА
Правила поведения в химической лаборатории и технику безопасности: ü к эксперименту приступают только после ознакомления со всеми его этапами; ü на лабораторном столе должны находиться только необходимые для эксперимента приборы, оборудование лабораторный журнал; ü в лаборатории работают только в халате; ü нельзя брать руками вещества и пробовать их на вкус; ü опыты с ядовитыми и летучими веществами, концентрированными растворами кислот и щелочей проводят под тягой; ü при приливании реактивов нельзя наклоняться над отверстием сосуда во избежание попадания брызг на лицо и одежду; ü нельзя работать с легковоспламеняющимися жидкостями вблизи включенных электрических и нагревательных приборов; ü нельзя выливать в раковину остатки кислот, щелочей и огнеопасных веществ их следует сливать в специально предназначенные для этого склянки; ü для засасывания кислот и щелочей в пипетку пользуются резиновыми грушами; ü разбавляя концентрированные кислоты, осторожно вливают кислоту в воду, а не наоборот.
При несоблюдении правил техники безопасности в лаборатории, бывают несчастные случаи, требующие первой неотложной помощи, для ее оказания в лаборатории должна быть аптечка. Основные правила скорой помощи следующие:
Прежде чем приступить к эксперименту, студенты должны изучить соответствующий раздел учебника, лекций, а также ознакомиться с описанием работы и ответить на вопросы для самоподготовки.
С правилами поведения в химической лаборатории и техникой безопасности ознакомилась(ся)
Фамилия _____________________ Имя_________________ Отчество _______________________
Дата: Подпись: _____._____20____ ____________________ Занятие 1. Дата ____.____. 20 ___
Тема: Способы выражения состава растворов. Приготовление растворов. Теоретический материал к занятию:
Эквивалент – это реальная или условная частица вещества Х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции одному электрону.
Массовая доля растворенного вещества Х – растворенное вещество
Молярная концентрация,
Молярная концентрация эквивалента
Фактор эквивалентности,
Молярная масса эквивалента,
Плотность раствор,
Моляльная концентрация,
Формулы перехода от одних способов выражения состава раствора к другим
Задача. Какой объем соляной кислоты ( ρ =1,070 г/мл) и воды необходим для приготовления раствора HCl объемом 200 мл и молярной концентрацией 0,1 моль/л для кислотно-основного титрования натрия тетрабората.
2. Массу исходного раствора HCl можно рассчитать по формуле:
m (p-p HCl) = m (HCl) / V (HCl) (m (HCl) и V (HCl) – неизвестны)
3. Массовую долю ω можно найти в справочнике, зная плотность ρ исходного раствора HCl. Массу HCl можно рассчитать зная молярную массу вещества и количество вещества
m (HCl) = M (HCl) · n (HCl) (n (HCl) – неизвестно)
4. Количество вещества HCl можно рассчитать зная объем раствора и его концентрацию n (HCl) = V (p-p) · C(HCl) (обе величины даны в условии задачи)
4.1 n (HCl) = 0,2 л · 0,1 моль/л = 0,02 моль
4.2 m (HCl) = 36,5 г/моль · 0,02 моль = 0,73 г
4.3 ω (%) = 14% или ω (в долях) = 0,14 (по таблице №14)
4.4 m (p-p HCl) = 0,73 г / 0,14 = 5,2 г
4.5 V (р-р HCl) = 5,2 г / 1,07 г/мл = 5мл
4.6 V(H2О) = 200 мл - 5 мл = 195 мл
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 191; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.23.102.79 (0.006 с.) |



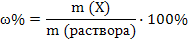



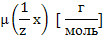


 (m (р-р HCl) – неизвестна)
(m (р-р HCl) – неизвестна)



