
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Для расчетно-графической работыСодержание книги Поиск на нашем сайте
Вариант индивидуального задания выбирают по двум последним цифрам зачетной книжки. Например, если номер зачетной книжки 02123, номер варианта – «23».
План выполнения расчетно – графической работы Расчетно – графическую работу следует выполнять по предлагаемому плану. Содержание работы состоит из следующих пунктов: Введение 1.Характеристика объекта исследования. 2. Расчет водородного показателя воды. 3. Гидролиз солей. 4. Расчет показателей жесткости воды. 5. Расчет дозы реагентов для умягчения воды. 6. Обработка результатов определения содержания взвешенных веществ в воде математическим методом. 7. Расчетное задание по оценке качества питьевой воды. 8. Графическое выражение результатов анализа воды. 9. Расчет содержания карбонатных ионов в воде. 10. Расчетно–графическое определение параметров стабилизационной обработки воды. 11. Расчетно - графическое определение величины хлорпоглощаемости воды. Литература ПРИМЕР ВЫПОЛНЕНИЯ ИНДИВИДУАЛЬНОГО ЗАДАНИЯ
Характеристика объекта исследования.
Объект исследования – природная вода, отобранная из подземного источника. Дата отбора пробы: май 2014 года.
Расчет водородного показателя воды Теоретическая часть Чистая вода – слабый электролит, частично диссоциирует на ионы: Н2О ⇄ Н+ + ОН-
Кдисс• [Н2О] = [Н+] • [ОН-] При определенной температуре Кдис. и [Н2О] – величины постоянные, следовательно: KH2O = [Н+] • [ОН-] = 10-14 – ионное произведение воды В чистой воде [H+] = [OH-] = рН - это отрицательный десятичный логарифм концентрации водородных ионов: рН = – lg[H+] Следовательно,
Из логарифмической формы ионного произведения воды следует: рН + рОН = 14 рОН = 14 – рН рОН = – lg[ОН-] Чтобы найти концентрацию ионов водорода по величине рН необходимо: [Н+] = 10-рН Чтобы найти концентрацию гидроксильных ионов по величине рOН необходимо: [OН-] = 10-рOН Расчет рН растворов сильных и слабых электролитов
Сильные кислоты и основания (табл.2.1) в растворах диссоциируют пол- ностью, поэтому концентрация ионов водорода и ионов гидроксила равна общей концентрации сильного электролита. Для сильных оснований: [ OH-] = С м;длясильных кислот: [ H+] = См. Таблица 2.1 Сильные электролиты
Слабым электролитом принято считать химические соединения, молекулы которых даже в сильно разбавленных растворах не полностью диссоциируют на ионы. Степень диссоциации слабых электролитов для децимолярных растворов (0,1М) меньше 3%. Примеры слабых электролитов: все органические кислоты, некоторые неорганические кислоты (например, H2S, HCN), большинство гидроксидов (например, Zn(OH)2, Cu(OH)2). Для растворов слабых кислот концентрация ионов водорода [H+] в растворе рассчитывается по формуле:
где: Кк – константа диссоциации слабой кислоты; Ск – концентрация кислоты, моль/дм3. Для растворов слабых оснований концентрация гидроксильных ионов рассчитывается по формуле:
где: Ко – константа диссоциации слабого основания; Сосн. – концентрация основания, моль/дм3. Таблица 2.2 Константы диссоциации слабых кислот и оснований при 25 оС
2.2. Примеры решения индивидуального задания Пример №1. Условие задания: Определить концентрацию водородных и гидроксильных ионов в растворе, если рН =5,5. Решение Концентрация ионов водорода рассчитывается по формуле: [Н+] = 10-рН [Н+] = 10-5,5 = 3,16 •10-6 моль/дм3 Концентрация гидроксильных ионов рассчитывается по формуле: [OН-] = 10-рOН рОН = 14 – рН = 14 – 5,5 = 8,5 [OН-] = 10 -8,5 = 3 • 10-9 моль/дм3 Пример № 2. Условие задания: Вычислить рН 0,001 М раствора HС1. Решение Кислота HС1 является сильным электролитом (табл.2.1) и в разбавленных растворах практически полностью диссоциирует на ионы: HС1⇄ Н+ + С1- Поэтому концентрация ионов [Н+] равна общей концентрации кислоты: [Н+] = См = 0,001 М. [Н+] = 0,001= 1·10-3 моль/дм3 Тогда: рН = – lg[H+] = – lg 1 • 10-3 = 3 Пример № 3. Условие задания: Вычислить рН 0,002 М раствора NaOH. Решение Основание NaOH является сильным электролитом (табл.2.1) и в разбавленных растворах практически полностью диссоциирует на ионы: NaOH ⇄Na++OH- Поэтому концентрация гидроксильных ионов равна общей концентрации основания: [ОH-]= См = 0,002 М. Тогда: рОН = – lg[ОН-] = – lgСм = – lg 2 •10-3 = 2,7 Исходя из формулы: рН + рОН = 14, находим рН раствора: рН = 14 – 2,7 = 11,3 Пример №4. Условие задания: Вычислить рН 0,04 М раствора NH4OH, если константа диссоциации Кд(NH4OH) = 1,79·10-5 (табл.2.2). Решение Основание NH4OH является слабым электролитом и в разбавленных растворах очень незначительно диссоциирует на ионы. Концентрация гидроксильных ионов [ОH-] в растворе слабого основания рассчитывается по формуле:
рОН = – lg[ОH-] = – lg 8,5·10-2 = 1,1 Исходя из формулы: рН + рОН = 14, находим рН раствора: рН = 14 – рOН = 14 – 1,1 = 12,9 Пример №5. Условие задания: Вычислить рН 0,17 М растворауксусной кислоты (CH3COOH), если константа диссоциации Кд(CH3COOH) = 1,86 • 10-5 (табл.2.2). Решение Кислота CH3COOH является слабым электролитом и в разбавленных растворах очень незначительно диссоциирует на ионы. Концентрация ионов водорода [H+] в растворе слабой кислоты рассчитывается по формуле:
Тогда:
Вычисляем pH раствора по формуле: рН = – lg [H+] pH = – lg 1,78 • 10-3 = 2,75 2.3. Индивидуальные задания Условия заданий (табл. 2.3): Задание № 1. Вычислить концентрацию водородных и гидроксильных ионов в растворе при определенном значении рН (см. пример № 1); Задание № 2. Вычислить рН раствора сильного электролита (кислоты, основания) при заданной концентрации (см. пример № 2, 3); Задание № 3. Вычислить рН раствора слабого электролита (кислоты, основания) при заданной концентрации (см. пример № 4, 5). Таблица 2.3 Состав исследуемой воды
Продолжение табл. 2.3
Гидролиз солей Теоретическая часть Гидролиз солей – взаимодействие ионов соли с водой, приводящее к образованию слабого электролита. В результате гидролиза происходит смещение равновесия диссоциации воды вследствие образования малодиссоцирующих соединений, малорастворимьх и летучих веществ. Поэтому гидролизуютcя только катионы слабых оснований и анионы слабых кислот, то есть три типа солей: 1) соли, образованные слабыми основаниями и сильными кислотами (гидролиз по катиону), например, NН4CI, Mg(NO3)2, FeС13; 2) соли, образованные сильными основаниями и слабыми кислотами (гидролиз по аниону), например, СН3СООNa, Na2CO3, Na2SO3; 3) соли, образованные слабыми основаниями и слабыми кислотами (гидролиз по катиону и аниону), например, CH3COONН4, Аl2S3, (NH4)2S. Формулы сильных и слабых кислот и оснований приведены в табл. 2.1 и 2.2. 3.2. Примеры решения индивидуального задания Пример №1. Условие задания: Написать уравнение ступенчатого гидролиза соли Na2CO3. Указать реакцию среды и константу равновесия для каждой стадии. Решение Гидролиз соли Na2CO3, образованной сильным основанием NaОН и слабой двухосновной кислотой H2CO3, протекает ступенчато в 2 стадии: I ступень: Na2CO3 + HOH ⇄ NaHCO3 + NaOH Na + + СО32- + HOH ⇄ Na + + HCO3– + Na + + OH– СО32- + HOH ⇄ HCO3– + OH– (среда щелочная, рН > 7) Константа равновесия I ступени:
II ступень: NaНCO3 + HOH ⇄ H2CO3 + NaOH Na + + НCO3– + HOH ⇄ Н2CO3 + Na + + OH- НCO3– + HOH ⇄ Н2CO3 + OH- (среда щелочная, рН > 7) Константа равновесия II ступени:
Пример № 2. Условие задания: Написать уравнение ступенчатого гидролиза соли FeCl2. Указать реакцию среды и константу равновесия для каждой стадии. Решение Гидролиз соли FeCl2, образованной слабым многокислотным основанием Fe(OH)2 и сильной кислотой HCl, протекает ступенчато в 2 стадии: I ступень: FeCl2 + HOH ⇄ Fe(OH)Cl + HCl Fe2+ + 2 Cl- + HOH ⇄ FeOH+ + Cl- + H+ + Cl- Fe2+ + HOH ⇄ FeOH+ + H+ (среда кислая, рН < 7) Константа равновесия I ступени:
II ступень: Fe(OH)Cl + HOH ⇄ Fe(OH)2+ HCl FeOH+ + Cl- + HOH ⇄ Fe(OH)2 + H+ + Cl- FeOH+ + HOH ⇄ Fe(OH)2 + H+ (среда кислая, рН < 7)
Константа равновесия II ступени:
Пример № 3. Условие задания: Написать уравнение гидролиза солиKCN. Вычислить константу гидролиза Кг, концентрацию ионов водорода [H+] и рН раствора соли, если известно, что концентрация соли 0,1М, а константа диссоциации синильной кислоты Кд(HCN) = 7,2 • 10-10 (табл.2.2). Решение 1. Уравнение реакции гидролиза соли KCN, которая образована сильным основанием KOH и слабой кислотой HCN имеет вид: KCN + НОН ⇄ КОН + НCN K+ + CN- + НОН ⇄ К+ + ОН- + НCN CN- + НОН ⇄ ОН- + НCN
2. Константа гидролиза Кг для соли, которая образована сильным основанием и слабой кислотой, рассчитывается по формуле:
Тогда:
3. Концентрация ионов водорода равна:
4. Рассчитываем рН раствора соли: pH = – lg 8,5 • 10-13 = 12,07 Пример № 4. Условие задания: Написать уравнение гидролиза солиNH4Cl. Вычислить константу гидролиза Кг, концентрацию ионов водорода [H+] и рН раствора соли, если известно, что концентрация соли 0,1М, а константа диссоциации гидроксида аммония Кд(NH4OH) = 1,79 •10-5 (табл. 2.2).
Решение 1.Уравнение реакции гидролиза соли NH4Cl, которая образована слабым основаниемNH4OH и сильной кислотой HCl, имеет вид: NH4Cl + НОН ⇄ NH4ОН + HCl NH4+ + Cl- + НОН ⇄ NH4ОН + H+ + Cl- NH4+ + НОН ⇄ NH4ОН +H+
2. Константа гидролиза Кг для соли, которая образована слабым основанием и сильной кислотой, рассчитывается по формуле:
Тогда:
3. Концентрация ионов водорода равна:
4. Рассчитываем рН раствора соли: pH = – lg 7,5 • 10-6 = 3,84 Пример № 5. Условие задания: Написать уравнение гидролиза солиCH3COONH4. Вычислить константу гидролиза Кг, концентрацию ионов водорода [H+] и рН раствора соли CH3COONH4, если известно, что константа диссоциации гидроксида аммония Кд(NH4OH) = 1,79 • 10-5, а константа диссоциации уксусной кислоты Кд (СH3COOH) = 1,86 • 10–5 (табл. 2.2). Решение 1.Уравнение реакции гидролиза соли CH3COONH4, которая образована слабым основанием NH4OH и слабой кислотой СH3COOH, имеет вид: CH3COONH4 + НОН ⇄ CH3COOН + NH4ОН CH3COO- + NH4 + + НОН ⇄ CH3COOН + NH4ОН
2. Константа гидролиза Кг для соли, которая образована слабым основанием и слабой кислотой, рассчитывается по формуле:
Тогда:
3. Концентрация ионов водорода равна:
4. Рассчитываем рН раствора соли: pH = – lg 1,02 • 10-7 = 6,99 3.3. Индивидуальные задания Условия заданий (табл. 3.5): Задание № 1. Написать уравнение ступенчатого гидролиза соли с указанием реакции среды. Привести константу равновесия для каждой стадии (см. примеры № 1,2); Задание № 2. Написать уравнение гидролиза соли. Вычислить константу гидролиза Кг, концентрацию ионов водорода [H+] и рН раствора соли (см. примеры № 3,4,5). Таблица 3.5
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 498; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.202.168 (0.008 с.) |


 = 10-7 моль/дм3. Концентрация ионов водорода указывает ([H+]) на активную реакцию среды. Для удобства оценки кислотности и щелочности среды пользуются не концентрацией водородных ионов, а величиной водородного показателя рН.
= 10-7 моль/дм3. Концентрация ионов водорода указывает ([H+]) на активную реакцию среды. Для удобства оценки кислотности и щелочности среды пользуются не концентрацией водородных ионов, а величиной водородного показателя рН.

 моль/дм3
моль/дм3 моль/дм3
моль/дм3



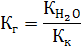

 г-ион/дм3
г-ион/дм3

 г – ион/дм3
г – ион/дм3

 г – ион/дм3
г – ион/дм3


