Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет содержания карбонатных ионов в водеСодержание книги Поиск на нашем сайте
Теоретическая часть Диоксид углерода (СО2) находится в воде как в растворенном виде, так и в форме угольной кислоты. Содержание диоксида углерода зависит от солесодержания, рН, температуры, концентрации ионов Са2+ и характеризуется карбонатным равновесием. Суммарное содержание СО2 + Н2СО3, которое определяют при химическом анализе воды, объединяется понятием свободная угольная кислота. Различают углекислоту: 1) общую; 2) гидрокарбонатную (НСО3-); 3) карбонатную (СО3 2-); 4) свободную (СО2); 5) равновесную; 6) агрессивную. Определить формы углекислоты, содержащиеся в воде, можно по константам диссоциации кислоты и рН среды. Углекислота в водном растворе диссоциирует на ионы ступенчато: H2CO3 ↔ Н+ + НСО3-
НСО3- ↔ Н+ + СО32- В природных водах устанавливается динамическое равновесие между СО2, НСО3–, СО32–: CO2 + Н2O ↔ Н2СO3 ↔ Н + + НСО3- ↔ 2Н + + СО32- Соотношение форм углекислоты зависит от рН воды (рис. 4). При рН < 4 вся углекислота находится в виде углекислого газа СО2; при рН = 8,4 в воде содержатся преимущественно ионы НСО3–; при рН > 10,5 преобладают карбонатные ионы СО32–.
Рис. 4. Влияние рН на соотношение различных форм СО2, НСО3-, СО32-
Пример решения индивидуального задания Пример. Условие задания: Определить концентрацию карбонатного иона СО32- в исследуемой воде, если рН = 7,1 и [НСО3-] = 6,8 мг-экв/дм3 (415мг/дм3). Решение 1). Концентрацию ионов водорода воды при рН =7,1 рассчитывают по формуле: [Н+] = 10-рН = lg10-7,1=7,94 •10-8 моль/дм3 2). Угольная кислота диссоциирует на ионы ступенчато: H2CO3 ↔ Н+ + НСО3-
НСО3- ↔ Н+ + СО32- Карбонатный ион(СО32-) входит в уравнение второй константы диссоциации угольной кислоты, поэтому для решения используем выражение для К2:
9.3. Индивидуальные задания Условие задания (табл. 7.12): Определить концентрацию карбонатного иона СО32- в исследуемой воде, если известны значения рН и концентрация НСО3- (см. табл. 7.12). Расчетно – графическое определение параметров Стабилизационной обработки воды Теоретическая часть Содержащиеся в воде ионы НСО3-, СО32- и СО2, связаны между собой углекислотным равновесием: СО32- + СО2 + Н2О = 2 НСО3- Вода, в которой соблюдается основное карбонатное равновесие, называется стабильной. Она не изменяют своего состава при контакте с карбонатами, бетоном, карбонатными защитными пленками. Как следует из константы углекислотного равновесия гидрокарбонат - ионы существуют в растворе только при наличии свободной углекислоты:
Часть свободной углекислоты, находящейся в равновесии с гидрокарбо-натными ионами, называется равновесной - [СО2]равн. Она как бы связана с гидрокарбонатами и поэтому не вступает в химические реакции. Избыточная свободная углекислота, в отличие от равновесной, активна и носит название агрессивной. Однако не вся она агрессивна: одна часть избыточной свободной углекислоты, действуя на углекислый кальций, превращает его в гидрокарбонат, а другая часть идет на увеличение количества равновесной углекислоты для удержания в растворе вновь образовавшихся количеств гидрокарбоната. В водах открытых водоемов из-за низкого содержания углекислоты в воздухе присутствие агрессивной углекислоты маловероятно. В подземных водах содержание агрессивной углекислоты иногда бывает весьма значительным. Под стабильностью воды понимают ее свойство не растворять карбонат кальция и не выделять его из воды. Нарушение стабильности воды может быть вызвано наличием избытка растворенной углекислоты или кислорода, низким рН, пересыщенностью ее карбонатом кальция или гидроокисью магния, повышенной концентрацией сульфатов либо хлоридов. Нестабильными бывают как природные воды, так и вода после ее обработки на очистных сооружениях. Возможны два варианта нестабильности воды: - Воды, содержащие избыток свободной угольной кислоты над равновесной, называются агрессивными. При контакте с бетоном или карбонатными пленками такие воды вызывают растворение карбонатных составляющих цемента и бетона: CaCO3+CO2+H2O↔Ca(HCO3)2 Ca(OH)2+2 CO2↔Ca(HCO3)2 - Воды, содержащие меньше свободной угольной кислоты, чем равновесное количество, характеризуются как склонные к карбонатным отложениям. Стабильность воды определяется двумя методами: 1) по методу карбонатных испытаний (экспериментальный метод). Сопоставляют щелочность и рН исследуемой воды до и после контакта с СаСО3 в течение 1 часа. Стабильность воды оценивают по показателю стабильности (С) ивспомогательному показателю стабильности (Свсп.) в соответствии с табл. 10.15:
2) метод вычисления индекса насыщения карбонатом кальция или индекса Ланжелье (J) по данным анализа воды (рН, температура, концентрация ионов кальция, общая щелочность, солесодержание): J = рНисх. – рНs где: рНисх. – рН воды в естественном состоянии; рНs –рН воды в условиях насыщения карбонатом кальция. Стабильность воды оценивают по индексу стабильности (Ланжелье J) в соответствии с табл. 10.15. После оценки стабильности воды (табл. 10.15) для нестабильной воды с целью защиты металлических труб, бетонных сооружений от коррозии и от образования бугристых коррозионных отложений выполняют стабилизационную обработку воды. Таблица 10.15 Оценка стабильности воды
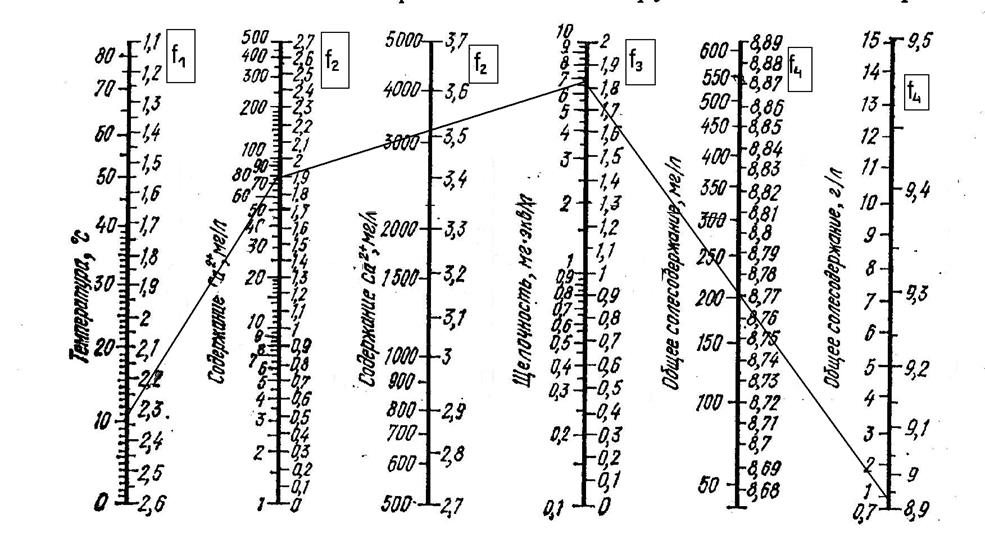
10.3. Пример решения индивидуального задания Пример. Условия заданий: 1). Рассчитать индекс насыщения воды следующего состава: температура воды – 10оС, рН = 7,1, концентрация иона кальция – 80 мг/дм3, общая щелочность – 6,8 мг-экв/ дм3, общее солесодержание – 0,8 г/ дм3; 2). Оценить стабильность исследуемой воды; 3). Рекомендовать метод стабилизационной обработки. Решение При отсутствии данных технологических анализов стабильность воды допускается определять по индексу насыщения карбонатом кальция (индекс Ланжелье J)по формуле: J = pHисх. - рНs где: J - индекс Ланжелье; pHисх. — опытное значение рН исходной воды; pHs — значение рН в условиях насыщения воды карбонатом кальция, рассчитывают на основании данных анализа воды по формуле: pHs = f1(tо) - f2(Ca2+) - f3(Щ) + f4(Р) где: f1, f2, f3, f4 — значения функций: f1 – температура воды; f2 - содержание Са2+; f3 – показатель щелочности (Щ); f4 - общее солесодержание (Р) в воде. Значения функций определяют по номограмме (рис. 5). На четырех шкалах номограммы слева отложены температура воды (t,оС), щелочность (Щ, мг-экв/дм3), концентрация кальция (Са2+, мг/дм3), общее солесодержание (Р, г/дм3); справа функции этих величин. 1). Определяем значение f1. По номограмме (рис. 5) на шкале температуры напротив точки - 10оС определяем соответствующее значение коэффициента f1 = 2,35. 2). Определяем значение f2. По номограмме (рис. 5) на шкале «содержание Са2+, мг/дм3» отмечаем точку - 80 мг/дм3 и определяем соответствующее значение коэффициента f2 = 1,9. 3). Определяем значение f3. По номограмме (рис. 5) на шкале «общая щелочность, мг - экв/дм3» отмечаем точку – 6,8 мг - экв/дм3 и определяем соответствующее значение коэффициента f3 = 1,84. 4). Определяем значение f4. По номограмме (рис. 5) на шкале «общее солесодержание, мг/дм3» отмечаем точку – 0,80 г/дм3 и определяем соответствующее значение коэффициента f4 = 8,94. 5). Рассчитываем значение pHs: pHs = f1(tо) + f2(Ca2+) - f3(Щ) + f4(Р) = 2,35 – 1,9 – 1,84 + 8,94 = 7,55 6). Индекс стабильности вычисляем по формуле: J = pHисх. - pHs = 7,1 – 7,55 = - 0,45 < 0 где: рНисх..— значение рН исходной воды; pHs — рассчитанный по номограмме (рис. 5) водородный показатель в условиях насыщения воды карбонатом кальция. 7). Заключение о стабильности исследуемой воды выполняем в соответствии с табл. 10.15. Заключение: J < 0, вода агрессивна по отношению к цементу и бетону. Содержание свободной углекислоты превышает равновесную концентрацию. Требуется проводить стабилизационную обработку исследуемой воды щелочными реагентами: - известью: Са(ОН)2 + 2 СО2 = Са(НСО3)2 - гидроксидом натрия: NаОН + СО2 = NаНСО3 - карбонатом натрия: Nа2СО3+СО2 + Н2О= 2 NаНСО3
|
| № задания | рНисх | Температура, оС | Содержание Ca2+, мг/дм3 | Щелочность HCO3-, мг-экв/дм3 | Солесодер- жание, мг/дм3 |
| 6,05 | 2,23 | ||||
| 8,5 | 1,97 | ||||
| 5,5 | 2,46 | ||||
| 7,7 | 2,25 | ||||
| 6,3 | 4,92 | ||||
| 6,5 | 2,05 | ||||
| 8,9 | 3,85 | ||||
| 8,5 | 2,07 | ||||
| 6,5 | 2,02 | ||||
| 6,1 | 1,90 | ||||
| 6,5 | 3,05 | ||||
| 6,9 | 5,49 | ||||
| 8,8 | 3,52 | ||||
| 6,9 | 2,54 | ||||
| 7,3 | 1,10 | ||||
| 6,3 | 1,31 | ||||
| 7,4 | 1,03 | ||||
| 6,7 | 0,49 | ||||
| 8,2 | 5,33 | ||||
| 8,3 | 0,80 | ||||
| 6,1 | 1,97 | ||||
| 6,9 | 2,13 | ||||
| 8,2 | 4,28 | ||||
| 8,6 | 1,97 | ||||
| 8,5 | 3,28 | ||||
| 8,2 | 2,95 | ||||
| 8,0 | 2,66 | ||||
| 7,9 | 2,30 | ||||
| 7,9 | 2,16 | ||||
| 8,1 | 2,62 |
Продолжение табл. 10.16
| 6,1 | 1,84 | ||||
| 6,5 | 2,56 | ||||
| 6,9 | 3,85 | ||||
| 8,8 | 1,89 | ||||
| 6,9 | 2,05 | ||||
| 7,3 | 1,67 | ||||
| 6,3 | 2,95 | ||||
| 7,4 | 2,67 | ||||
| 6,7 | 1,97 | ||||
| 8,2 | 5,16 | ||||
| 8,3 | 1,79 | ||||
| 6,1 | 1,49 | ||||
| 6,9 | 2,38 | ||||
| 8,2 | 4,11 | ||||
| 8,6 | 1,97 | ||||
| 8,5 | 3,43 | ||||
| 8,2 | 3,07 | ||||
| 8,0 | 2,82 | ||||
| 7,9 | 2,38 | ||||
| 7,9 | 2,16 |
|
| Поделиться: |
Последнее изменение этой страницы: 2016-04-26; просмотров: 2808; Нарушение авторского права страницы; Мы поможем в написании вашей работы!
infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.170 (0.011 с.)

 ; К1 = 4,5 •10 -7
; К1 = 4,5 •10 -7 ; К2 = 5,6 •10 -11
; К2 = 5,6 •10 -11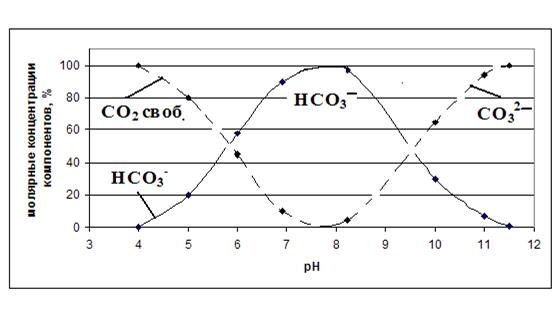
 = 5,6 •10 -11
= 5,6 •10 -11
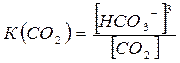

 ; Свсп. =
; Свсп. =