
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Состав солей исследуемой водыСодержание книги Поиск на нашем сайте
Продолжение табл. 3.5
Расчет показателей жесткости воды Теоретическая часть Жесткость воды обусловлена присутствием в ней растворенных солей кальция и магния. Различают общую, карбонатную и некарбонатную жесткость. Общей жесткостью (Жо) называется суммарная концентрация ионов Ca2+ и Mg2+ в воде, выраженная в моль/м3 или ммоль/дм3.Общая жесткость воды (ЖО) равна сумме карбонатной и некарбонатной жесткости. ЖО = [Са2+] + [Mg2+] = ЖК + ЖНК; (ммоль/дм3) Количественно жесткость воды определяется суммой молярных концентраций эквивалентов ионов кальция и магния, содержащихся в 1 дм3 воды (ммоль/дм3, мг - экв/дм3). Карбонатная (временная) жесткость (ЖК) обусловлена содержанием в воде преимущественно гидрокарбонатов (и карбонатов при рН > 8,3) солей кальция имагния: Ca(НСО 3 ) 2, Мg(НСО 3 ) 2, (МgСО 3). Некарбонатная жесткость воды (ЖНК) обусловлена присутствием в воде сульфатов ихлоридов солей кальция и магния: СаSO4, MgSO4, СаС12, MgС12. Некарбонатная жесткость – часть общей жесткости, равная разности между общей и карбонатной жесткостью: Жнк = Жо – Жк По величине жесткости природную воду делят на: очень мягкую — до 1,5 ммоль/дм3; мягкую — от 1,5 до 4 ммоль/дм3; средней жесткости — от 4 до 8 ммоль/дм3; жесткую — от 8 до 12 ммоль/дм3; очень жесткую — свыше 12 ммоль/дм3. В зависимости от конкретных требований производства допускаемая жесткость воды может быть различной. Жесткость воды хозяйственно-питьевых водопроводов не должна превышать 7 ммоль/дм3 (мг-экв/дм3).
4.2. Пример решения индивидуального задания Пример. Условие задания: Рассчитать карбонатную, некарбонатную и общую жесткость воды, если в 1м3 исследуемой воды содержится 80 г Ca2+; 55 г Mg2+; 415 г HCO3-. Дано: m (Са2+) = 80 г = 80 000 мг m (Mg2+) = 55 г = 55 000 мг m (HCO3-) = 415 г = 415 000 мг V(Н2О) = 1 м3 = 1000 дм3 Жо -? Жк -? Жнк -? Решение 1). Жесткость общую рассчитывают по формуле: Жо =[Са2+] + [Mg2+] = где: [Са2+], [Mg2+] – концентрация ионов в мг-экв/дм3; m (Са2+), m (Mg2+) – содержание ионов Са2+ и Mg2+ в мг; V(Н2О) – объем воды, дм3; Э (Са2+), Э (Mg2+) – эквивалентная масса ионов Са2+ и Mg2+, которая равна: Э (Са2+) = Э(Mg2+) = Тогда: Жо = [Са2+] + [Mg2+] = 2). Рассчитываем жесткость карбонатную (Жк) по формуле: Жк = [НСО3-] = где: [НСО3-] - концентрация в мг-экв/дм3;m (НСО3-) – содержание иона НСО3- в мг; V(Н2О) – объем воды, дм3; Э (НСО3-) – эквивалентная масса иона НСО3-, которая равна: Э (НСО3-) = Тогда: Жк = [НСО3-] = 3). Рассчитываем жесткость некарбонатную (Жнк), как разность между жесткостью общей и карбонатной: Жнк = Жо – Жк = 8,5 – 6,8 = 1,7 мг-экв/дм3 4). Результаты расчетов приведены в табл. 4.6. Таблица 4.6 Показатели жесткости исследуемой воды
4.3 Индивидуальные задания Условие задания (табл. 4.7): Рассчитать карбонатную, некарбонатную и общую жесткость воды. Таблица 4.7 Состав исследуемой воды
Продолжение табл. 4.7
Расчет дозы реагентов для умягчения исследуемой воды Теоретическая часть Использование жестких вод для хозяйственно-бытовых и промышленных нужд приводит к весьма нежелательным последствиям: - усиление коррозии паровых котлов и теплообменников вследствие гидролиза магниевых солей и повышения концентрации водородных ионов в растворе; - отложение накипи на поверхности теплообменных аппаратов (котлов, холодильников) снижает экономичность работы этих установок. Это приводит к образованию вздутий и трещин в трубах паровых котлов; - в жесткой воде плохо развариваются продукты, понижается их питательная ценность. Белки переходят в нерастворимое состояние, плохо усваиваются организмом; - преждевременный износ тканей при стирке в жесткой воде и перерасход моющего средства. Волокна тканей сорбируют кальциевые и магниевые мыла, а это делает их хрупкими и ломкими. Для умягчения воды в промышленности и в быту используют термический, реагентный и ионообменный методы. Термический метод применяют для устранения карбонатной (временной) жесткости воды. При кипячении гидрокарбонаты металлов разрушаются, образуя труднорастворимые вещества: to Са(НСО3)2 → СаСО3↓ + СО2↑+ Н2О Общая жесткость воды уменьшается на величину карбонатной жесткости. Ионообменный метод широко применяется в промышленности. Жесткость воды устраняют с помощью ионитов (ионообменных смол). Воду фильтруют через ионообменные смолы (катиониты), при этом ионы кальция и магния замещаются на катионы Н+, Nа+, образуя растворимые соединения, не обусловливающие жесткость воды. Процесс ионного обмена можно представить схемой: 2 NaR + Са2+ = СаR2 + 2 Na+ 2 НR + Са2+ = СаR2 + 2 Н+ где: NаR, НR – условное обозначение катионита в Nа+– и Н+ – форме. После замещения всех ионов Н+, Nа+ в катионите ионами кальция или магния его регенерируют (восстанавливают), пропуская через смолу концентрированный раствор хлорида натрия или кислоты: СаR2 + 2 Na+ = 2 NaR + Са2+ СаR2 + 2 Н+ = 2 НR + Са2+ Реагентный метод заключается в обработке воды различными химическими вещества (реагентами), которые осаждают ионы кальция и магния и умягчают воду. Фосфатный метод основан на использовании гексаметафосфата натрия, что обеспечивает глубокое умягчение воды независимо от вида жесткости: 2 СаС12 + Na6Р6O18 = Na2Са2P6О18 + 4 NaCl Известково-содовый метод умягчения воды является одним из самых распространенных, рекомендованных СНиП 2.04.02-84. Известь устраняет карбонатную жесткость воды, а сода – некарбонатную. При использовании этого метода можно достичь величины остаточной жесткости 0,5 - 1,0 мг-экв/дм3 и карбонатной жесткости 0,8 - 1,2 мг-экв/дм3. Нижние пределы жесткости могут быть получены при нагреве воды до 35-40ºС. Карбонатную жесткость устраняют добавлением к воде щелочи (гидроксида кальция - гашеной извести): Са(НСО3)2 + Са(ОН)2 = 2 СаСО3 ↓+ 2 Н2О Дозу извести в мг/дм3 рассчитывают по формуле:
где: Дuзвести – доза извести для 1дм3 умягчаемой воды в расчете на CaO, мг/дм3; CO2 – содержание свободной углекислоты, мг/дм3; [ Mg2+] – содержание Mg2+, мг/дм3; Жк – жесткость карбонатная, мг-экв/дм3; Дк – доза коагулянта, мг/дм3; Эк –эквивалент коагулянта, мг/экв – мг; 0,5 – избыток извести для ускорения процесса, мг-экв/дм3; 28 – эквивалент CaO. Некарбонатную жесткость воды устраняют добавлением к воде соды: СаС12 + Na2CO3 = СаСО3↓ + 2 NaCl 2 MgSO4 + 2 Na2CO3 + Н2О = (МgOH)2СО3↓+ СО2↑+ 2 Na2SO4 Дозу соды в мг/дм3 рассчитывают по формуле:
где: Дcоды – доза соды для 1дм3 умягчаемой воды, мг/дм3; Жнк – жесткость некарбонатная, мг-экв/дм3; Дк, Эк – см. выше; 1 – избыток соды для ускорения процесса; 53 – эквивалент соды. Примечание: При условии 5.2. Пример решения индивидуального задания Пример. Условие задания: Рассчитать дозу извести и соды для умягчения исследуемой воды, если известно, что:
Решение 1). РассчитатьЖнк для исходной воды по формуле: Жнк = Жобщ – Жк = 8,5 – 6,8 = 1,7 мг-экв/дм3 По формуле СНиПа рассчитать дозу соды в мг/дм3:
Поскольку для умягчения используют 10 %-ый раствор соды Na2CO3 (ρ = 1,05 г/см3), вычисляем объем этого раствора: 10 г Na2CO3 содержится в 100 г раствора 0,143 г Na2CO3 ----------- в х г раствора
Объем 10%-ого раствора соды для умягчения воды:
2) По формуле СНиПа рассчитать дозу извести (СаО) в мг/дм3:
СаО реагирует с водой с образованием Са(ОН)2 по уравнению: CaO + H2O = Ca(OH)2 Поэтому следует пересчитать дозу СаО в Са(ОН)2: М(CaO) = 56 г/моль; М(Ca(OH)2) = 74 г/моль Тогда: 74 мг Ca(OH)2 содержат 56 мг CaO х мг Ca(OH)2 ------------ 484 мг CaO
Поскольку для умягчения используют 0,5 %-ый раствор извести Ca(OH)2 (ρ = 1,03 г/см3), вычисляем объем этого раствора: 0,5 г Ca(OH)2 содержится в 100 г раствора 0,64 г Ca(OH)2 ------------- в х г раствора
Объем 0,5%-ого раствора извести для умягчения воды:
5.3. Индивидуальные задания
Условия заданий (табл. 4.6 и табл. 4.7): Задание № 1. Написать уравнения реакций известково-содового умягчения; Задание № 2. Рассчитать дозу извести и соды для известково – содового умягчения воды. Использовать результаты расчетов показателей жесткости воды и магния (в мг/дм3) из табл.4.6; а также данные по содержанию углекислого газа из табл. 4.7. 6. Обработка результатов определения содержания взвешенных веществ
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 570; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.130.228 (0.007 с.) |

 +
+  ; мг – экв/дм3
; мг – экв/дм3

 = 3,99 + 4,52 = 8,5 мг-экв/дм3
= 3,99 + 4,52 = 8,5 мг-экв/дм3
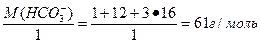

 мг/дм3
мг/дм3 , мг/дм3
, мг/дм3 > Жк, содержании [Mg2+] ≤ 15 мг/дм3 и перманганатной окисляемости ≤ 10 мг 02/дм3 в производственных условиях можно использовать не осветлители с взвешенным осадком, а вихревые реакторы, что позволяет не применять коагулянты и из приведенных формул определения Дuзвести и Дcоды исключить член
> Жк, содержании [Mg2+] ≤ 15 мг/дм3 и перманганатной окисляемости ≤ 10 мг 02/дм3 в производственных условиях можно использовать не осветлители с взвешенным осадком, а вихревые реакторы, что позволяет не применять коагулянты и из приведенных формул определения Дuзвести и Дcоды исключить член  .
.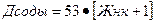
 мг/дм3 = 0,143 г
мг/дм3 = 0,143 г 10% раствора Na2CO3
10% раствора Na2CO3
 =
=  484 мг/дм3
484 мг/дм3 640 мг = 0,64 г Са(ОН)2
640 мг = 0,64 г Са(ОН)2 128 г 0,5% раствора Са(ОН)2
128 г 0,5% раствора Са(ОН)2 124 см3
124 см3


