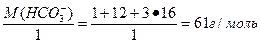Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химического состава природной воды»Содержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ
ОДЕССКАЯ ГОСУДАРСТВЕННАЯ АКАДЕМИЯ СТРОИТЕЛЬСТВА И АРХИТЕКТУРЫ
Кафедра химии и экологии
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
по дисциплине «ХИМИЯ ВОДЫ И МИКРОБИОЛОГИЯ» для выполнения расчетно-графической работы на тему: «Определение качественного и количественного Химического состава природной воды»
для студентов направлений: 6.060103 «Гидротехника (Водные ресурсы)» специальный вид деятельности: «Рациональное использование природных ресурсов» 6.060101 «Строительство» специальный вид деятельности «Водоснабжение и водоотведение»
форма обучения: дневная, заочная
Одесса 2014
«УТВЕРЖДЕНО» Ученым Советом строительно-технологического института протокол № 8 от 23.04.2014г.
Составители: к.т.н., доцент Олейник Т.П. асс. Маковецкая Е.А.
Рецензенты: к.б.н. Николенко С.И., ст.н. сотр. ГУ «УкрНИИ МР и К МЗ Украины» к.т.н., доц. Семенова С.В., доц. каф. химии и экологии ОГАСА
Ответственный за выпуск:
профессор, д.х.н. Довгань И.В., зав. каф. химии и экологии ОГАСА
СОДЕРЖАНИЕ
ВВЕДЕНИЕ Методические указания предназначены для выполнения расчетно - графической работы по дисциплине «Химия воды и микробиология» для направлений «Строительство», «Гидротехника (Водные ресурсы)» для специального вида деятельности: «Рациональное использование и охрана водных ресурсов», «Водоснабжение и водоотведение». Цель выполнения расчетно–графической работы - получение знаний о химических, физико-химических, микробиологических и санитарно-гигиенических параметрах качества природных вод, о методах ее кондиционирования. Работа заключается в оценке качества конкретной природной воды как возможного источника централизованного водоснабжения. В методических указаниях приведены методики расчетов для определения основных показателей качества исследуемой воды. Указано значение каждого показателя, предложены задания по расчету технологических процессов очистки природной воды. Студенты при выполнении расчетно – графической работы должны освоить теоретический материал курса, используя рекомендуемую учебную литературу, и решить расчетно - графические задания. Правила оформления работы: 1. Работа выполняется на стандартных листах формата А - 4. 2. Работа должна быть аккуратно оформлена, написана четко и ясно, иметь поля для замечаний рецензента. Поля: левое –2 см, верхнее и нижнее –2 см, правое – 1 см. Страницы нумеруются в нижнем правом углу или по центру. Работа должна быть переплетена (скреплена). 3. Решение заданий должны быть коротко, но четко обоснованы. Необходимо приводить весь ход решения задания и математические преобразования. 4. Титульный лист включает: наименование работы, сведения о студенте, номер зачетной книжки, номер варианта, номер группы, подпись преподавателя. Вторая страница работы – содержание. 5. Вариант индивидуального задания выбирают: - для студентов очной формы обучения вариант индивидуального задания выбирают по указанию преподавателя; - для студентов заочной формы обучения вариант индивидуального задания определяют по последним двум цифрам номера зачетной книжки в соответствии с таблицей вариантов (см. далее). Если расчетно – графическая работа по дисциплине «Химия воды и микробиология» не зачтена, ее следует выполнить повторно в соответствии с указаниями рецензента и представить вместе с незачтенной работой. Исправления следует выполнять в конце работы. Работа, выполненная не по своему варианту, преподавателем не рецензируется и не засчитывается. ВАРИАНТЫ КОНТРОЛЬНЫХ ЗАДАНИЙ Для расчетно-графической работы Вариант индивидуального задания выбирают по двум последним цифрам зачетной книжки. Например, если номер зачетной книжки 02123, номер варианта – «23».
План выполнения расчетно – графической работы Расчетно – графическую работу следует выполнять по предлагаемому плану. Содержание работы состоит из следующих пунктов: Введение 1.Характеристика объекта исследования. 2. Расчет водородного показателя воды. 3. Гидролиз солей. 4. Расчет показателей жесткости воды. 5. Расчет дозы реагентов для умягчения воды. 6. Обработка результатов определения содержания взвешенных веществ в воде математическим методом. 7. Расчетное задание по оценке качества питьевой воды. 8. Графическое выражение результатов анализа воды. 9. Расчет содержания карбонатных ионов в воде. 10. Расчетно–графическое определение параметров стабилизационной обработки воды. 11. Расчетно - графическое определение величины хлорпоглощаемости воды. Литература ПРИМЕР ВЫПОЛНЕНИЯ ИНДИВИДУАЛЬНОГО ЗАДАНИЯ
Характеристика объекта исследования.
Объект исследования – природная вода, отобранная из подземного источника. Дата отбора пробы: май 2014 года.
Расчет водородного показателя воды Теоретическая часть Чистая вода – слабый электролит, частично диссоциирует на ионы: Н2О ⇄ Н+ + ОН-
Кдисс• [Н2О] = [Н+] • [ОН-] При определенной температуре Кдис. и [Н2О] – величины постоянные, следовательно: KH2O = [Н+] • [ОН-] = 10-14 – ионное произведение воды В чистой воде [H+] = [OH-] = рН - это отрицательный десятичный логарифм концентрации водородных ионов: рН = – lg[H+] Следовательно,
Из логарифмической формы ионного произведения воды следует: рН + рОН = 14 рОН = 14 – рН рОН = – lg[ОН-] Чтобы найти концентрацию ионов водорода по величине рН необходимо: [Н+] = 10-рН Чтобы найти концентрацию гидроксильных ионов по величине рOН необходимо: [OН-] = 10-рOН Таблица 2.1 Сильные электролиты
Слабым электролитом принято считать химические соединения, молекулы которых даже в сильно разбавленных растворах не полностью диссоциируют на ионы. Степень диссоциации слабых электролитов для децимолярных растворов (0,1М) меньше 3%. Примеры слабых электролитов: все органические кислоты, некоторые неорганические кислоты (например, H2S, HCN), большинство гидроксидов (например, Zn(OH)2, Cu(OH)2). Для растворов слабых кислот концентрация ионов водорода [H+] в растворе рассчитывается по формуле:
где: Кк – константа диссоциации слабой кислоты; Ск – концентрация кислоты, моль/дм3. Для растворов слабых оснований концентрация гидроксильных ионов рассчитывается по формуле:
где: Ко – константа диссоциации слабого основания; Сосн. – концентрация основания, моль/дм3. Таблица 2.2 Константы диссоциации слабых кислот и оснований при 25 оС
2.2. Примеры решения индивидуального задания Пример №1. Условие задания: Определить концентрацию водородных и гидроксильных ионов в растворе, если рН =5,5. Решение Концентрация ионов водорода рассчитывается по формуле: [Н+] = 10-рН [Н+] = 10-5,5 = 3,16 •10-6 моль/дм3 Концентрация гидроксильных ионов рассчитывается по формуле: [OН-] = 10-рOН рОН = 14 – рН = 14 – 5,5 = 8,5 [OН-] = 10 -8,5 = 3 • 10-9 моль/дм3 Пример № 2. Условие задания: Вычислить рН 0,001 М раствора HС1. Решение Кислота HС1 является сильным электролитом (табл.2.1) и в разбавленных растворах практически полностью диссоциирует на ионы: HС1⇄ Н+ + С1- Поэтому концентрация ионов [Н+] равна общей концентрации кислоты: [Н+] = См = 0,001 М. [Н+] = 0,001= 1·10-3 моль/дм3 Тогда: рН = – lg[H+] = – lg 1 • 10-3 = 3 Пример № 3. Условие задания: Вычислить рН 0,002 М раствора NaOH. Решение Основание NaOH является сильным электролитом (табл.2.1) и в разбавленных растворах практически полностью диссоциирует на ионы: NaOH ⇄Na++OH- Поэтому концентрация гидроксильных ионов равна общей концентрации основания: [ОH-]= См = 0,002 М. Тогда: рОН = – lg[ОН-] = – lgСм = – lg 2 •10-3 = 2,7 Исходя из формулы: рН + рОН = 14, находим рН раствора: рН = 14 – 2,7 = 11,3 Пример №4. Условие задания: Вычислить рН 0,04 М раствора NH4OH, если константа диссоциации Кд(NH4OH) = 1,79·10-5 (табл.2.2). Решение Основание NH4OH является слабым электролитом и в разбавленных растворах очень незначительно диссоциирует на ионы. Концентрация гидроксильных ионов [ОH-] в растворе слабого основания рассчитывается по формуле:
рОН = – lg[ОH-] = – lg 8,5·10-2 = 1,1 Исходя из формулы: рН + рОН = 14, находим рН раствора: рН = 14 – рOН = 14 – 1,1 = 12,9 Пример №5. Условие задания: Вычислить рН 0,17 М растворауксусной кислоты (CH3COOH), если константа диссоциации Кд(CH3COOH) = 1,86 • 10-5 (табл.2.2). Решение Кислота CH3COOH является слабым электролитом и в разбавленных растворах очень незначительно диссоциирует на ионы. Концентрация ионов водорода [H+] в растворе слабой кислоты рассчитывается по формуле:
Тогда:
Вычисляем pH раствора по формуле: рН = – lg [H+] pH = – lg 1,78 • 10-3 = 2,75 2.3. Индивидуальные задания Условия заданий (табл. 2.3): Задание № 1. Вычислить концентрацию водородных и гидроксильных ионов в растворе при определенном значении рН (см. пример № 1); Задание № 2. Вычислить рН раствора сильного электролита (кислоты, основания) при заданной концентрации (см. пример № 2, 3); Задание № 3. Вычислить рН раствора слабого электролита (кислоты, основания) при заданной концентрации (см. пример № 4, 5). Таблица 2.3 Состав исследуемой воды
Продолжение табл. 2.3
Гидролиз солей Теоретическая часть Гидролиз солей – взаимодействие ионов соли с водой, приводящее к образованию слабого электролита. В результате гидролиза происходит смещение равновесия диссоциации воды вследствие образования малодиссоцирующих соединений, малорастворимьх и летучих веществ. Поэтому гидролизуютcя только катионы слабых оснований и анионы слабых кислот, то есть три типа солей: 1) соли, образованные слабыми основаниями и сильными кислотами (гидролиз по катиону), например, NН4CI, Mg(NO3)2, FeС13; 2) соли, образованные сильными основаниями и слабыми кислотами (гидролиз по аниону), например, СН3СООNa, Na2CO3, Na2SO3; 3) соли, образованные слабыми основаниями и слабыми кислотами (гидролиз по катиону и аниону), например, CH3COONН4, Аl2S3, (NH4)2S. Формулы сильных и слабых кислот и оснований приведены в табл. 2.1 и 2.2. 3.2. Примеры решения индивидуального задания Пример №1. Условие задания: Написать уравнение ступенчатого гидролиза соли Na2CO3. Указать реакцию среды и константу равновесия для каждой стадии. Решение Гидролиз соли Na2CO3, образованной сильным основанием NaОН и слабой двухосновной кислотой H2CO3, протекает ступенчато в 2 стадии: I ступень: Na2CO3 + HOH ⇄ NaHCO3 + NaOH Na + + СО32- + HOH ⇄ Na + + HCO3– + Na + + OH– СО32- + HOH ⇄ HCO3– + OH– (среда щелочная, рН > 7) Константа равновесия I ступени:
II ступень: NaНCO3 + HOH ⇄ H2CO3 + NaOH Na + + НCO3– + HOH ⇄ Н2CO3 + Na + + OH- НCO3– + HOH ⇄ Н2CO3 + OH- (среда щелочная, рН > 7) Константа равновесия II ступени:
Пример № 2. Условие задания: Написать уравнение ступенчатого гидролиза соли FeCl2. Указать реакцию среды и константу равновесия для каждой стадии. Решение Гидролиз соли FeCl2, образованной слабым многокислотным основанием Fe(OH)2 и сильной кислотой HCl, протекает ступенчато в 2 стадии: I ступень: FeCl2 + HOH ⇄ Fe(OH)Cl + HCl Fe2+ + 2 Cl- + HOH ⇄ FeOH+ + Cl- + H+ + Cl- Fe2+ + HOH ⇄ FeOH+ + H+ (среда кислая, рН < 7) Константа равновесия I ступени:
II ступень: Fe(OH)Cl + HOH ⇄ Fe(OH)2+ HCl FeOH+ + Cl- + HOH ⇄ Fe(OH)2 + H+ + Cl- FeOH+ + HOH ⇄ Fe(OH)2 + H+ (среда кислая, рН < 7)
Константа равновесия II ступени:
Пример № 3. Условие задания: Написать уравнение гидролиза солиKCN. Вычислить константу гидролиза Кг, концентрацию ионов водорода [H+] и рН раствора соли, если известно, что концентрация соли 0,1М, а константа диссоциации синильной кислоты Кд(HCN) = 7,2 • 10-10 (табл.2.2). Решение 1. Уравнение реакции гидролиза соли KCN, которая образована сильным основанием KOH и слабой кислотой HCN имеет вид: KCN + НОН ⇄ КОН + НCN K+ + CN- + НОН ⇄ К+ + ОН- + НCN CN- + НОН ⇄ ОН- + НCN
2. Константа гидролиза Кг для соли, которая образована сильным основанием и слабой кислотой, рассчитывается по формуле:
Тогда:
3. Концентрация ионов водорода равна:
4. Рассчитываем рН раствора соли: pH = – lg 8,5 • 10-13 = 12,07 Пример № 4. Условие задания: Написать уравнение гидролиза солиNH4Cl. Вычислить константу гидролиза Кг, концентрацию ионов водорода [H+] и рН раствора соли, если известно, что концентрация соли 0,1М, а константа диссоциации гидроксида аммония Кд(NH4OH) = 1,79 •10-5 (табл. 2.2).
Решение 1.Уравнение реакции гидролиза соли NH4Cl, которая образована слабым основаниемNH4OH и сильной кислотой HCl, имеет вид: NH4Cl + НОН ⇄ NH4ОН + HCl NH4+ + Cl- + НОН ⇄ NH4ОН + H+ + Cl- NH4+ + НОН ⇄ NH4ОН +H+
2. Константа гидролиза Кг для соли, которая образована слабым основанием и сильной кислотой, рассчитывается по формуле:
Тогда:
3. Концентрация ионов водорода равна:
4. Рассчитываем рН раствора соли: pH = – lg 7,5 • 10-6 = 3,84 Пример № 5. Условие задания: Написать уравнение гидролиза солиCH3COONH4. Вычислить константу гидролиза Кг, концентрацию ионов водорода [H+] и рН раствора соли CH3COONH4, если известно, что константа диссоциации гидроксида аммония Кд(NH4OH) = 1,79 • 10-5, а константа диссоциации уксусной кислоты Кд (СH3COOH) = 1,86 • 10–5 (табл. 2.2). Решение 1.Уравнение реакции гидролиза соли CH3COONH4, которая образована слабым основанием NH4OH и слабой кислотой СH3COOH, имеет вид: CH3COONH4 + НОН ⇄ CH3COOН + NH4ОН CH3COO- + NH4 + + НОН ⇄ CH3COOН + NH4ОН
2. Константа гидролиза Кг для соли, которая образована слабым основанием и слабой кислотой, рассчитывается по формуле:
Тогда:
3. Концентрация ионов водорода равна:
4. Рассчитываем рН раствора соли: pH = – lg 1,02 • 10-7 = 6,99 3.3. Индивидуальные задания Условия заданий (табл. 3.5): Задание № 1. Написать уравнение ступенчатого гидролиза соли с указанием реакции среды. Привести константу равновесия для каждой стадии (см. примеры № 1,2); Задание № 2. Написать уравнение гидролиза соли. Вычислить константу гидролиза Кг, концентрацию ионов водорода [H+] и рН раствора соли (см. примеры № 3,4,5). Таблица 3.5 Теоретическая часть Жесткость воды обусловлена присутствием в ней растворенных солей кальция и магния. Различают общую, карбонатную и некарбонатную жесткость. Общей жесткостью (Жо) называется суммарная концентрация ионов Ca2+ и Mg2+ в воде, выраженная в моль/м3 или ммоль/дм3.Общая жесткость воды (ЖО) равна сумме карбонатной и некарбонатной жесткости. ЖО = [Са2+] + [Mg2+] = ЖК + ЖНК; (ммоль/дм3) Количественно жесткость воды определяется суммой молярных концентраций эквивалентов ионов кальция и магния, содержащихся в 1 дм3 воды (ммоль/дм3, мг - экв/дм3). Карбонатная (временная) жесткость (ЖК) обусловлена содержанием в воде преимущественно гидрокарбонатов (и карбонатов при рН > 8,3) солей кальция имагния: Ca(НСО 3 ) 2, Мg(НСО 3 ) 2, (МgСО 3). Некарбонатная жесткость воды (ЖНК) обусловлена присутствием в воде сульфатов ихлоридов солей кальция и магния: СаSO4, MgSO4, СаС12, MgС12. Некарбонатная жесткость – часть общей жесткости, равная разности между общей и карбонатной жесткостью: Жнк = Жо – Жк По величине жесткости природную воду делят на: очень мягкую — до 1,5 ммоль/дм3; мягкую — от 1,5 до 4 ммоль/дм3; средней жесткости — от 4 до 8 ммоль/дм3; жесткую — от 8 до 12 ммоль/дм3; очень жесткую — свыше 12 ммоль/дм3. В зависимости от конкретных требований производства допускаемая жесткость воды может быть различной. Жесткость воды хозяйственно-питьевых водопроводов не должна превышать 7 ммоль/дм3 (мг-экв/дм3).
4.2. Пример решения индивидуального задания Пример. Условие задания: Рассчитать карбонатную, некарбонатную и общую жесткость воды, если в 1м3 исследуемой воды содержится 80 г Ca2+; 55 г Mg2+; 415 г HCO3-. Дано: m (Са2+) = 80 г = 80 000 мг m (Mg2+) = 55 г = 55 000 мг m (HCO3-) = 415 г = 415 000 мг V(Н2О) = 1 м3 = 1000 дм3 Жо -? Жк -? Жнк -? Решение 1). Жесткость общую рассчитывают по формуле: Жо =[Са2+] + [Mg2+] = где: [Са2+], [Mg2+] – концентрация ионов в мг-экв/дм3; m (Са2+), m (Mg2+) – содержание ионов Са2+ и Mg2+ в мг; V(Н2О) – объем воды, дм3; Э (Са2+), Э (Mg2+) – эквивалентная масса ионов Са2+ и Mg2+, которая равна: Э (Са2+) = Э(Mg2+) = Тогда: Жо = [Са2+] + [Mg2+] = 2). Рассчитываем жесткость карбонатную (Жк) по формуле: Жк = [НСО3-] = где: [НСО3-] - концентрация в мг-экв/дм3;m (НСО3-) – содержание иона НСО3- в мг; V(Н2О) – объем воды, дм3; Э (НСО3-) – эквивалентная масса иона НСО3-, которая равна: Э (НСО3-) = Тогда: Жк = [НСО3-] = 3). Рассчитываем жесткость некарбонатную (Жнк), как разность между жесткостью общей и карбонатной: Жнк = Жо – Жк = 8,5 – 6,8 = 1,7 мг-экв/дм3 4). Результаты расчетов приведены в табл. 4.6. Таблица 4.6 Таблица 4.7 Состав исследуемой воды
Продолжение табл. 4.7
Теоретическая часть Использование жестких вод для хозяйственно-бытовых и промышленных нужд приводит к весьма нежелательным последствиям: - усиление коррозии паровых котлов и теплообменников вследствие гидролиза магниевых солей и повышения концентрации водородных ионов в растворе; - отложение накипи на поверхности теплообменных аппаратов (котлов, холодильников) снижает экономичность работы этих установок. Это приводит к образованию вздутий и трещин в трубах паровых котлов; - в жесткой воде плохо развариваются продукты, понижается их питательная ценность. Белки переходят в нерастворимое состояние, плохо усваиваются организмом; - преждевременный износ тканей при стирке в жесткой воде и перерасход моющего средства. Волокна тканей сорбируют кальциевые и магниевые мыла, а это делает их хрупкими и ломкими. Для умягчения воды в промышленности и в быту используют термический, реагентный и ионообменный методы. Термический метод применяют для устранения карбонатной (временной) жесткости воды. При кипячении гидрокарбонаты металлов разрушаются, образуя труднорастворимые вещества: to Са(НСО3)2 → СаСО3↓ + СО2↑+ Н2О Общая жесткость воды уменьшается на величину карбонатной жесткости. Ионообменный метод широко применяется в промышленности. Жесткость воды устраняют с помощью ионитов (ионообменных смол). Воду фильтруют через ионообменные смолы (катиониты), при этом ионы кальция и магния замещаются на катионы Н+, Nа+, образуя растворимые соединения, не обусловливающие жесткость воды. Процесс ионного обмена можно представить схемой: 2 NaR + Са2+ = СаR2 + 2 Na+ 2 НR + Са2+ = СаR2 + 2 Н+ где: NаR, НR – условное обозначение катионита в Nа+– и Н+ – форме. После замещения всех ионов Н+, Nа+ в катионите ионами кальция или магния его регенерируют (восстанавливают), пропуская через смолу концентрированный раствор хлорида натрия или кислоты: СаR2 + 2 Na+ = 2 NaR + Са2+ СаR2 + 2 Н+ = 2 НR + Са2+ Реагентный метод заключается в обработке воды различными химическими вещества (реагентами), которые осаждают ионы кальция и магния и умягчают воду. Фосфатный метод основан на использовании гексаметафосфата натрия, что обеспечивает глубокое умягчение воды независимо от вида жесткости: 2 СаС12 + Na6Р6O18 = Na2Са2P6О18 + 4 NaCl Известково-содовый метод умягчения воды является одним из самых распространенных, рекомендованных СНиП 2.04.02-84. Известь устраняет карбонатную жесткость воды, а сода – некарбонатную. При использовании этого метода можно достичь величины остаточной жесткости 0,5 - 1,0 мг-экв/дм3 и карбонатной жесткости 0,8 - 1,2 мг-экв/дм3. Нижние пределы жесткости могут быть получены при нагреве воды до 35-40ºС. Карбонатную жесткость устраняют добавлением к воде щелочи (гидроксида кальция - гашеной извести): | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| Поделиться: |


 = 10-7 моль/дм3. Концентрация ионов водорода указывает ([H+]) на активную реакцию среды. Для удобства оценки кислотности и щелочности среды пользуются не концентрацией водородных ионов, а величиной водородного показателя рН.
= 10-7 моль/дм3. Концентрация ионов водорода указывает ([H+]) на активную реакцию среды. Для удобства оценки кислотности и щелочности среды пользуются не концентрацией водородных ионов, а величиной водородного показателя рН.

 моль/дм3
моль/дм3 моль/дм3
моль/дм3



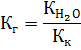

 г-ион/дм3
г-ион/дм3

 г – ион/дм3
г – ион/дм3

 г – ион/дм3
г – ион/дм3 +
+  ; мг – экв/дм3
; мг – экв/дм3

 = 3,99 + 4,52 = 8,5 мг-экв/дм3
= 3,99 + 4,52 = 8,5 мг-экв/дм3