
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физико – химические свойства растворовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Цель деятельности студентов на занятии.
Студент должен знать: а) Характеристику растворов, их компонентов. б) Способы выражения концентрации растворов, растворимость веществ. в) Определение закона Рауля через молярную долю растворителя и растворенного вещества г) Следствия из закона Рауля д) Определение осмоса; экзосмоса; эндосмоса
Студент должен уметь: а) Формировать и применять для расчета свойств растворов законы осмоса и законы Рауля б) Расчеты различных концентраций растворов в) Определять молярную массу вещества эбуллиоскопическим и криоскопическим методом
Для изучения биологических и медицинских дисциплин большой интерес представляет учение о растворах.
Раствором называют находящуюся в состоянии равновесия гомогенную систему переменного состава из двух или более веществ. Вещества, составляющие раствор, называют компонентами раствора.
Растворы могут существовать в трех агрегатных состояниях – твердом, жидком и газообразном (парообразном). Примерами твердых растворов могут служить некоторые сплавы металлов, например сплав золота и меди, а газообразных – воздух. Для медиков наибольший интерес представляют жидкие растворы, к которым относятся плазма крови, моча, лимфа и другие биологические жидкости, представляющие собой очень сложные смеси белков, липидов, углеводов, солей, растворенных в воде. Многие химические процессы протекают лишь при условии, что участвующие в них вещества находятся в растворенном состоянии. Усвоение пищи связано с переходом питательных веществ в растворенное состояние. Биохимические реакции в живых организмах протекают в растворах. Биожидкости участвуют в транспорте питательных веществ (жиров, аминокислот, кислорода), лекарственных препаратов к органам и тканям, а также в выведении из организма метаболитов (мочевины, билирубина, углекислого газа и т.д.). В жидких средах организма поддерживается постоянство кислотности, концентрации солей и органических веществ – концентрационный гомеостаз. Изучение свойств растворов показывает, что их поведение подчиняется ряду законов, которые необходимо учитывать в медицинской практике.
Концентрация является важнейшей характеристикой раствора.
Концентрацией вещества – компонента раствора – называют величину, измеряемую количеством растворенного вещества, содержащегося в определенной массе или объеме раствора или растворителя.
В химии применяются разнообразные способы выражения концентрации растворов.
Массовая доля вещества в процентах показывает число граммов (единиц массы) вещества, содержащееся в 100 г (единиц массы) раствора
где m (X) – масса данного компонента Х (растворенного вещества), кг (г); Молярная концентрация показывает число молей растворенного вещества, содержащихся в 1 л раствора
где n (X) – количество растворенного вещества, моль; М (Х) – молярная масса растворенного вещества, кг/моль (г/моль); Vр-ра – объем раствора, л. Моляльная концентрация показывает число молей растворенного вещества, содержащихся в 1000 г растворителя
где mр-ля – масса растворителя. Нормальность или молярная концентрация эквивалента показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора
где nЭ – количество вещества эквивалента. Эквивалент элемента называют реальную или условную частицу вещества Х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции – одному электрону.
Закон эквивалентов: вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам.
Эквивалент кислот определяется количеством ионов водорода Н+, которые принимают участие в данной реакции
Эквивалент оснований будет определяться числом ОН–-ионов, которые прореагируют с ионами Н+
При вычислении эквивалентов солей учитывают число ионов металла и степень его окисления
Эквивалент не постоянное число, зависит от реакции, в которой участвует вещество. Титром раствора называется масса вещества, содержащегося в одном кубическом сантиметре (или в одном миллилитре) раствора. Единица измерения титра г/см3 (или г/мл)
Диффузия
Диффузия – это самопроизвольный процесс выравнивания концентрации растворенного вещества в растворе.
Диффузия обусловлена тепловым движением частиц растворенного вещества и растворителя. Хотя движение каждой частицы хаотично, в целом смещение частиц направленное – частицы растворенного вещества постепенно проникают все дальше в растворитель. Диффузия наблюдается и при соприкосновении растворов разных концентраций. При этом количество частиц растворенного вещества, проходящее в единицу времени в сторону менее концентрированного раствора, будет больше, чем в обратном направлении.
(знак «–» потому, что С1 > С2) Закон Фика: Скорость диффузии вещества пропорциональна площади поверхности, через которую переносится вещество, и градиенту концентрации этого вещества.
где А. Эйнштейн и независимо от него М. Смолуховский вывели следующее уравнение для коэффициента диффузии:
где R – универсальная газовая постоянная, равная 8,31 Дж/(моль·К); Т – абсолютная температура, К; NA – постоянная Авогадро, равная 6,02·1023 1/моль; r – радиус диффундирующих частиц, м; D – коэффициент диффузии, м2/с; η – вязкость среды, Н·с/м2. Из уравнений следует, что скорость диффузии возрастает при повышении температуры и градиента концентрации и уменьшается при увеличении вязкости растворителя и размера диффундирующих частиц. С увеличением молекулярной массы, а, следовательно, и размеров молекул, уменьшается коэффициент диффузии и, следовательно, ее скорость.
Явление диффузии играет очень важную роль в процессах перемещения различных питательных веществ и продуктов обмена в тканевых жидкостях. В живых организмах диффузия тесно связана со многими биологическими явлениями. Скорость многих физико-химических процессов в организме зависит прежде всего от скорости диффузии реагирующих веществ. Общая кинетика биологических явлений определяется наиболее медленным их этапом – диффузией реагентов, а не биохимическими реакциями, протекающими при участии ферментов с очень большой скоростью. Каждая клетка организма представляет сложнейшую систему различных веществ (систему фаз), существенно влияющую на направление и скорость диффузии различных веществ. Изменение функционального состояния клетки, тесно связанное с общими регуляторными механизмами живых организмов, сопровождается изменением состояния фаз, их объемов, величины поверхности раздела между ними. Все это приводит к определенным изменениям в диффузии различных веществ. Интенсивность обменных реакций также оказывает регулирующее влияние на диффузию. Повышение обменных процессов усиливает использование диффундирующих реагентов и ведет к накоплению продуктов реакций, что в свою очередь повышает градиенты их концентраций и увеличивает диффузию. Понижение интенсивности обменных процессов действует в обратном направлении.
|
||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 1539; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.008 с.) |

 ,
,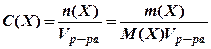 ; моль/л (моль/м3),
; моль/л (моль/м3), , моль/кг,
, моль/кг, , моль/л (моль/м3)
, моль/л (моль/м3) ;
;  ; 1 г-экв = 49 г.
; 1 г-экв = 49 г. ;
;  .
. ;
;  .
. .
. Диффузия может быть выражена количественно. Предположим, что на некотором расстоянии x1 от дна от дна сосуда концентрация раствора равна С1, а на расстоянии x 2 концентрация С2, причем С1 > С2. Следовательно, изменение концентрации, приходящееся на единицу расстояния между С1 и С2 (градиент концентрации), равно
Диффузия может быть выражена количественно. Предположим, что на некотором расстоянии x1 от дна от дна сосуда концентрация раствора равна С1, а на расстоянии x 2 концентрация С2, причем С1 > С2. Следовательно, изменение концентрации, приходящееся на единицу расстояния между С1 и С2 (градиент концентрации), равно
 ,
, – скорость диффузии, моль/с; S – площадь поверхности, м2;
– скорость диффузии, моль/с; S – площадь поверхности, м2; 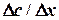 – градиент концентрации, моль/м2; D – коэффициент пропорциональности, м2/с, называемый коэффициентом диффузии вещества.
– градиент концентрации, моль/м2; D – коэффициент пропорциональности, м2/с, называемый коэффициентом диффузии вещества. ,
,


