
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Авторы: калагова Р. В. , кибизова А. Ю. , плиева А. Г. , плиева Л. Х.Содержание книги
Поиск на нашем сайте
УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ «ХИМИЯ» ДЛЯ СТУДЕНТОВ ЛЕЧЕБНОГО И ПЕДИАТРИЧЕСКОГО ФАКУЛЬТЕТОВ Авторы: Калагова Р.В., Кибизова А.Ю., Плиева А.Г., Плиева Л.Х. Занятие №1 ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Цель деятельности студентов на занятии. Студент должен знать: а) Понятия электролитов, неэлектролитов б) Положения теории электролитической диссоциации. в) Константы ионизации слабого электролита. Закон разведения Оствальда. г) Общие положения теории Дебая-Хюккеля. Ионная сила раствора. Активность, коэффициент активности ионов.
Студент должен уметь: а) Писать уравнения диссоциации электролитов и выражения для константы диссоциации слабых электролитов. б) Объяснить смещение ионного равновесия при добавлении одноименных ионов в) Писать уравнения реакций амфотерных электролитов с кислотами и щелочами.
Теоретическая часть
Учение о растворах представляет для медиков особый интерес потому, что важнейшие биологические жидкости – кровь, лимфа, моча, слюна, пот – являются растворами солей, белков, углеводов, липидов в воде. Биологические жидкости и ткани содержат много различных электролитов: NaCl, KCl, HCl, CaCl2, NaH2PO4, NaHCO3 и др. Концентрация ионов регулирует распределение воды между внеклеточным пространством и клетками тканей, а также между внеклеточным пространством и мочой. Кислотно-щелочное равновесие в крови и биожидкостях определяется содержанием слабых и сильных электролитов: Na2HPO4, NaH2PO4, H2CO3, NaHCO3 и др. Ионы играют определенную роль в создании осмотического давления различных биологических жидкостей.
Электролитами называются соединения, которые существуют в растворе в виде ионов независимо от прохождения или непрохождения через раствор электрического тока. В конце XIX века швед С. Аррениус создал теорию электролитической диссоциации, с некоторыми поправками сохранившую значение и до настоящего времени. До Аррениуса полагали, что электролиты проводят ток в результате диссоциации молекул на ионы под действием электрического поля. Но позже Аррениус пришел к выводу, что диссоциация молекул электролитов на ионы происходит уже в процессе растворения.
Распад молекул на ионы в растворителях называется электролитической диссоциацией (ионизацией).
Причиной, вызывающей распад растворенного вещества на ионы, является интенсивное взаимодействие ионов с молекулами растворителя, т.е. сольватация ионов. Частный случай сольватации ионов есть гидратация, т.е. взаимодействие их с водой. Впервые представление о гидратации ионов было введено Д.И. Менделеевым в его химической теории растворов. Дальнейшие исследования И.А. Каблукова и В.А. Кистяковского, а также теория электролитической диссоциации С. Аррениуса оказались плодотворными для объяснения свойств растворов электролитов. Процесс диссоциации – обратим (справедливо для слабых электролитов). Наряду с распадом электролитов на ионы идет обратный процесс – рекомбинация – образование из ионов молекул. Чем полярнее растворитель, тем сильнее диссоциация. Первой стадией диссоциации является гидратация (сольватация). При растворении электролитов в воде диполи воды (полярного растворителя) за счет ориентационного диполь-дипольного или ион-дипольного взаимодействия притягиваются к полярным молекулам или ионам растворяемого вещества. Вторую стадию диссоциации называют поляризацией молекулы растворяемого вещества. В веществах с полярными молекулами, например в НСl, под действием молекул растворителя происходит сильное смещение связывающих электронов и связь Н-Cl становится ионной. Третьей стадией является собственно диссоциация, т.е. разрушение поляризованной «молекулы» и образование гидратированных ионов.
По способности образовывать ионы в растворе электролиты делят на две группы: слабые и сильные. К сильным электролитам относятся все соли, образованные сильным основанием или сильной кислотой, и большая часть солей, образованных слабым основанием и слабой кислотой. Из наиболее важных кислот и оснований к сильным электролитам принадлежат H2SO4, HCl, HBr, HI, HNO3, NaOH, KOH, Ba(OH)2. Многие сильные электролиты кристаллизуются в кристаллах с ионной решеткой. К слабым электролитам относятся ковалентные соединения, подвергающиеся в воде частичной диссоциации. Это, прежде всего, слабые кислоты (H2S, HCN, H2CO3, H2SO3, HClO, H3BO3) и слабые основания, а также некоторые соли. К слабым электролитам принадлежит большинство органических кислот, фенолы, амины.
Лабораторная работа
Опыт 1
Ионные равновесия в растворах слабых кислот на примере уксусной кислоты. Налейте в две пробирки по 5 мл раствора уксусной кислоты и прибавьте в каждую по 2-3 капли раствора метилового оранжевого. Обратите внимание на окраску обоих растворов. Затем в одну из пробирок добавьте сухой соли CH3COONa, перемешайте до полного растворения и наблюдайте изменение окраски. Объясните, что при этом происходит. Напишите соответствующие ионные уравнения реакций.
Опыт 2
Амфотерные электролиты Налейте в пробирку 1-2 мл раствора алюминия сульфата. По каплям приливайте к нему раствор натрия гидроксида до образования осадка Al(OH)3. Раствор с осадком разлейте в две пробирки: в одну из них прибавьте избыток раствора щелочи, в другую – кислоты. Что наблюдается? Составьте уравнения протекающих в пробирках реакций. Объясните растворение амфотерных гидроксидов в щелочах и кислотах.
Вопросы:
1. Что понимается под электролитической диссоциацией веществ в растворах? 2. Какие вещества относятся к электролитам и неэлектролитам? 3. Изложите основные положения теории электролитической диссоциации. 4. Объясните процесс электролитической диссоциации в воде веществ с ионным типом связи. 5. Как происходит электролитическая диссоциация в воде веществ с ковалентным типом связи? 6. Что называется степенью диссоциации? Какие факторы влияют на степень диссоциации? 7. Что называется константой диссоциации? Какие электролиты подвергаются в растворах ступенчатой диссоциации? Напишите выражения констант диссоциации H2S и Н2СО3 по первой и второй ступеням. От каких факторов зависит константа диссоциации? 8. Какая взаимосвязь существует между степенью и константой диссоциации слабых электролитов? Сформулируйте закон разведения Оствальда. 9. Приведите примеры сильных электролитов. Почему для сильных электролитов применяют понятие «кажущаяся степень диссоциации»? 10. Что понимается под коэффициентом активности? 11. Что понимается под активностью электролита? 12. Что называют ионной силой раствора? Закон Дебая-Хюккеля. Формула Дебая-Хюккеля. Вычислите ионную силу 0,01 молярного раствора соли Na3PO4. 13. Роль электролитов в процессах жизнедеятельности. Литература
1. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др. Под ред. Ю.А. Ершова. – М.: Высш. шк., 2007. 2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: учеб. Пособие для студентов мед. спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; под ред. Ю.А. Ершова, В.А. Попкова. – М.: Высш. шк., 2007 Занятие № 2 ГИДРОЛИЗ СОЛЕЙ. МЕДИКО-БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ГИДРОЛИЗА
Цель деятельности студентов на занятии.
Студент должен знать:
а) Определение гидролиза. Типы гидролиза в зависимости от природы соли. б) Гидролиз АТФ.
Студент должен уметь:
а) Писать уравнения гидролиза различных типов солей. б) Рассчитывать значения константы гидролиза и значения рН для различных типов солей. в) Экспериментально определять по значению рН тип соли, степень ее гидролиза. г) Объяснять образование кислых, основных солей, доказать их значения рН. б) Объяснять, почему не подвергаются гидролизу соли сильного основания и сильной кислоты.
Содержание обучения.
Под гидролизом понимают реакции разложения вещества водой. Гидролиз – частный случай сольволиза – взаимодействие растворенного вещества и растворителя. Гидролизу могут подвергаться: белки, жиры, углеводы, эфиры, соли и т.д. Гидролизом соли называют взаимодействие соли с молекулами воды, приводящее к образованию малодиссоциированных соединений. В зависимости от природы соли вода выступает либо как кислота, либо как основание, а соль является соответственно сопряженным основанием или сопряженной кислотой. Возможны четыре варианта гидролиза в зависимости от типа соли: 1. Соли сильной кислоты и слабого основания:
2. Соль слабой кислоты и слабого основания:
3. Соль сильного основания и слабой кислоты:
Гидролиз характеризуется степенью гидролиза α и константой гидролиза K.
Типовые обучающие задачи 1. Написать гидролиз солей: Na2CO3, AlCl3, Al2S3. 2. Написать константу равновесия для слабой кислоты, используя закон действующих масс. 3. Написать константу гидролиза, учитывая, что концентрация недиссоциированных молекул воды в разбавленных растворах постоянна при T = const. 4. Вывести закономерности для гидролиза: А) при повышении температуры; Б) при подкислении раствора; В) возможность необратимости гидролиза; Г) гидролиз органических соединений; Д) роль гидролиза в процессах жизнедеятельности.
Опыт 1
Опыт 4 Гидролитическое разложение соли Налейте в пробирку 1-2 мл раствора алюминия сульфата и прибавляйте по каплям раствор натрия карбоната до выпадения осадка. Наблюдайте выделение газа при смешении этих растворов. Какой газ выделяется? Каков состав образовавшегося осадка? Как это можно доказать? Объясните полученные результаты и напишите соответствующие ионные уравнения.
Опыт 5 Влияние температуры на смещение равновесия гидролиза В пробирку с раствором натрия ацетата прилейте 1-2 капли фенолфталеина. Заметьте интенсивность окраски. Нагрейте пробирку с раствором, поместив ее в стакан с кипящей водой. Как меняется интенсивность окраски? Объясните полученный результат. Дайте немного остыть пробирке и охладите ее в холодной воде. Что происходит? Напишите ионное уравнение реакции и объясните наблюдаемое явление. Экзо- или эндотермической является реакция гидролиза ацетат-иона?
Материальное оснащение занятия: а) приборы: колбы, бюретки, химические стаканы, спиртовки, индикаторы б) соли: Na2SO3, Al2(SO4)3, NH4CH3COO, NaCl, Na2CO3, NaHCO3 и NaHSO3
Контрольные вопросы: 1. Роль Н2О и растворов в жизнедеятельности. Физико-химические свойства воды, обуславливающие ее уникальную роль как единственного биорастворителя. 2. Что называется ионным произведением воды? Как оно определяется? 3. Объясните, как зависит величина ионного произведения воды от температуры? 4. Что называют водородным показателем рН среды? 5. Дайте определение гидролизу. Гидролиз с точки зрения протолитической теории. 6. Какие типы солей подвергаются гидролизу? Типы гидролиза. 7. Какова реакция среды водных растворов следующих солей: NH4Cl, CH3COOH, NH4CN. 8. Напишите по стадиям уравнения реакций гидролиза следующих солей: FeCl3, CuSO4, Na2SO3, CH3COONH4. 9. Как выражается константа гидролиза для различных случаев гидролиза? 10. Роль гидролиза биоорганических соединений в процессах жизнедеятельности? Напишите уравнение гидролиза АТФ. Какова роль этого процесса в организме человека?
Хронометраж 3-х часового занятия: 1. Организационный момент – 2 мин; 2. Пояснения к выполнению работы – 20 мин; 3. Опрос – 40 мин; 4. Выполнение и оформление работы – 50 мин; 5. Проверка работ и задание на дом –23 мин.
Литература: 1. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др. Под ред. Ю.А. Ершова. – М.: Высш. шк., 1993. 2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: учеб. Пособие для студентов мед. спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; под ред. Ю.А. Ершова, В.А. Попкова. – М.: Высш. шк., 1993.
Занятие № 3 Диффузия
Диффузия – это самопроизвольный процесс выравнивания концентрации растворенного вещества в растворе.
Диффузия обусловлена тепловым движением частиц растворенного вещества и растворителя. Хотя движение каждой частицы хаотично, в целом смещение частиц направленное – частицы растворенного вещества постепенно проникают все дальше в растворитель. Диффузия наблюдается и при соприкосновении растворов разных концентраций. При этом количество частиц растворенного вещества, проходящее в единицу времени в сторону менее концентрированного раствора, будет больше, чем в обратном направлении.
(знак «–» потому, что С1 > С2) Закон Фика: Скорость диффузии вещества пропорциональна площади поверхности, через которую переносится вещество, и градиенту концентрации этого вещества.
где А. Эйнштейн и независимо от него М. Смолуховский вывели следующее уравнение для коэффициента диффузии:
где R – универсальная газовая постоянная, равная 8,31 Дж/(моль·К); Т – абсолютная температура, К; NA – постоянная Авогадро, равная 6,02·1023 1/моль; r – радиус диффундирующих частиц, м; D – коэффициент диффузии, м2/с; η – вязкость среды, Н·с/м2. Из уравнений следует, что скорость диффузии возрастает при повышении температуры и градиента концентрации и уменьшается при увеличении вязкости растворителя и размера диффундирующих частиц. С увеличением молекулярной массы, а, следовательно, и размеров молекул, уменьшается коэффициент диффузии и, следовательно, ее скорость.
Явление диффузии играет очень важную роль в процессах перемещения различных питательных веществ и продуктов обмена в тканевых жидкостях. В живых организмах диффузия тесно связана со многими биологическими явлениями. Скорость многих физико-химических процессов в организме зависит прежде всего от скорости диффузии реагирующих веществ. Общая кинетика биологических явлений определяется наиболее медленным их этапом – диффузией реагентов, а не биохимическими реакциями, протекающими при участии ферментов с очень большой скоростью. Каждая клетка организма представляет сложнейшую систему различных веществ (систему фаз), существенно влияющую на направление и скорость диффузии различных веществ. Изменение функционального состояния клетки, тесно связанное с общими регуляторными механизмами живых организмов, сопровождается изменением состояния фаз, их объемов, величины поверхности раздела между ними. Все это приводит к определенным изменениям в диффузии различных веществ. Интенсивность обменных реакций также оказывает регулирующее влияние на диффузию. Повышение обменных процессов усиливает использование диффундирующих реагентов и ведет к накоплению продуктов реакций, что в свою очередь повышает градиенты их концентраций и увеличивает диффузию. Понижение интенсивности обменных процессов действует в обратном направлении.
Осмос Весьма важным в биологическом отношении свойством растворов является осмос. В природе часто растворы отделяются от растворителя мембранами, проницаемыми лишь для частиц растворителя. В этом случае растворенное вещество диффундировать в растворитель не может, и будет наблюдаться только переход растворителя в раствор, т.е. растворитель будет перемещаться в обоих направлениях, но все же в раствор будет переходить его больше, чем в обратном направлении.
Осмосом называют преимущественно одностороннее проникновение молекул растворителя (диффузию) через полупроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией.
Для возникновения осмоса необходимо растворы разных концентраций привести в соприкосновение через полупроницаемую мембрану (проницаемую только для растворителя).
В результате осмоса увеличивается объем раствора, и его концентрация постепенно снижается; проникающий через мембрану в раствор растворитель увеличивает столб жидкости h и, следовательно, повышает гидростатическое давление. Одновременно будет возрастать число молекул растворителя, перемещающихся через мембрану в обратном направлении, т.е. из раствора в растворитель. Постепенно гидростатическое давление и разбавление раствора достигнут величин, при которых количество молекул растворителя, перемещающихся в обоих направлениях, уравняется и наступит осмотическое равновесие. Развившееся в результате осмоса избыточное гидростатическое давление, измеряемое столбом раствора высотой h, при котором устанавливается осмотическое равновесие, называют осмотическим давлением. Осмотическим давлением называют величину, измеряемую минимальным гидравлическим давлением, которое нужно приложить к раствору, чтобы осмос прекратился.
Законы осмотического давления. Изучение законов осмотического давления выявило их полную аналогию с газовыми законами. 1) При постоянной температуре осмотическое давление прямо пропорционально молярной концентрации растворенного вещества (аналогия с законом Бойля-Мариотта):
2) При постоянной молярной концентрации осмотическое давление прямо пропорционально абсолютной температуре (аналогия с законом Гей-Люссака):
3) Вант-Гоффом был предложен объединенный закон для осмотического давления в растворах (аналогично объединенному закону Менделеева-Клайперона): Осмотическое давление разбавленных растворов неэлектролитов прямо пропорционально молярной концентрации, коэффициенту пропорциональности и абсолютной температуре:
где π – осмотическое давление, кПа; С (X) – молярная концентрация, моль/л,
Осмос имеет большое значение для растительных и животных организмов, способствуя достаточному оводнению клеток и межклеточных структур. Возникающее при этом осмотическое давление обуславливает тургор клеток, т.е. их своеобразную упругость, способствуя тем самым поддержанию эластичности тканей, сохранению определенной формы организма и т.п. Каждая живая клетка имеет оболочку или поверхностный слой протоплазмы, обладающие свойством полупроницаемости. Так, оболочка эритроцитов непроницаема для ряда катионов (например, для К+ и Na+), хотя она свободно пропускает анионы и воду. Помещая животные или растительные клетки в дистиллированную воду, можно наблюдать перемещение воды внутрь клеток, что ведет к их набуханию, а затем к разрыву оболочек и вытеканию клеточного содержимого. Если в таком опыте использовать эритроциты, то вода окрасится в гемоглобином в красный цвет. Подобное разрушение клеток путем разрыва их оболочек (или поверхностных слоек протоплазмы) называют лизисом, а в случае эритроцитов – гемолизом. В крепких растворах солей отмечается, наоборот, сморщивание клеток (плазмолиз), обусловленное потерей воды, перемещающейся из них в более концентрированный внешний раствор. Растворы солей с осмотическим давлением, равным осмотическому давлению раствора, взятого за стандарт, называются изотоническими (изос – по-гречески равный). Растворы с осмотическим давлением более высоким, чем в стандарте, называются гипертоническими, с меньшим давлением – гипотоническими.
Изучение разбавленных растворов неэлектролитов показало, что коллигативные свойства – понижение давления пара Δ p, изменение температур замерзания Δ Тз и кипения Δ Тк, осмотическое давление π – изменяются пропорционально количеству растворенного неэлектролита (объединенный закон Рауля – Вант-Гоффа). Изменение коллигативных свойств растворов электролитов превышает значения, рассчитываемые по закону Рауля для растворов неэлектролитов той же концентрации. Чтобы согласовать количественное описание коллигативных свойств электролитови законы идеальных растворов, Вант-Гофф ввел поправочный коэффициент i, называемый изотоническим коэффициентом Вант-Гоффа
Итак, для растворов электролитов формулы принимают следующий вид:
Вопросы:
1.Что называют растворами? 2.Значение растворов в жизнедеятельности организмов? 1. Вода как растворитель. 2. Классификация растворов: растворы электролитов, неэлектролитов, растворы амфолитов, растворы полиэлектролитов. 3. Концентрация растворов и способы ее выражения. 4. Диффузия в растворах. Закон Фика. Уравнение Эйнштейна-Смолуховского. Факторы, влияющие на скорость диффузии. Роль диффузии в процессах переноса веществ в биологических системам. 5. Коллигативные свойства разбавленных растворов электролитов. Закон Рауля и следствия из него: понижение температуры замерзания растворителя, повышение температуры кипения, осмос. 6. Осмос. Осмотическое давление. Закон Вант-Гоффа. 7. Гипо-, гипер- и изотонические растворы. Изотонический коэффициент. 8. Роль осмоса в биологических системах. Плазмолиз и лизис. Литература 3. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др. Под ред. Ю.А. Ершова. – М.: Высш. шк., 1993. 4. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: учеб. Пособие для студентов мед. спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; под ред. Ю.А. Ершова, В.А. Попкова. – М.: Высш. шк., 1993. Лабораторная работа
Выполнение эксперимента В 3 пробирки вносят пипеткой по 3 мл трех растворов хлорида натрия различной концентрации. В каждую пробирку добавляют микропипеткой по 0,5 мл крови. Перемешивают стеклянной палочкой. По одной капле каждой смеси наносят палочкой на предметные стекла, закрывают покровными стеклами и изучают препараты под микроскопом. Зарисовывают форму эритроцитов в каждом случае. Рассчитывают осмотическое давление примененных в работе растворов хлорида натрия при температуре опыта, и объясняют на основании полученных результатов наблюдаемые явления гемолиза и плазмолиза эритроцитов. Опыт 2. Древовидные образования. Ряд пробирок наполняют разбавленным в 8 раз жидким стеклом Na2SiO3 или силикатным клеем и опускают в пробирки кристаллики соли. Лучше всего для этой цели подходят хлориды, бромиды или нитраты железа, меди, марганца, никеля, кобальта и т.д. Через некоторое время из кристаллов вырастают древовидные образования. Объясните наблюдаемое явление, сделайте выводы.
Вопросы к опытам:
1. В каком растворе наблюдалось осмотическое равновесие между эритроцитами и средой? 2. Зависит ли осмотическое давление от природы растворенного вещества? 3. Можно ли оценить осмотическое давление раствора по температуре его замерзания (кипения)? 4. Почему в 4 % - м растворе хлорида натрия эритроциты не наблюдались?
Занятие № 4 СВОЙСТВА БУФЕРНЫХ РАСТВОРОВ
Цель: Приобрести навыки в приготовлении буферных смесей с определенным значением рН; изучить некоторые свойства буферных растворов.
Научно-методическое обоснование темы:
Студент должен знать: а) Определение и классификацию буферных систем б).Основные буферные системы живых организмов в) Определение буферной емкости
Студент должен уметь: а) Объяснять механизм действия буферных смесей б) Уметь выводить уравнение Гендерсона-Гассельбаха для буферных смесей I и II типа в) Готовить буферные системы с заданным значением рН г) Практически определять буферную емкость смеси Теоретическая часть:
Значительную роль в поддержании постоянства рН биологических жидкостей, тканей и органов (кислотно-основного гомеостаза биосистем) и лабораторной диагностике играют буферные растворы.
Буферные растворы – это растворы, рН которых меняется незначительно при разбавлении или при добавлении небольших количеств кислоты или щелочи.
В водных буферных растворах основными компонентами являются донор и акцептор протонов, представляющие собой сопряженную кислотно-основную пару.
Сопряженные кислотно-основные пары В/ВН+ и А–/НА называют буферными системами.
Буферные системы по составу бывают двух основных типов: 1. Слабая кислота (донор протонов) и ее соль (акцептор протонов, сопряженное основание), образованная сильным основанием. Например, ацетатный буфер СН3СООН + СН3СООNa. 2. Слабое основание (акцептор протонов) е его соль (донор протонов), образованная сильной кислотой. Например, аммиачный буфер NH4OH + NH4Cl.
Расчет рН буферных систем
Каждая из буферных смесей характеризуется определенной концентрацией водородных ионов, которую буферная система и стремиться сохранять при добавлении кислот или щелочей. Рассмотрим на примере ацетатной буферной смеси, что же определяет ее рН.
Из приведенной схемы видно, что в ацетатном буферном растворе концентрация водородных ионов будет зависеть от степени диссоциации молекул кислоты. Согласно закону действия масс константа диссоциации уксусной кислоты будет
откуда
Это равенство справедливо для раствора, в котором содержится только одна уксусная кислота. Добавление к раствору уксусной кислоты ацетата натрия подавляет ее диссоциацию (принцип Ле Шателье), в результате чего концентрацию молекул недиссоциированной СН3СООН можно без больших погрешностей принять равной общей концентрации кислоты, т.е. [СН3СООН] = Скислота. (2) Учитывая, что соль СН3СООNa как сильный электролит в водном растворе диссоциирована полностью, можно принять, что общая концентрация аниона СН3СОО– практически равна аналитической концентрации соли в данной буферной смеси, т.е. [СН3СОО–] = Ссоль. (3) Подставляя значения (2) и (3) в уравнение константы диссоциации (1), получим:
Взяв обратный логарифм от обеих частей этого уравнения и обозначив
или
В общем случае для любого буфера уравнение (4) принимает следующий вид:
и носит название уравнения Гендерсона-Гассельбаха.
Для щелочного буфера, каким является, например, аммиачный, соответственно будет:
и
Из приведенных уравнений видно, что рН буферных смесей зависит от константы диссоциации кислоты или основания и от соотношения концентрации компонентов буферных смесей.
Механизм буферного действия При разбавлении буферных растворов концентрации обоих компонентов смеси уменьшаются в одинаковое число раз. Следовательно, исходя из уравнения Гендерсона-Гассельбаха, величина рН буферных растворов при этом не должна изменяться.
Ацетатная буферная система. Рассмотрим механизм буферного действия:
При добавлении соляной кислоты к ацетатному буферу происходит взаимодействие с одним из компонентов смеси (СН3СООН):
Как видно из уравнения (I), сильная кислота заменяется эквивалентным количеством слабой кислоты (в данном случае HCl заменяется CH3COOH). В соответствии с законом разведения Оствальда повышение концентрации уксусной кислоты понижает степень ее диссоциации, а в результате этого концентрация ионов Н+ в буфере увеличивается незначительно. При добавлении к буферному раствору щелочи концентрация водородных ионов и рН изменяется также незначительно. Щелочь при этом будет реагировать с другим компонентом буфера (СН3СООН) по реакции нейтрализации:
В результате этого добавленная щелочь заменяется эквивалентным количеством слабоосновной слои, в меньшей степени влияющей на реакцию среды, чем NaOH. Поскольку в результате этой реакции уксусная кислота расходуется, можно было бы ожидать значительного снижения содержания ионов Н+. Однако вместо прореагировавших ионов кислоты Н+ и СН3СОО– за счет потенциальной кислотности образуются новые ионы Н+ и СН3СОО–, и активная кислотность смеси (рН) почти не меняется.
Аммонийная буферная система Этот буфер содержит слабое основание (К = 1,87·10–5) и его аммонийную соль, образованную сильной кислотой, которая диссоциирует полностью:
Механизм действия аммонийного буфера заключается в том, что при добавлении к буферу сильной кислоты происходит реакция нейтрализации и кислота заменяется эквивалентным количеством соли по уравнению
Щелочь, добавленная к буферу, взаимодействует с солью, в результате чего образуется слабое основание, и рН смеси мало изменяется:
Способность буферных систем стойко удерживать на определенном уровне концентрацию ионов водорода является ограниченной.
Величину, характеризующую способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочей, называют буферной емкостью системы.
Мерой буферной емкости служит обычно количество сильной кислоты или сильного основания, которое необходимо прибавлять к раствору буферной смеси, чтобы рН этого раствора изменилось на единицу. Математически буферная емкость определяется следующим образом. Буферная емкость по кислоте:
Буферная емкость по щелочи:
где Nкисл и Nосн – нормальные концентрации сильной кислоты и щелочи соответственно; Vкисл, Vоснов, V(БР) – соотв
|
||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 745; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.170.253 (0.013 с.) |






 (рН < 7)
(рН < 7)

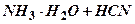


 (рН ≈ 7)
(рН ≈ 7)




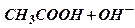 (рН > 7)
(рН > 7) Диффузия может быть выражена количественно. Предположим, что на некотором расстоянии x1 от дна от дна сосуда концентрация раствора равна С1, а на расстоянии x 2 концентрация С2, причем С1 > С2. Следовательно, изменение концентрации, приходящееся на единицу расстояния между С1 и С2 (градиент концентрации), равно
Диффузия может быть выражена количественно. Предположим, что на некотором расстоянии x1 от дна от дна сосуда концентрация раствора равна С1, а на расстоянии x 2 концентрация С2, причем С1 > С2. Следовательно, изменение концентрации, приходящееся на единицу расстояния между С1 и С2 (градиент концентрации), равно
 ,
, – скорость диффузии, моль/с; S – площадь поверхности, м2;
– скорость диффузии, моль/с; S – площадь поверхности, м2; 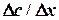 – градиент концентрации, моль/м2; D – коэффициент пропорциональности, м2/с, называемый коэффициентом диффузии вещества.
– градиент концентрации, моль/м2; D – коэффициент пропорциональности, м2/с, называемый коэффициентом диффузии вещества. ,
, Одностороннее перемещение растворителя через мембрану можно объяснить тем, что с поверхности мембраны снизу соприкасается больше молекул растворителя, чем сверху, где часть объема занята молекулами растворенного вещества, не проникающего через нее. Поэтому в единицу времени вверх будет переходить больше молекул растворителя, чем в обратном направлении.
Одностороннее перемещение растворителя через мембрану можно объяснить тем, что с поверхности мембраны снизу соприкасается больше молекул растворителя, чем сверху, где часть объема занята молекулами растворенного вещества, не проникающего через нее. Поэтому в единицу времени вверх будет переходить больше молекул растворителя, чем в обратном направлении. .
. .
. ,
, , где n – число молей неэлектролита, V – объем раствора; R – универсальная газовая постоянная, равная 8,31 кПа×л/(моль·К); Т – абсолютная температура, К.
, где n – число молей неэлектролита, V – объем раствора; R – универсальная газовая постоянная, равная 8,31 кПа×л/(моль·К); Т – абсолютная температура, К. или
или  .
. .
. ;
; 
 ;
;  ;
;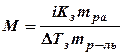 ;
;  .
.
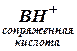




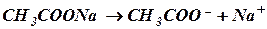
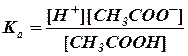 ,
, . (1)
. (1)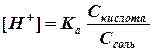 .
.
 . (4)
. (4)

 ,
,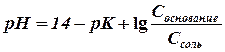 . (5)
. (5)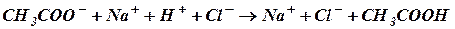 , (I)
, (I) . (II)
. (II)

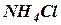
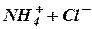

 .
.

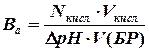 , моль/л
, моль/л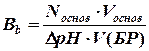 , моль/л
, моль/л


