Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: «биологически активные гетероциклическиеСодержание книги
Поиск на нашем сайте
СОЕДИНЕНИЯ»
Цель темы: Сформировать знания строения и особенностей химического поведения гетероциклических соединений, обладающих биологической активностью. Исходный уровень: 1. Сопряжение и ароматичность. 2. Электронное строение пиридинового и пиррольного атомов азота. 3. Реакции электрофильного и нуклеофильного замещения. 4. Водородная связь. 5. Кислотность и основность органических соединений. 6. Лактим-лактамная таутомерия.
Студент должен знать: 1. Определение и классификацию гетероциклических соединений. 2. Строение и свойства пятичленных гетероциклов с двумя и более гетероатомами. 3. Строение и свойства пиридина и его производных. 4. Строение и свойства шести- и семичленных гетероциклов с двумя и более гетероатомами. 5. Бициклические гетероциклы.
Студент должен уметь:
1.Определять принадлежность соединения к определенному виду гетероциклов. 2. Проводить качественные реакции на антипирин и амидопирин. 3. Проводить качественную реакцию (мурексидная проба) на вещества, содержащие пуриновое основание.
Теоретическая часть Гетероциклическими называют циклические органические соединения, в состав цикла которых, помимо атомов углерода, входят один или несколько атомов других элементов (гетероатомов). Наибольшее распространение в природе имеют пяти- и шестичленные циклы, содержащие в качестве гетероатомов кислород, азот, серу. В таких соединениях валентные углы между атомами в цикле существенно не отличаются от обычных валентных углов sp 3- или sp 2-гибридизованного атома углерода. Включение гетероатомов N, O и S вместо групп – СН2 – или – С = в циклическую группировку мало сказывается на напряжении цикла и не очень сильно изменяет общую геометрию молекулы. По степени насыщенности все гетероциклические соединения могут быть отнесены к насыщенным, ненасыщенным и ароматическим. Насыщенные гетероциклы:
Ненасыщенные гетероциклы:
Ароматические гетероциклы – очень обширная группа гетероциклов, имеющих сопряженные системы кратных связей. Такого рода гетероциклы напоминают своей устойчивостью и типами реакций бензол и его производные.
Именно ароматические гетероциклические соединения широко распространенны в природе.
Гетероциклические соединения делятся на группы прежде всего по общему числу атомов в цикле, затем по виду и числу гетероатомов в цикле. Гетероциклы могут быть сконденсированы с другими циклами.
Наиболее важные гетероциклы, лежащие в основе многих природных физиологически активных веществ и лекарственных средств, подразделяются на группы: 1. Пятичленные а) С одним гетероатомом, например
б) С двумя гетероатомами, например
2. Шестичленные а) С одним гетероатомом, например:
б) С двумя гетероатомами, например:
3. Конденсированные с другими циклами, например:
Лабораторная работа Опыт 40. Реакции антипирина и амидопирина с хлоридом железа (III) В пробирку поместите несколько кристалликов антипирина (54), прибавьте 2 капли воды и каплю 1% раствора хлорида железа (III) (7). Появляется интенсивное и стойкое оранжево-красное окрашивание, не исчезающее при стоянии. Для сравнения поместите в другую пробирку несколько кристалликов амидопирина (55), добавьте 2 капли воды и 1 каплю 1% раствора хлорида железа (III) (7). Появляется фиолетовое окрашивание, быстро исчезающее. Добавьте сразу еще 3 капли хлорида железа (III). Окраска вновь появляется, сохраняется несколько дольше, но постепенно бледнеет. Окрашивание антипирина с хлоридом железа(III) обусловлено образованием комплексного соединения ферропирина, амидопирина – образованием продуктов окисления. Реакция с хлоридом железа(III) является качественной, позволяющей отличить амидопирин от антипирина. Вопросы: 1. Назовите причины возникновения окраски антипирина с хлоридом железа(III). 2. Назовите причины образования окраски амидопирина схлоридом железа(III). 3. Какое практическое значение имеет реакция антипирина и амидопирина с хлоридом железа(III). Опыт 41. Реакция антипирина и амидопирина с азотистой кислотой В пробирку поместите несколько кристаллов антипирина (54), добавьте 2 капли воды, 1 каплю 10% раствора серной кислоты (15) и 1 каплю 5% раствора нитрита натрия (13). Появляется изумрудно-зеленое окрашивание, постепенно исчезающее, особенно при избытке нитрита натрия. Для сравнения поместите в другую пробирку несколько кристаллов амидопирина (55). Добавьте 2 капли воды, 1 каплю 10% раствора серной кислоты (15) и 1 каплю 5% раствора нитрита натрия (13). Появляется нестойкое фиолетовое окрашивание. Если окрашивание исчезает слишком быстро, добавьте еще немного амидопирина. С амидопирином образуются окрашенные продукты окисления.
Подобно приведенным реакциям с хлоридом железа (III), реакция с азотистой кислотой применяется в фармацевтической практике для распознавания антипирина и амидопирина и отличия их друг от друга. Вопросы: 1. Напишите схему взаимодействия антипирина с азотистой кислотой. 2. По какому механизму протекает реакция антипирина с азотистой кислотой? 3. Где применяется реакция антипирина и амидопирина с азотистой кислотой? Опыт 42. Растворимость пиридина в воде и его основный характер В пробирку поместите 1 каплю пиридина (56). Обратите внимание на его характерный запах (запах денатурата). Добавьте 1 каплю воды, сразу получается прозрачный раствор. Добавьте еще 4 капли воды. Пиридин хорошо растворим в воде и смешивается с ней во всех отношениях. Пинцетом возьмите узкую полоску красной лакмусовой бумажки (на общем столе) и смочите ее раствором пиридина, для чего наклоните пробирку с раствором. Можно заметить только слабое посинение красной лакмусовой бумажки, точнее – переход от красного цвета к фиолетовому, что указывает на слабоосновный характер пиридина. Вопросы: 1. Почему пиридин проявляет основный характер? 2. Напишите схему взаимодействия пиридина с водой. Опыт 43. Растворимость мочевой кислоты и ее натриевой соли в воде В пробирку поместите небольшое количество (на кончике лопаточки) мочевой кислоты (49). Прибавьте по каплям воду, каждый раз встряхивая пробирку. Обратите внимание на плохую растворимость мочевой кислоты в воде. В холодной воде мочевая кислота почти нерастворима: 1 часть ее растворяется в 39 000 частях воды. После добавления 8 капель воды растворения все еще не заметно. Стоит, однако, добавить всего 1 каплю 10% раствора гидроксида натрия (2), как мутный раствор моментально просветляется вследствие образования относительно легкорастворимой двузамещенной соли натрия. Полученный раствор сохраните для последующего опыта. Вопросы: 1. Напишите таутомерные формы мочевой кислоты. 2. Напишите схему взаимодействия мочевой кислоты с гидроксидом натрия. Опыт 44. Открытие мочевой кислоты (мурексидная проба) На предметное стекло с помощью пипетки поместите 1 каплю раствора натриевой соли мочевой кислоты (см. опыт 43). Добавьте 1 каплю концентрированной азотной кислоты (на общем столе) и осторожно выпаривайте, держа стекло над пламенем горелки на некотором расстоянии (примерно 10 см). Как только раствор выпарится и начнется слабое покраснение пятна на месте бывшей капли, прекратите нагревание. Когда стекло остынет, сбоку от пятна поместите 1 каплю 10% раствора аммиака (5). На месте соприкосновения наблюдается появление полоски пурпурно-фиолетового цвета (мурексидная проба). При окислении азотной кислотой мочевая кислота, как и прочие пуриновые основания (например, кофеин), образует аллоксантин. При смачивании образовавшегося аллоксантина аммиаком получается аммониевая соль очень неустойчивой в свободном виде пурпурной кислоты – мурексид. Мурексидная проба применяется при анализе мочевых камней. Применяется эта проба также при открытии кофеина, теобромина и других пуриновых оснований.
Вопросы: 1.Объясните причины возникновения окрашивания в мурексидной пробе. 2.Какое применение в медицине находит мурексидная проба? Зачетные вопросы 1. Биологически важные гетероциклические системы. Пятичленные гетероциклы с одним гетероатомом. Пиролл, фуран, тиофен. Понятие о строении тетрапирольных соединений (порфин, гемм). Линейные тетрапирольные соединения. 2. Индол (бензопиррол). Строение, свойства. Биологически активные производные индола. 3. Пятичленные гетероциклы с двумя и более гетероатомами. Имидазол, свойства; медико-биологическое значение производных. 4. Пиразол, оксазол, тиазол. Строение, свойства, биологические функции производных. Пиразолон-3 – структурная основа ненаркотических анальгетиков (анальгин). 5. Шестичленные гетероциклы с одним гетероатомом. Пиридин, никотиновая кислота и никотинамид. Изоникотиновая (γ-пиридинкарбоновая кислота), медико-биологические функции производных. 6. Шестичленные гетероциклы с одним гетероатомом: пиримидин, пиразин. Гидрокси- и аминопроизводные пиримидина – компоненты нуклеиновых кислот. Барбитуровая кислота и ее произодные. 7. Бициклические гетероциклы. Пурин. Гидрокси- и аминопурины. Мочевая кислота. Лактим-лактамовая таутомерия. Аденин; медико-биологическое значение производных, таутомерные формы. 8. Понятие об алкалоидах. Гигрин, никотин. Производные тропана - атропин и кокаин. Метилированные ксантины – кофеин, теофиллин, теобромин.
Литература:
1. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. – М.: Медицина, 1985, глава 15. 2. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. – М.: Медицина, 1990, глава 10. 3. Руководство к лабораторным занятиям по биоорганической химии. Под ред. Н.А. Тюкавкиной. М.: Медицина, 1985. с – 163-179.
Хронометраж 3-х часового занятия: 1. Организационный момент – 2 мин; 2. Опрос – 40 мин; 3. Пояснения к выполнению работы – 25 мин; 4. Выполнение и оформление работы – 30 мин; 5. Изложение нового материала – 45 мин 6. Проверка работ и задание на дом – 3 мин.
Занятие № 14 Тема: α-АМИНОКИСЛОТЫ
Время: 3 часа Цель темы: Сформировать знания о строении и свойствах важнейших Исходный уровень: 1. Стереоизомерия. Асимметрический атом углерода. 2. Реакции среды водных растворов. Водородный показатель.
3. Кислотность и основность органических соединений. 4. Водородная связь. 5. Реакции нуклеофильного замещения в карбоксильной группе. Получение амидов кислот и их гидролиз. 6. Химические свойства аминогруппы. Основность и нуклеофильность аминогруппы. 7. Окисление тиолов и восстановление дисульфидов.
Студент должен знать: 1. Классификацию α-аминокислот. 2. В какой форме α-аминокислоты существуют в различных средах. 3. Химические свойства аминокислот. Студент должен уметь: 1.Давать названия аминокислотам и их производным. 2. Качественно определять аминокислоты в смеси с другими веществами. 3. Писать реакции взаимодействия аминокислот с ацилирующими и алкилирующими реагентами, с формальдегидом, азотистой кислотой, нингидрином.
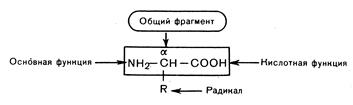
Теоретическая часть Многообразные пептиды и белки состоят из остатков α-аминокислот. Общее число встречающихся в природе аминокислот достигает 300, однако некоторые из них обнаружены лишь в определенном сообществе или даже в одном организме. Среди них выделяется группа из 20 наиболее важных α-аминокислот. α-Аминокислоты – гетерофункциональные соединения. Они обязательно содержат карбоксильную группу и аминогруппу, находящиеся у одного и того же атома углерода.
Основным источником α-аминокислот для живого организма служат пищевые белки. Многие α-аминокислоты синтезируются в организме, некоторые же необходимые для синтеза белков α-аминокислоты не синтезируются в организме и должны поступать извне. Такие аминокислоты называются незаменимыми: Валин, лейцин, изолейцин, лизин, треонин, метионин, фенилаланин, триптофан. При некоторых, чаще всего врожденных, заболеваниях перечень незаменимых кислот расширяется. Например, при фенилкетонурии человеческий организм не синтезирует еще одну α-аминокислоту – тирозин, который в организме здоровых людей получается при гидроксилировании фенилаланина. α-Аминокислоты классифицируют несколькими способами в зависимости от признака, положенного в основу их деления на группы. Одним из классификационных признаков служит химическая природа радикала R. По этому признаку α-аминокислоты делятся на алифатические, ароматические и гетероциклические. Внутри группы алифатических кислот выделяют нейтральные (одна NH2- и одна COOH-группы), основные (две NH2- и одна COOH-группы) и кислые (одна NH2- и две COOH-группы) аминокислоты. В зависимости от характера бокового радикала α-аминокислоты делятся на две группы: с неполярными (гидрофобными) и полярными (гидрофильными) радикалами. К первой группе относятся α-аминокислоты с алифитическим (аланин, валин, лейцин, изолейцин, метионин) и ароматическим (фенилаланин, триптофан) боковыми радикалами. Ко второй группе принадлежат α-аминокислоты, у которых в радикале имеются полярные функциональные группы, способные к ионизации (ионогенные) или не способные переходить в ионное состояние (неионогенные) в условиях организма. Например, в тирозине гидроксильная группа ионогенная (имеет фенольный характер), в серине – неионогенная (имеет спиртовую природу).
Амфотреность α-аминокислот обусловлена наличием в их молекулах функциональных групп кислотного (СООН) и основного (NH2) характера. Поэтому α-аминокислоты образуют соли как со щелочами, так и кислотами. α-Аминокислоты как гетерофункциональные соединения вступают в реакции, характерные для карбоксильной группы и аминогруппы. Некоторые химические свойства α-аминокислот обусловлены наличием функциональных групп в радикале.
Лабораторная работа студентов на практическом занятии Опыт №45. Реакция глицина с нингидрином В пробирку поместите 4 капли 1% раствора глицина и 2 капели 0,1% раствора нингидрина. Содержимое пробирки осторожно нагрейте до появления сине-красной окраски. Вопросы: 1. Напишите уравнение реакции взаимодействия глицина с нингидрином. 2. Какими внешними признаками характеризуется реакция а-аминокислот с нингидридом? 3. Какое практическое применение имеет реакция а-аминокислот с нингидрином?
Опыт №46. Реакция глицина с формальдегидом В пробирку поместите 5 капель 1 % раствора глицина и 1 каплю индикатора метилового красного. Раствор окрашивается в желтый цвет (нейтральная среда). К полученной смеси добавьте равный объем формалина. Отметьте появление красной окраски (кислая среда). Данная реакция под названием «формольное титрование» используется для количественного определения карбоксильных групп в α-аминокислотах. Вопросы: 1. Напишите уравнение реакции взаимодействия глицина с формальдегидом. 2. Каковы причины изменения окраски индикатора? 3. Какое практическое применение имеет реакция α-аминокислот с формальдегидом (метод Серенсена)?
Опыт №47. Реакция глициа с азотистой кислотой В пробирку поместите 5 капель 1% раствора глицина и равный объем 5% раствора нитрита натрия. Добавьте концентрированной уксусной кислоты и осторожно взболтайте смесь. Наблюдается выделение газа. Реакция используется для количественного определения аминогрупп в аминокислотах. Вопросы: 1. Напишите схему взаимодействия глицина с азотистой кислотой. Назовите образовавшиеся соединения. 2. Какое практическое применение имеет реакция аминокислот с азотистой кислотой (метод Ван-Слайка)? Опыт №48. Образование комплексной соли меди глицина В пробирку поместите 1 мл 1% раствора глицина. Добавьте на кончике лопаточки сухой карбонат меди (II) и смесь нагрейте. Раствор окрашивается в синий цвет. Вопросы: 1. Напишите схему взаимодействия глицина с карбонатом меди (II). 2. Какой цвет характерен для растворов комплексных солей меди? Какой тип комплексообразования имеет здесь место? Опыт №49. Амфотерные свойства α-аланина 1. В пробирку поместите 5 капель 1% раствора α-аланина и добавьте по каплям 0,1% раствор хлороводородной кислоты, подкрашенный индикатором конго в синий цвет, до появления розово-красной окраски. 2. В пробирку поместите 5 капель 1% раствора α-аланина и по каплям добавьте 0,1% раствор гидроксида натрия, подкрашенный фенолфталеином, до исчезновения окраски. Вопросы: 1. Напишите уравнение реакции взаимодействия α-аланина с гидроксидом натрия. Почему изменяется окраска индикатора в ходе реакции? 2. Напишите уравнение реакции взаимодействия α-аланина с хлороводородной кислотой. Почему изменяется окраска индикатора в ходе реакции? 3. Почему α-аминокислоты способны взаимодействовать с кислотами и щелочами?
Занятие № 15 ТЕМА: ПЕПТИДЫ. БЕЛКИ
Время: 3 часа Цель темы: Сформировать знания о строении и химической основе структурной организации олигопептидов, полипептидов и белковых молекул для дальнейшего изучения биологических функций различных белков на молекулярном уровне. Исходный уровень: 1. Конформационные представления в органической химии. 2. Кислотность и основность органических соединений. 3. Водородная связь. 4. Реакции нуклеофильного замещения в карбоксильной группе. Получение амидов кислот и их гидролиз. 5. Химические свойства аминогруппы. 6. Окисление тиолов и восстановление дисульфидов. 7. Кислотно-основные свойства аминокислот. 8. Химические свойства аминокислот. 9. Биологически важные химические реакции α-аминокислот.
Студент должен знать: 1. Пространственное строение полипептидов и белков. 2. Характерные свойства и признаки вторичной, третичной и четвертичной структуры. 3. Качественные реакции на белки. 4. Признаки глобулярных и фибриллярных белков.
Студент должен уметь: 1. Описывать строение пептидной группы. 2. Писать химизм определения аминокислотной последовательности в белках (метод Эдмана, метод ДНФ, дансильный метод). Теоретическая часть Белки составляют материальную основу химической деятельности клетки. Функции белков в природе универсальны. Среди них различают ферменты, гормоны, структурные (кератин, фиброин, коллаген), транспортные (гемоглобин, миоглобин), двигательные (актин, миозин), защитные (иммуноглобулины), запасные (казеин, яичный альбумин) белки, токсины (змеиные яды, дифтерийный токсин). В зависимости от величины молекулярной массы различают пептиды и белки. Пептиды имеют меньшую молекулярную массу, чем белки. В биологическом плане пептиды отличаются от белков более узким спектром функций. Наиболее характерна для пептидов регуляторная функция (гормоны, антибиотики, токсины, ингибиторы и активаторы ферментов, переносчики ионов через мембраны и т.д.). Пептиды и белки представляют собой соединения, построенные из остатков α-аминокислот. Условно считают, что пептиды содержат в молекуле до 100 (что соответствует молекулярной массе до 10000), а белки – свыше 100 аминокислотных остатков (молекулярная масса от 10000 до нескольких миллионов). Пептидную или белковую молекулу формально можно представить как продукт поликонденсации α-аминокислот протекающей с образованием пептидной (амидной) связи между мономерными звеньями. При единообразно построенной полиамидной цепи специфичность пептидов и белков определяется двумя важнейшими характеристиками – аминокислотным составом и аминокислотной последовательностью. Аминокислотный состав пептидов и белков – это природа и количественное соотношение входящих в них α-аминокислот. Аминокислотный состав устанавливается путем анализа пептидных и белковых гидролизаторов в основном хроматографическими методами. В настоящее время такой анализ осуществляется с помощью аминокислотных анализаторов. Амидные связи способны гидролизоваться как в кислой, так и щелочной средах. Пептиды и белки гидролизуются с образованием либо более коротких цепей – это так называемый частичный гидролиз, либо смеси α-аминокислот при полном гидролизе. Для высокомолекулярных полипептидов и белков наряду с первичной структурой характерны более высокие уровни организации, которые принято называть вторичной, третичной и четвертичной структурами. Вторичная структура описывается пространственной ориентацией основной полипептидной цепи, третичная – трехмерной архитектурой всей белковой молекулы. Как вторичная, так и третичная структуры связаны с упорядоченным расположением макромолекулярной цепи в пространстве. Вторичная структура закрепляется, как правило, с помощью водородных связей между пептидными группами, довольно близко расположенными в цепи α-аминокислотных остатков. Его основные виды – α-спираль и β-структура. Третичная структура стабилизируется не только водородными связями, но и другими видами взаимодействий, например ионным, гидрофобным, а также дисульфидными связями. Первые три уровня характерны для структурной организации всех белковых молекул. Четвертый уровень встречается при образовании единых белковых комплексов, состоящих из нескольких полипептидных цепей. Определяющее значение в формировании более высоких уровней организации белковых молекул имеет их первичная структура. Природа α-аминокислотных остатков и порядок их соединения обуславливают характер стабилизации более высокоорганизованных структур. При этом существенную роль играет важнейшее звено первичной структуры – пептидная группа. По пространственной структуре белки делятся на два больших класса – глобулярные и фибриллярные. Для глобулярных белков более характерна α-спиральная структура, а цепи их изогнуты в пространстве так, что макромолекула приобретает форму сферы. Глобулярные белки растворяются в воде и солевых растворах с образованием коллоидных систем. Примеры глобулярных белков – альбумин, глобин, миоглобин, почти все ферменты. Для фибриллярных белков более характерна β-структура. Как правило, они имеют волокнистое строение, не растворяются в воде. К ним относятся многие широко распространенные белки –β-кератин, β-фиброин шелка, коллаген. Лабораторная работа студентов на практическом занятии
Опыт №52. Биуретовая реакция на пептидную связь В пробирку поместите 5-6 капель раствора яичного белка, добавьте равный объем 10% раствора гидроксида натрия и по стенке добавьте 1-2 капли раствора сульфата меди (II). Наблюдается появление фиолетовой окраски. Вопросы: 1. Напишите схему образования биурета. 2. Каковы внешние признаки положительной биуретовой реакции? 3. Все ли белки дают биуретовую реакцию? Наличие какого структурного фрагмента в молекуле необходимо для положительной биуретовой реакции? Можно ли считать эту реакцию положительной?
Опыт №53. Ксантопротеиновая реакция белков В пробирку поместите 10 капель раствора яичного белка и 2 капли концентрированной азотной кислоты. Содержимое пробирки осторожно нагрейте все время встряхивая. Раствор и осадок окрашиваются в желтый цвет. Охладив пробирку, осторожно добавьте 1-3 капли 10% раствора гидроксида натрия до появления ярко-оранжевой окраски. Вопросы: 1. Какие α-аминокислоты в составе белка можно открыть с помощью ксантопротеиновой реакции? 2. На примере соответствующей аминокислоты напишите ее реакцию взаимодействия с азотной кислотой. 3. Можно ли считать данную реакцию качественной на белок? Опыт №54. Реакция на присутствие серусодержщих α-аминокислот В пробирку поместите 10 капель раствора яичного белка и вдвое больший объем 10% раствора гидроксида натрия. Содержимое прибирки перемешайте, нагрейте до кипения (1-2 мин.), к полученному щелочному раствору добавьте 5 капель 10% ацетата свинца (И) и вновь прокипятите. Отметьте появление серо-черного осадка. Вопросы: 1. Напишите в общем виде схему реакции белка с ацетатом свинца (II). 2. Какие α-аминокислоты в составе белка можно открыть данной качественной реакцией? Зачетные вопросы 1. Первичная структура пептидов и белков. Состав и аминокислотная последовательность. Ферментативный гидролиз белков. 2. Химические способы определения первичной структуры пептидов и белков: метод динитрофенилирования, метод Эдмана, дансильный метод. 3. Строение и синтез пептидов. Метод защиты аминогруппы, активация карбоксильной группы - Дипептиды. - Трипептиды. - Пептидные антибиотики. - Пептидные гормоны. - Пептидные токсины. - Нейропептиды. 4. Пространственное строение полипептидов и белков: - Строение пептидной группы. - Вторичная структура полипептидов и белков: α-спираль, β-складчатая структура, спираль коллагена. - Третичная структура белков; электростатические и гидрофобные взаимодействия в структуре, водородные и дисульфидные связи; активный центр («щель») в третичной структуре лизоцима. - Четвертичная структура белка. - Денатурация и ренатурация нативной конформации. Литература: Основная 1. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. - М. 1985, гл. 16, с. 320-349, (1991, гл. 11, с. 334-376.) 2. Руководство к лабораторным занятиям по биоорганической химии. Под. ред. Тюкавкиной Н.А. - М. 1985, тема 3.1, с. 184-201, оп. 52-54.
Дополнительная 3. Терней А. Современная органическая химия. - М. 1981, т. 2, гл. 25, с. 399-412. 4. Робертс Дж., Касерио М. Основы органической химии. - М. 1978, т. 2, гл. 20, с. 114-133. 5. Ленинджер А. Биохимия. - М. 1976, гл. III, с. 62-75, гл. V, с. 102-125, гл. VI, с. 128-147. Хронометраж 3-х часового занятия: 1. Организационный момент – 2 мин; 2. Опрос – 40 мин; 3. Пояснения к выполнению работы – 25 мин; 4. Выполнение и оформление работы – 30 мин; 5. Изложение нового материала – 45 мин 6. Проверка работ и задание на дом – 3 мин.
Занятие № 16 ТЕМА: НУКЛЕИНОВЫЕ КИСЛОТЫ Время: 3 часа
Цель темы. Сформировать знания строения и химических свойств нуклеиновых кислот и их мономерных единиц – нуклеотидов кА химическую основу для усвоения различных уровней структурной организации макромолекул нуклеиновых кислот и действия нуклеотидных коферментов.
Исходный уровень 1) Цикло-оксо- и лактим-лактамная таутомерия 2) Строение и свойства N-гликозидов 3) Строение и свойства сложных эфиров 4) Водородная связь Студент должен знать: 1.Строение и химические свойства нуклеиновых кислот. 2.Строение и свойства нуклеотидов как основу для усвоения различных уровней структурной организации макромолекул нуклеиновых кислот 3. Действие нуклеотидных коферментов.
Студент должен уметь: 1. Писать таутомерные превращения нуклеиновых оснований 2.Изображать строение нуклеозидов 3.Писать структурные формулы нуклеотидов 4.Писать строение трехнуклеотидных участков цепи ДНК 5.Писать схемы обратимых окислительно-восстановительных реакций с участием кофермента НАД+
Теоретическая часть
Нуклеиновые кислоты – это природные высокомолекулярные соединения (биополимеры), макромолекулы которых состоят из мононуклеотидов. Особенность нуклеотидов состоит в том, что они представляют собой трехкомпонентное образование, включающее гетероциклическое основание, углеводный остаток и фосфатную группу. Углеводными компонентами служат пентозы – D-рибоза и 2-дезокси-D-рибоза. Поэтому нуклеиновые кислоты делят на рибонуклеиновые (РНК) и дезоксирибонуклеиновые (ДНК). Нуклеиновые основания. В состав нуклеиновых кислот входят гетероциклические азотистые основания пиримидинового или пуринового ряда. Пиримидиновые основания – производные пиримидина – 6-тичленного гетероцикла, содержащего два атома азота. Пуриновые основания – производные пурина, который представляет собой конденсированный гетероцикл, состоящий из цикла пиримидина и цикла имидазола. В качестве заместителей нуклеиновые основания в гетероциклическом ядре могут содержать: либо оксо-группу, как в урациле и тимине; либо аминогруппу, как в аденине; либо одновременно обе эти группы, как в цитозине и гуанине. Нуклеозиды. Нуклеиновые основания образуют N-гликозиды с D-рибозой или 2-дезокси-D-рибозой. Такие N-гликозиды называют нуклеозидами. D-рибоза и 2-дезокси-D-рибоза в состав природных нуклеозидов входят в фуранозной форме. Гликозидная связь осуществляется между аномерным атомом углерода С-1 рибозы и атомом азота N-1 пиримидинового или N-9 пуринового оснований. Природные нуклеозиды всегда являются β-аномерами. Являясь N-гликозидами, нуклеозиды устойчивы к гидролизу в слабощелочной среде, но расщепляются в кислой. Нуклеотиды. Нуклеотидами называют фосфаты нуклеозидов. Фосфорная кислота обычно вступает в реакцию этерификации со спиртовым гидроксилом при С-5’ или С-3’ в остатке рибозы (рибонуклеотиды) или дезоксирибозы (дезоксирибонуклеотиды). Для связывания трех компонентов в молекуле нуклеотида используются сложноэфирная и N-гликозидная связи. Нуклеотиды можно рассматривать, с одной сотороны, как эфиры нуклеозидов (фосфаты), с другой – как кислоты (наличие остатка фосфорной кислоты).
|
||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 1455; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.19.62.227 (0.013 с.) |