
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторные работы на практическом занятии. (Стр. 52).Содержание книги
Поиск на нашем сайте
Опыт 10. Получение этилата натрия и его гидролиз. В сухую пробирку поместить 3 капли этанола и внести размером с рисовое зернышко кусочек металлического натрия, предварительно отжатый от керосина на отфильтрованной бумаге. Соберите выделяющийся водород, прикрыв пробирку пробкой. Затем уберите пробку и поднесите пробирку отверстием к пламени горелки. Смесь водорода с воздухом сгорает с характерным «лающим» звуком. Белый осадок этилата натрия растворите в 2-4 каплях этанола и добавьте 1 каплю 1% спиртового раствора фенолфталеина. Затем внесите в пробирку 1-2 капли воды. Объясните появление малиновой окраски. Вопросы: 1. Напишите уравнение реакций получения этилата натрия и его гидролиза. 2. Какое свойство спиртов проявляется в реакции с металлическим натрием? 3. Можно ли с помощью цветных индикаторов обнаружить кислотные свойства эталона? 4. Почему спирты реагируют с натрием медленнее, чем вода? 5. Почему вода разлагает этилат натрия? Опыт 11. Получение этиленгликолята меди (II). В пробирку внесите 2 капли 2%-ного раствора сульфата меди (II) и 2 капли 10%-ного раствора гидроксида натрия. К осадку добавьте 1 каплю этиленгликоля и встряхните пробирку. Образуется гликолят меди, раствор которого имеет синюю окраску. Эта реакция используется для обнаружения органических соединений, содержащих диольный фрагмент (две гидроксильные группы у соседних атомов углерода). Вопросы: 1. Напишите схему взаимодействия этиленгликоля с гидроксидом меди (II) с образованием хелатного комплекса гликолята меди. 2. Какой структурный фрагмент содержат органические соединения, растворяющие гидроксид меди (II)? 3. Сравните кислотность этиленгликоля и этанола. Какими реакциями можно подтвердить различие в их кислотности? Опыт 12. Образование фенолята натрия и разложение его кислотой. В пробирку с 3 каплями воды поместите несколько кристаллов фенола и встряхните. К возникшей мутной эмульсии добавляйте по каплям 10%-ный раствор гидроксида натрия, до прозрачного раствора. Подкислите этот раствор несколькими каплями 10%-ного раствора хлороводородной кислоты. Вопросы: 1. Напишите уравнение реакции получения фенолята натрия. 2. Почему фенол в отличие от спиртов способен реагировать с щелочами? 3. В чем причина более кислого характера фенольного гидроксила по сравнению со спиртовым? 4. Почему при добавлении НСl к раствору фенолята натрия наблюдается помутнение раствора? 5. Почему фенолят натрия не разлагается водой? Опыт 13. Основность алифатических и ароматических аминов. 1.В две пробирки внесите по 2 капли воды. Затем в 1-ую пробирку поместите 1 каплю анилина, а во 2-ую – 1 каплю диэтиламина и взболтайте. Сравните растворимость этих аминов в воде. Определите рН растворов анилина и диэтиламина. 2. К эмульсии анилина в воде добавьте 1 каплю 10%-ного раствора хлороводородной кислоты. Образуется прозрачный раствор. К раствору диэтиламина прибавьте 3 капли насыщенного раствора пикриновой кислоты. И перемешайте. Пробирку поместите в стакан с холодной водой. Через некоторое время выпадает осадок пикрата диэтиламина. Вопросы: 1. Сравните основность диэтиламина и анилина. 2. Почему при добавлении к эмульсии анилина хлороводородной кислоты образуется прозрачный раствор? Напишите уравнение реакции. 3. Напишите схему взаимодействия диэтиламина с пикриновой кислотой (2,4,6- тринитрофенол). Зачетные вопросы 1. Как делятся кислоты в зависимости от природы элемента, связанного с протоном? 2. Что такое Ка, рКа? Какая существует зависимость между их величиной и силой кислоты? 3. Дать определении кислоты и основания по теории Бренстеда. 4. От каких факторов зависит сила кислот? Перечислите их. 5. Как зависит кислотность от природы атома в кислотном центре? Как она изменяется в группах, в периодах? Почему? 6. Охарактеризуйте влияние донорных и акцепторных заместителей на силу кислоты и оснований. 7. Как зависит кислотность от природы растворителя? 8. Что такое р- и π-основания? Приведите примеры. 9. Какая величина является количественной характеристикой силы оснований? Физический смысл рКвн+. 10.Определение кислот и оснований по теории Льюиса. 11.Суть принципа ЖМКО. Охарактеризуйте жесткие и мягкие кислоты и основания. 12.Кислотность жидких систем организма
Литература Основная: 1. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия М.,1985, Гл.6, с. 112-125. 2. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия М.,1991, Гл 4. §4.4., с. 100-116. 3. Руководство к лабораторным занятиям по биоорганической химии. Под редакцией Покавкиной М, 1985. Тема 1,3, с.42-55. Дополнительная: 1. Степаненко Б.Н. Курс органической химии. М.1979. Гл. VII, с. 147-182, гл.ХII, с.270-283. 2. Терней А. Современная органическая химия. М.,1981,Т.1 § 10.5. с.406-408. Т.2, § 23.2., с.285-287. 3. Дж.Робертс, М.Касерио. Основы органической химии. М., 1978,Т. 1 гл.13, § 13-5, с. 419-426. Хронометраж 3-х часового занятия: 1. Организационный момент – 2 мин; 2. Опрос – 40 мин; 3. Изложение нового материала и пояснения к выполнению работы – 60 мин; 4. Выполнение и оформление работы – 30 мин;
5. Проверка работ и задание на дом – 3 мин. Занятие № 12 Тема: Гетерофункциональные алифатические соединения, участвующие в процессах метаболизма Время: 3 часа Цель темы. Сформировать знания о пространственном строении и специфических химических свойствах алифатических гетерофункциональных соединений как основу для последующего изучения и понимания метаболических превращений их в организме. На базе теоретических знаний сформировать умения и навыки в решении задач по оптической изомерии молекул и ее медико-биологическим приложениям, в предсказании стереоизомеров и их реакционной способности, в идентификации различных функциональных групп. Исходный уровень. 1. Электронные эффекты заместителей 2. Кислотность и основность органических молекул. 3. СН-кислоты 4. Нуклеофильные реакции карбонильных соединений. 5. Реакции нуклеофильного замещения и элиминирования у насыщенного атома углерода
Студент должен знать: 1. Классификацию гетерофункциональных соединений. 2. Строение и свойства биологически важных классов поли- и гетерофункциональных соединений. 3. Специфические реакции поли- и гетерофункциональных соединений. 4. Гетерофункциональные производные бензола, используемые в качестве лекарственных средств.
Студент должен уметь: 1. Доказывать амфотерные свойства α-аминокислот. 2. Подтверждать уравнениями реакций наличие двух карбоксильных и двух спиртовых групп в винной кислоте. 3. Писать схему кетонного разложения ацетоуксусного эфира.
Теоретическая часть В живом организме протекает множество катализируемых ферментами химических реакций. Совокупность этих реакций называется обменом веществ или метаболизмом. Подавляющее большинство веществ, участвующих в метаболизме принадлежит к поли или гетерофукциональным соединениям. Функциональные группы, наиболее часто встречающиеся у соединений, участвующих в процессах жизнедеятельности:
- ОН Гидроксильная группа
- NН2 Аминогруппа
Н
-СООН Карбоксильная группа -S O3 H Сульфогруппа -S H Тиольная группа
Полифункциональные соединения содержат несколько одинаковых функциональных групп. Из них наиболее широко представлены в природных объектах соединения с -ОН- группами – многоатомные спирты и многоатомные фенолы. Гетерофункциональные соединения содержат несколько разных функциональных групп. Из соединений с двумя функциональными группами в природных объектах широко представлены аминоспирты, гидроксикислоты, аминокислоты, оксокислоты, ненасыщенные кислоты. В ароматическом ряду основу важных природных биологически активных соединений и синтетических лекарственных средств составляют: n – Аминофенол, n- Аминобензойная кислота, салициловая кислота, сульфаниловая кислота. Наиболее распространенные сочетания двух функциональных групп в биологически важных алифатических соединениях:
Химические свойства поли- и гетерофункциональных соединений в значительной степени определяются свойствами соответствующих монофункциональных производных. Поэтому наблюдается определенное сходство в поведении обоих классов соединений: поли-и гетерофункциональные соединения проявляют свойства, присущие монофункциональным соединениям, т.е. способность вступать в реакции по каждой функциональной группе. Однако одновременное наличие нескольких функциональных групп в молекуле ведет к появлению определенных различий в свойствах моно-, поли- и гетерофункциональных соединений. Во первых, в поли- и гетерофункциональных соединениях может наблюдаться усиление или, наоборот, ослабление каких-то свойств, характерных для монофункциональных соединений. Во-вторых, в поли- и гетерофункциональных соединениях могут появляться специфические химические свойства, которые наиболее важны для обеспечения биологических функций, выполняемых этими веществами. Кислотность. Накопление кислотных групп увеличивает кислотные свойства соединений. Сравним:
СН3 – СН2 - ОН НОСН2 –СН2 –ОН Этанол Этиленгликоль
Этиленгликоль проявляет более сильные кислотные свойства, чем этанол, что связано с –I эффектом группы СН 2ОН
Основность. Накопление основных аминогрупп в молекуле повышает основные свойства соединений.
Сравним:
NH2 А мочевина (2-NН2 группы) образует с ними достаточно устойчивые соли:
О ОН Мочевина Гидрохлорид мочевины.
Амфотерность. Гетерофункциональные соединения, содержащие одновременно кислотные и основные функциональные группы проявляют амфотерные свойства. Например: амфотерность а-аминокислот обусловлена наличием в молекуле функциональных групп кислотного (СООН) и основного (NH2) характера. Поэтому они образуют соли как со щелочами, так и с кислотами.
Кето-енольная таутомерия Таутомерия (динамическая изомерия) –это подвижное равновесие между взаимопревращающимися структурными изомерами. Таутомеры существуют совместно в одном и том же образце вещества и постоянно переходят друг в друга. Чаще всего встречается прототропная таутомерия, которая состоит во взаимопревращении таутомеров с переносом протона. Ацетоуксусному эфиру присуща кето-енольная таутомерия-одна из разновидностей прототропной таутомерии. В равновесной смеси при температуре 250 С содержится 92,5% кетонной и 7,5% енольной форм.
|
||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 2245; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.24.98 (0.007 с.) |




 С= С Двойная связь
С= С Двойная связь О
О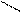
 С Альдегидная группа
С Альдегидная группа
 С=О Кетогруппа
С=О Кетогруппа

 С=С -СООН
-ОН -NН2
-ОН -СООН
-NН2 -СООН
С=С -СООН
-ОН -NН2
-ОН -СООН
-NН2 -СООН

 С=О -СООН
С=О -СООН
 О ацетамид, проявляет нейтральный характер и не реагирует с
О ацетамид, проявляет нейтральный характер и не реагирует с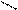 СН3 -- С разбавленными минеральными кислотами
СН3 -- С разбавленными минеральными кислотами
 НСI,Н2О + -
НСI,Н2О + -

 Н 2N-С-NН2 Н2 N-С-NН2 СI
Н 2N-С-NН2 Н2 N-С-NН2 СI


