
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Коллигативные свойства разбавленных растворовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Понижение давления пара, повышение температуры кипения, понижение температуры замерзания, осмотическое давление называют коллигативными свойствами раствора, т.е. связанными друг с другом, поскольку они обусловлены общими причинами и зависят главным образом от числа растворенных частиц. Растворы многими свойствами отличаются от чистых растворителей. Давление пара растворителя над раствором ниже, чем над чистым растворителем. Относительное понижение давления насыщенного пара растворителя над раствором пропорционально молярной доле растворенного нелетучего неэлектролита (закон Рауля). Математически закон Рауля можно представить так:
где Δ р – понижение давления пара над раствором; x – молярная доля растворенного вещества; Кр – константа Рауля, Па, Кр = Δ р при x = 1. Растворенное вещество, занимая часть объема раствора, понижает концентрацию частиц растворителя и соответственно этому уменьшает число их, переходящих в пар. Следствием закона являются два свойства растворов: температура замерзания растворов ниже, а температура кипения их (если растворенное вещество нелетучее) выше, чем у чистых растворителей, причем повышение температуры кипения Δ Тк и понижение температуры замерзания Δ Тз растворов неэлектролитов прямо пропорциональны их моляльной концентрации растворов
где b (X) – моляльная концентрация, моль/кг; Кэ и Кз – коэффициенты пропорциональности, кг·К·моль-1; которые называются соответственно эбулиометрической (определение величины, на которую повышается температура кипения растворов, называется эбулиометрией (эбулио – кипение)) и криометрической (определение величины понижения температуры замерзания, т.е. разности между температурами замерзания чистого растворителя и раствора, называется криометрией (криос – холод)) константами. Измерение температур кипения и замерзания растворов лежит в основе эбулиометрического и криометрического методов определения молярных масс веществ. Молярные масс (моль/кг) растворенных веществ-неэлектролитов могут быть рассчитаны по следующим формулам:
где mрв – масса растворенного вещества, г; mр-ль – масса растворителя, г.
Осмос Весьма важным в биологическом отношении свойством растворов является осмос. В природе часто растворы отделяются от растворителя мембранами, проницаемыми лишь для частиц растворителя. В этом случае растворенное вещество диффундировать в растворитель не может, и будет наблюдаться только переход растворителя в раствор, т.е. растворитель будет перемещаться в обоих направлениях, но все же в раствор будет переходить его больше, чем в обратном направлении.
Осмосом называют преимущественно одностороннее проникновение молекул растворителя (диффузию) через полупроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией.
Для возникновения осмоса необходимо растворы разных концентраций привести в соприкосновение через полупроницаемую мембрану (проницаемую только для растворителя).
В результате осмоса увеличивается объем раствора, и его концентрация постепенно снижается; проникающий через мембрану в раствор растворитель увеличивает столб жидкости h и, следовательно, повышает гидростатическое давление. Одновременно будет возрастать число молекул растворителя, перемещающихся через мембрану в обратном направлении, т.е. из раствора в растворитель. Постепенно гидростатическое давление и разбавление раствора достигнут величин, при которых количество молекул растворителя, перемещающихся в обоих направлениях, уравняется и наступит осмотическое равновесие. Развившееся в результате осмоса избыточное гидростатическое давление, измеряемое столбом раствора высотой h, при котором устанавливается осмотическое равновесие, называют осмотическим давлением. Осмотическим давлением называют величину, измеряемую минимальным гидравлическим давлением, которое нужно приложить к раствору, чтобы осмос прекратился.
Законы осмотического давления. Изучение законов осмотического давления выявило их полную аналогию с газовыми законами. 1) При постоянной температуре осмотическое давление прямо пропорционально молярной концентрации растворенного вещества (аналогия с законом Бойля-Мариотта):
2) При постоянной молярной концентрации осмотическое давление прямо пропорционально абсолютной температуре (аналогия с законом Гей-Люссака):
3) Вант-Гоффом был предложен объединенный закон для осмотического давления в растворах (аналогично объединенному закону Менделеева-Клайперона): Осмотическое давление разбавленных растворов неэлектролитов прямо пропорционально молярной концентрации, коэффициенту пропорциональности и абсолютной температуре:
где π – осмотическое давление, кПа; С (X) – молярная концентрация, моль/л,
Осмос имеет большое значение для растительных и животных организмов, способствуя достаточному оводнению клеток и межклеточных структур. Возникающее при этом осмотическое давление обуславливает тургор клеток, т.е. их своеобразную упругость, способствуя тем самым поддержанию эластичности тканей, сохранению определенной формы организма и т.п. Каждая живая клетка имеет оболочку или поверхностный слой протоплазмы, обладающие свойством полупроницаемости. Так, оболочка эритроцитов непроницаема для ряда катионов (например, для К+ и Na+), хотя она свободно пропускает анионы и воду. Помещая животные или растительные клетки в дистиллированную воду, можно наблюдать перемещение воды внутрь клеток, что ведет к их набуханию, а затем к разрыву оболочек и вытеканию клеточного содержимого. Если в таком опыте использовать эритроциты, то вода окрасится в гемоглобином в красный цвет. Подобное разрушение клеток путем разрыва их оболочек (или поверхностных слоек протоплазмы) называют лизисом, а в случае эритроцитов – гемолизом. В крепких растворах солей отмечается, наоборот, сморщивание клеток (плазмолиз), обусловленное потерей воды, перемещающейся из них в более концентрированный внешний раствор. Растворы солей с осмотическим давлением, равным осмотическому давлению раствора, взятого за стандарт, называются изотоническими (изос – по-гречески равный). Растворы с осмотическим давлением более высоким, чем в стандарте, называются гипертоническими, с меньшим давлением – гипотоническими.
Изучение разбавленных растворов неэлектролитов показало, что коллигативные свойства – понижение давления пара Δ p, изменение температур замерзания Δ Тз и кипения Δ Тк, осмотическое давление π – изменяются пропорционально количеству растворенного неэлектролита (объединенный закон Рауля – Вант-Гоффа). Изменение коллигативных свойств растворов электролитов превышает значения, рассчитываемые по закону Рауля для растворов неэлектролитов той же концентрации. Чтобы согласовать количественное описание коллигативных свойств электролитови законы идеальных растворов, Вант-Гофф ввел поправочный коэффициент i, называемый изотоническим коэффициентом Вант-Гоффа
Итак, для растворов электролитов формулы принимают следующий вид:
Вопросы:
1.Что называют растворами? 2.Значение растворов в жизнедеятельности организмов? 1. Вода как растворитель. 2. Классификация растворов: растворы электролитов, неэлектролитов, растворы амфолитов, растворы полиэлектролитов. 3. Концентрация растворов и способы ее выражения. 4. Диффузия в растворах. Закон Фика. Уравнение Эйнштейна-Смолуховского. Факторы, влияющие на скорость диффузии. Роль диффузии в процессах переноса веществ в биологических системам. 5. Коллигативные свойства разбавленных растворов электролитов. Закон Рауля и следствия из него: понижение температуры замерзания растворителя, повышение температуры кипения, осмос. 6. Осмос. Осмотическое давление. Закон Вант-Гоффа. 7. Гипо-, гипер- и изотонические растворы. Изотонический коэффициент. 8. Роль осмоса в биологических системах. Плазмолиз и лизис. Литература 3. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др. Под ред. Ю.А. Ершова. – М.: Высш. шк., 1993. 4. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: учеб. Пособие для студентов мед. спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; под ред. Ю.А. Ершова, В.А. Попкова. – М.: Высш. шк., 1993. Лабораторная работа
|
||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 1162; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.138.2 (0.007 с.) |

 ,
, ,
, ,
, ,
, ,
, Одностороннее перемещение растворителя через мембрану можно объяснить тем, что с поверхности мембраны снизу соприкасается больше молекул растворителя, чем сверху, где часть объема занята молекулами растворенного вещества, не проникающего через нее. Поэтому в единицу времени вверх будет переходить больше молекул растворителя, чем в обратном направлении.
Одностороннее перемещение растворителя через мембрану можно объяснить тем, что с поверхности мембраны снизу соприкасается больше молекул растворителя, чем сверху, где часть объема занята молекулами растворенного вещества, не проникающего через нее. Поэтому в единицу времени вверх будет переходить больше молекул растворителя, чем в обратном направлении. .
. .
. ,
, , где n – число молей неэлектролита, V – объем раствора; R – универсальная газовая постоянная, равная 8,31 кПа×л/(моль·К); Т – абсолютная температура, К.
, где n – число молей неэлектролита, V – объем раствора; R – универсальная газовая постоянная, равная 8,31 кПа×л/(моль·К); Т – абсолютная температура, К. или
или  .
. .
. ;
; 
 ;
;  ;
;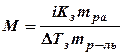 ;
;  .
.


