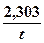Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Причины несовпадения молекулярности и порядкаСодержание книги
Поиск на нашем сайте
1) Постоянство концентрации одного или нескольких участников реакции.
[H2O] = const, следовательно, 2) Ступенчатый характер реакции (например, хлорирование NО):
1) стадия: 2) стадия:
Бимолекулярные и тримолекулярные реакции, в которых изменяется концентрация только одного реагирующего вещества при практически постоянной концентрации других, протекают по типу мономолекулярной и называются псевдомономолекулярными. КАТАЛИЗ
Вещество, изменяющее скорость химической реакции и остающееся после реакции в неизменном состоянии и количестве, называется катализатором. Катализ – изменение скорости химической реакции в присутствии катализаторов. Если от добавления катализатора к реагирующей смеси скорость химической реакции увеличивается, катализ называется положительным, если же реакция замедляется, то катализ называют отрицательным. Если ускорение реакции вызывается катализатором, образующимся в ходе химического процесса, то реакция называется аутокаталитической, а само явление – аутокатализом. Различные каталитические реакции подразделяются на реакции гомогенного и гетерогенного катализа. Гомогенный катализ протекает в одной фазе, когда реагирующие вещества и сам катализатор образуют газообразную или жидкую гомогенную (однородную) систему. Гетерогенный катализ протекает на границе раздела фаз, образуемых катализатором и реагирующими веществами, т.е. реакция идет на поверхности катализатора.
Ферментативный катализ Ферментами называют биологические катализаторы, которые являются продуктами жизнедеятельности живых организмов. По своей активности биологические катализаторы в миллионы раз превосходят активность химических катализаторов. Присутствие ферментов в ничтожно малых количествах способно расщеплять огромные количества реагирующих веществ. Так, 1 г кристаллического пепсина расщепляет 50 кг коагулированного яичного белка. В отличие от химических катализаторов ферменты обладают значительно большей специфичностью: каждый из них действует лишь на строго определенную реакцию или группу реакций, протекающих в организме. В отличие от неорганических катализаторов, фермент в процессе протекания каталитической реакции постепенно разрушается и утрачивает свою активность. Это явление получило название инактивации. По сравнению с неорганическими катализаторами ферменты имеют значительно более сложное строение. Каждый фермент содержит белок, которым и обусловлена высокая специфичность биологических катализаторов. По своему строению ферменты подразделяются на два больших класса: однокомпонентные и двухкомпонентные. Однокомпонентные состоят только из белковых тел, которые обладают каталитическими свойствами. К двухкомпонентным относятся такие ферменты, такие ферменты, которые состоят из белковой и небелковой части, называемой простетической группой или коферметном. Выполнение практической части
Лабораторная работа Определение константы скорости реакции окисления
Реакция протекает по уравнению:
Иодистоводородную кислоту получают действием серной кислоты на KI:
Скорость реакции между H2O2 и HI зависит только от концентрации перекиси водорода. Ход работы:
В колбу емкостью 200 мл вливают 100 мл 0,4% раствора KI и 5 мл 2Н раствора H2SO4. В колбу прибавляют из бюретки 1 мл 0,05 Н раствора Na2S2O3, затем 5 капель 0,5% раствора крахмала и 10 мл 0,05 Н раствора Н2О2. Тщательно перемешиваем раствор и по секундомеру (или часам) отмечаем в таблице момент первого появления голубого окрашивания (t0). Быстро прибавляют из бюретки еще 1 мл 0,05 Н раствора Na2S2O3 (перемешивают, вследствие чего голубое окрашивание исчезает) и вновь отмечают появление голубого окрашивания (t1) и т.д., повторив эти операции 4-5 раз. Промежутки времени t1, t2 и т.д. отсчитывают от момента первого появления окрашивания (t0), принимаемого за начало опыта. Таким образом, в начальный момент опыта (t0) содержится (А – 1) мл 0,05 Н раствора H2O2 и, следовательно, a = A – 1. К моменту второго появления окрашивания (t1) прореагирует еще 1 мл 0,05 Н раствора Н2О2, следовательно, x = 1, к моменту третьего появления окрашивания x = 2 и т.д. Константу скорости вычисляем по уравнению:
где k – константа скорости; a – исходное количество вещества; х – количество вещества за промежуток времени t; (а – х) – количество вещества, оставшееся к концу времени t. Отношение количеств вещества под логарифмом можно заменить пропорциональным ему отношением объемов раствора.
Результаты работы записываем в таблицу:
Материальное оснащение занятия: 2. приборы и оборудование: колбы, цилиндры, пробирки, бюретки 3. реактивы: 0,4% KI, 2H H2SO4, 0,5% раствор крахмала, 0,05 Н Na2S2O3, 0,05 H H2O2
Вопросы:
1. Предмет химической кинетики. 2. Что понимают под скоростью химической реакции? 3. В чем различие гомогенных и гетерогенных химических процессов? 4. Как выражается средняя и истинная скорость химических реакций? 5. Какие факторы влияют на скорость химической реакции? 6. Закон действия масс. 7. Что такое константа скорости химической реакции? От каких факторов она зависит? 8. Как скорость химической реакции зависит от температуры? Сформулируйте правило Вант-Гоффа. Уравнение Аррениуса. 9. Порядок и молекулярность реакции. 10. Какое явление называется катализом? Что такое катализатор? 11. Чем отличается гетерогенный катализ от гомогенного? В чем особенности ферментативного катализа?
ЛИТЕРАТУРА:
1. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др. Под ред. Ю.А. Ершова. – М.: Высш. шк., 1993. 2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: учеб. Пособие для студентов мед. спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; под ред. Ю.А. Ершова, В.А. Попкова. – М.: Высш. шк., 1993.
Лабораторная работа «ХИМИЧЕСКАЯ КИНЕТИКА. КАТАЛИЗ» Лабораторная работа 1. Исследование зависимости скорости реакции разложения тиосульфата натрия от концентрации. Цель. Приобрести навыки исследования кинетики химических реакций. Оборудование и реактивы. Бюретки вместимостью 25-30 мл (3 шт.) или мерные цилиндры (50 мл), пробирки одинакового размера (диаметра) в штативе (10 шт), термостат, секундомер, растворы натрия тиосульфата (0, 1 М) и серной кислоты с концентрацией 1 моль/л, вода дистиллированная. Сущность работы. Зависимость скорости реакции от концентрации реагирующих веществ можно изучить на примере реакции взаимодействия раствора тиосульфата натрия и серной кислоты
при различных концентрациях тиосульфата натрия. Скорость реакции измеряется временем от начала сливания растворов до появления во всех опытах одинаковой плотности суспензии серы. Чем меньше концентрация раствора тиосульфата натрия, тем больше будет этот промежуток времени (меньше скорость реакции). Выполнение эксперимента (Растворы Na2S2O3 и Н2SО4 отмерять разными цилиндрами). А. В колбу отмерить 1 0 мл 0, 1 М раствора Na2S2O3 и 20 мл воды. К раствору Na2S2O3 добавить 10 мл 1 М раствора Н2SО4 и сразу же начать отсчет времени по секундомеру с момента перемешивания растворов до начала помутнения — τ 1. Б. В колбу отмерить 20 мл 0,1 М раствора Na2S2O3 и 10 мл дистиллированной воды. Добавить 10 мл 1 М раствора Н2SО4 и отметить время начала помутнения — τ 2. В. В колбу отмерить 30 мл 0, 1 М раствора Na2S2O3 и добавить 1 0 мл 1 М раствора Н2SО4 . Отметить время появления суспензии серы — τ 3. По данным опытов рассчитать концентрацию и величины, пропорциональные скорости реакции. Результаты записать в таблицу по форме:
Построить график зависимости скорости реакции от концентрации Na2S2O3, откладывая на оси абсцисс концентрацию Na2S2O3, а на оси ординат — величину, пропорциональную скорости. На основании полученного графика сделать вывод о влиянии концентрации на скорость реакции. Написать уравнение реакции и математическое выражение закона действующих масс. Лабораторная работа 2. Исследование зависимости скорости реакции разложения тиосульфата натрия от температуры Цель. Приобрести навыки изучения зависимости химических реакций от температуры. Оборудование и реактивы. Бюретки вместимостью 25-30 мл (3 шт.) или мерные цилиндры (50 мл), пробирки одинакового размера (диаметра) в штативе (10 шт), термостат, термометр, секундомер, растворы натрия тиосульфата (0,1 М) и серной кислоты с концентрацией 1 моль/л, вода дистиллированная. Сущность работы. Зависимость скорости реакции от температуры можно изучить на примере реакции взаимодействия раствора тиосульфата натрия и серной кислоты.
при различных температурах. Скорость реакции измеряется временем от начала сливания растворов до появления во всех опытах одинаковой плотности суспензии серы. Чем меньше температура взаимодействующих растворов тиосульфата натрия и серной кислоты, тем больше будет этот промежуток времени (меньше скорость реакции). Желательно начать опыты с невысоких температур и постепенно повышать температуру на 10°. Выполнение эксперимента А. Налить в одну пробирку 5 мл раствора Na2S2O3, а в другую — 5 мл раствора Н2SО4. Поместить обе пробирки и термометр в стакан с водой комнатной температуры и через 5 мин записать в таблицу показания термометра - t 1.Не вынимая пробирку с тиосульфатом натрия из стакана с водой, добавить в нее содержимое пробирки с Н2SО4 и начать отсчет времени по секундомеру с момента перемешивания до появления опалесценции (легкого помутнения). Записать время протекания реакции при данной температуре—τ1. Б. В две другие пробирки налить такие же объемы растворов Na2S2O3 и Н2SО4. Поместить пробирки и термометр в стакан с водой. Стакан поставить на асбестовую сетку и нагреть воду до температуры на 10° выше комнатной. Затем проделать опыт так же, как и в первом случае, и отметить время по секундомеру — τ 2. В. Точно так же поступить с третьей парой пробирок, повысив температуру воды еще на 10°. Записать время по секундомеру — τ3.Результаты опытов записать в таблицу по форме:
Рассчитать температурный коэффициент скорости реакции γ: γ 1= τ1/ τ2; γ2 = τ2/ τ3; γ3 = (γ 1+ γ 2)/ 2. Сделать вывод о влиянии температуры на скорость реакции. Энергию активации рассчитать по уравнению Аррениуса: Еа= 2,3 lg γ(Т2Т1)/ (Т2- Т1) для температур Т1и Т2, Т2 и Т3, а также среднюю Еа. Лабораторная работа 3. Влияние поверхности реагирующих веществ на скорость реакции в гетерогенной системе. Цель. Изучить влияние скорости химической реакции от площади поверхности реагентов. Оборудование и реактивы. Технохимические весы, пробирки, секундомер, кусок мрамора, порошок мела или мрамора, разбавленный раствор соляной кислоты. Выполнение эксперимента Уравновесить на технохимических весах кусочек мрамора (или мела) и такую же массу порошка мрамора (или мела) — приблизительно 0,5 г. В две пробирки налить по 5 мл разбавленной соляной кислоты и внести в них одновременно навески мрамора или мела: кусочек — в одну пробирку, порошок — в другую. Отметить время, которое потребуется для полного растворения мрамора (мела). В какой пробирке реакция протекает быстрее и почему? Написать уравнение реакции и математическое выражение закона действующих масс. Сделать вывод о влиянии поверхности реагирующих веществ на скорость реакции, протекающей в гетерогенной системе. Лабораторная работа 4. Влияние активности катализатора на скорость химической реакции. Цель. Определение каталитической активности различных катализаторов. Оборудование и реактивы. Пробирки, волюмометр, секундомер, колбы с отростком, ампулы (2-3 мл), диоксид марганца, диоксид свинца, растворы: перманганата калия (ОДМ), щавелевой кислоты (5%-ный), бромида калия (2М), пероксида водорода (30%-ный), сульфата марганца (2М), дихромата калия (5%-ный), аммиака (10%-ный). Выполнение эксперимента Разложение пероксида водорода В две пробирки внести по 10 капель 30% -ного раствора пероксида водорода НД. В одну пробирку добавить немного диоксида марганца МпО2, а в другую — столько же диоксида свинца РЬ02. О скорости разложения Н2О2 судят по интенсивности выделения пузырьков газа. Как доказать, что в обеих пробирках выделяется кислород? Написать уравнение реакции разложения пероксида водорода.
Занятие № 7
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 790; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.138.214 (0.008 с.) |


 , т.е. реакция бимолекулярная, но первого порядка.
, т.е. реакция бимолекулярная, но первого порядка.  – суммарно
– суммарно – быстро
– быстро – медленно
– медленно – второго порядка, но тримолекулярная.
– второго порядка, но тримолекулярная.

 .
.

 или
или