
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Осмотические свойства растворовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Опыт 1. Наблюдение явлений гемолиза и плазмолиза эритроцитов. Цель. Изучить влияние концентрации веществ в окружающей среде на состояние эритроцитов и объяснить его, применяя понятие об осмотическом давлении. Оборудование. Микроскоп, штатив с пробирками, микропипетки, вместимостью5 и 1 мл, предметные и покровные стекла. Реактивы. Донорская кровь, водные растворы хлорида натрия с массовыми долями 0,25; 0,9 и 4%. Выполнение эксперимента В 3 пробирки вносят пипеткой по 3 мл трех растворов хлорида натрия различной концентрации. В каждую пробирку добавляют микропипеткой по 0,5 мл крови. Перемешивают стеклянной палочкой. По одной капле каждой смеси наносят палочкой на предметные стекла, закрывают покровными стеклами и изучают препараты под микроскопом. Зарисовывают форму эритроцитов в каждом случае. Рассчитывают осмотическое давление примененных в работе растворов хлорида натрия при температуре опыта, и объясняют на основании полученных результатов наблюдаемые явления гемолиза и плазмолиза эритроцитов. Опыт 2. Древовидные образования. Ряд пробирок наполняют разбавленным в 8 раз жидким стеклом Na2SiO3 или силикатным клеем и опускают в пробирки кристаллики соли. Лучше всего для этой цели подходят хлориды, бромиды или нитраты железа, меди, марганца, никеля, кобальта и т.д. Через некоторое время из кристаллов вырастают древовидные образования. Объясните наблюдаемое явление, сделайте выводы.
Вопросы к опытам:
1. В каком растворе наблюдалось осмотическое равновесие между эритроцитами и средой? 2. Зависит ли осмотическое давление от природы растворенного вещества? 3. Можно ли оценить осмотическое давление раствора по температуре его замерзания (кипения)? 4. Почему в 4 % - м растворе хлорида натрия эритроциты не наблюдались?
Занятие № 4 СВОЙСТВА БУФЕРНЫХ РАСТВОРОВ
Цель: Приобрести навыки в приготовлении буферных смесей с определенным значением рН; изучить некоторые свойства буферных растворов.
Научно-методическое обоснование темы:
Студент должен знать: а) Определение и классификацию буферных систем б).Основные буферные системы живых организмов в) Определение буферной емкости
Студент должен уметь: а) Объяснять механизм действия буферных смесей б) Уметь выводить уравнение Гендерсона-Гассельбаха для буферных смесей I и II типа в) Готовить буферные системы с заданным значением рН г) Практически определять буферную емкость смеси Теоретическая часть:
Значительную роль в поддержании постоянства рН биологических жидкостей, тканей и органов (кислотно-основного гомеостаза биосистем) и лабораторной диагностике играют буферные растворы.
Буферные растворы – это растворы, рН которых меняется незначительно при разбавлении или при добавлении небольших количеств кислоты или щелочи.
В водных буферных растворах основными компонентами являются донор и акцептор протонов, представляющие собой сопряженную кислотно-основную пару.
Сопряженные кислотно-основные пары В/ВН+ и А–/НА называют буферными системами.
Буферные системы по составу бывают двух основных типов: 1. Слабая кислота (донор протонов) и ее соль (акцептор протонов, сопряженное основание), образованная сильным основанием. Например, ацетатный буфер СН3СООН + СН3СООNa. 2. Слабое основание (акцептор протонов) е его соль (донор протонов), образованная сильной кислотой. Например, аммиачный буфер NH4OH + NH4Cl.
Расчет рН буферных систем
Каждая из буферных смесей характеризуется определенной концентрацией водородных ионов, которую буферная система и стремиться сохранять при добавлении кислот или щелочей. Рассмотрим на примере ацетатной буферной смеси, что же определяет ее рН.
Из приведенной схемы видно, что в ацетатном буферном растворе концентрация водородных ионов будет зависеть от степени диссоциации молекул кислоты. Согласно закону действия масс константа диссоциации уксусной кислоты будет
откуда
Это равенство справедливо для раствора, в котором содержится только одна уксусная кислота. Добавление к раствору уксусной кислоты ацетата натрия подавляет ее диссоциацию (принцип Ле Шателье), в результате чего концентрацию молекул недиссоциированной СН3СООН можно без больших погрешностей принять равной общей концентрации кислоты, т.е. [СН3СООН] = Скислота. (2) Учитывая, что соль СН3СООNa как сильный электролит в водном растворе диссоциирована полностью, можно принять, что общая концентрация аниона СН3СОО– практически равна аналитической концентрации соли в данной буферной смеси, т.е. [СН3СОО–] = Ссоль. (3) Подставляя значения (2) и (3) в уравнение константы диссоциации (1), получим:
Взяв обратный логарифм от обеих частей этого уравнения и обозначив
или
В общем случае для любого буфера уравнение (4) принимает следующий вид:
и носит название уравнения Гендерсона-Гассельбаха.
Для щелочного буфера, каким является, например, аммиачный, соответственно будет:
и
Из приведенных уравнений видно, что рН буферных смесей зависит от константы диссоциации кислоты или основания и от соотношения концентрации компонентов буферных смесей.
Механизм буферного действия При разбавлении буферных растворов концентрации обоих компонентов смеси уменьшаются в одинаковое число раз. Следовательно, исходя из уравнения Гендерсона-Гассельбаха, величина рН буферных растворов при этом не должна изменяться.
Ацетатная буферная система. Рассмотрим механизм буферного действия:
При добавлении соляной кислоты к ацетатному буферу происходит взаимодействие с одним из компонентов смеси (СН3СООН):
Как видно из уравнения (I), сильная кислота заменяется эквивалентным количеством слабой кислоты (в данном случае HCl заменяется CH3COOH). В соответствии с законом разведения Оствальда повышение концентрации уксусной кислоты понижает степень ее диссоциации, а в результате этого концентрация ионов Н+ в буфере увеличивается незначительно. При добавлении к буферному раствору щелочи концентрация водородных ионов и рН изменяется также незначительно. Щелочь при этом будет реагировать с другим компонентом буфера (СН3СООН) по реакции нейтрализации:
В результате этого добавленная щелочь заменяется эквивалентным количеством слабоосновной слои, в меньшей степени влияющей на реакцию среды, чем NaOH. Поскольку в результате этой реакции уксусная кислота расходуется, можно было бы ожидать значительного снижения содержания ионов Н+. Однако вместо прореагировавших ионов кислоты Н+ и СН3СОО– за счет потенциальной кислотности образуются новые ионы Н+ и СН3СОО–, и активная кислотность смеси (рН) почти не меняется.
Аммонийная буферная система Этот буфер содержит слабое основание (К = 1,87·10–5) и его аммонийную соль, образованную сильной кислотой, которая диссоциирует полностью:
Механизм действия аммонийного буфера заключается в том, что при добавлении к буферу сильной кислоты происходит реакция нейтрализации и кислота заменяется эквивалентным количеством соли по уравнению
Щелочь, добавленная к буферу, взаимодействует с солью, в результате чего образуется слабое основание, и рН смеси мало изменяется:
Способность буферных систем стойко удерживать на определенном уровне концентрацию ионов водорода является ограниченной.
Величину, характеризующую способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочей, называют буферной емкостью системы.
Мерой буферной емкости служит обычно количество сильной кислоты или сильного основания, которое необходимо прибавлять к раствору буферной смеси, чтобы рН этого раствора изменилось на единицу. Математически буферная емкость определяется следующим образом. Буферная емкость по кислоте:
Буферная емкость по щелочи:
где Nкисл и Nосн – нормальные концентрации сильной кислоты и щелочи соответственно; Vкисл, Vоснов, V(БР) – соответственно объемы кислоты, основания и буферного раствора; ΔрН – изменение рН буферного раствора при добавлении сильной кислоты или щелочи.
В живом организме в результате метаболизма образуются большие количества кислых продуктов. Так, в организме человека за сутки образуется такое количество различных кислот, которое эквивалентно 20-30 л однонормальной сильной кислоты. Сохранение постоянства реакции внутри организма обеспечивается наличием в нем мощных буферных систем. В организме человека особенно большую роль играют белковый, гидрокарбонатный, гемоглобиновый и фосфатный буферы. В плазме крови наиболее значимы гидрокарбонатная и белковая буферные системы, слабые буферные кислоты которых находятся в равновесии в основном с натриевыми солями этих кислот. В клеточном секторе преимущественное значение имеют фосфатная и белковая (в эритроцитах – гемоглобиновая) буферные системы, при этом буферные основания представлены в основном калийными солями фосфорной кислоты и белков.
|
||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 1398; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.244.34 (0.007 с.) |


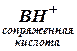




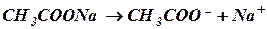
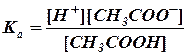 ,
, . (1)
. (1)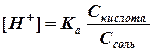 .
.
 . (4)
. (4)

 ,
,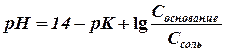 . (5)
. (5)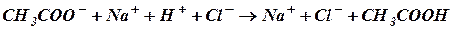 , (I)
, (I) . (II)
. (II)

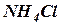
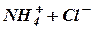

 .
.

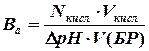 , моль/л
, моль/л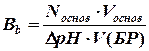 , моль/л
, моль/л


