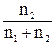Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Свойства разбавленных растворов неэлектролитовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Разбавленные растворы неэлектролитов обладают рядом свойств (коллигативные свойства), количественное выражение которых зависит только от числа находящихся в растворе частиц растворенного вещества и от количества растворителя. Некоторые коллигативные свойства растворов используются для определения молекулярной массы растворенного вещества. Зависимость этих свойств от концентрации выражается уравнениями: 1. Понижение давления пара растворителя над раствором, Δр (закон Рауля) р1 = N1p0; Δр = p0 – p1 = N2p0 = p0 Здесь p1 – парциальное давление насыщенного пара растворителя над раствором; p0 – давление насыщенного пара над чистым растворителем; N1 – мольная доля растворителя; N2 – мольная доля растворенного вещества; n1 – количество растворителя; n2 – количество растворенного вещества. 2. Понижение температуры кристаллизации раствора, Δtкрист Δtкрист = K·m. Здесь К – криоскопическая постоянная растворителя; m – моляльная концентрация растворенного вещества. 3. Повышение температуры кипения раствора, Δtкип Δtкип = Е·m. Здесь Е – эбуллиоскопическая постоянная растворителя. 4. Осмотическое давление, Р, кПа P = CмRT. Здесь Cм – молярная концентрация; R – газовая постоянная [8,31 Дж/(моль·К)]; Т – температура, К. Задания к разделу Свойства разбавленных растворов неэлектролитов* * - при решении задач этого раздела использовать данные таблицы 2 приложения. 161. Вычислите процентную концентрацию водного раствора сахара С12Н22О11, зная температуру кристаллизации раствора (–0,930С). 162. Вычислите процентную концентрацию водного раствора глицерина С3Н5(ОН)3, зная, что этот раствор кипит при 100,390С. 163. Вычислите температуру кипения 5%-ного раствора нафталина С10Н8 в бензоле. Температура кипения бензола 80,20С. 164. Вычислите процентную концентрацию водного раствора метанола СН3ОН, температура кристаллизации которого –2,790С. 165. Чему равно давление насыщенного пара над 10%-ным водным раствором карбамида CO(NH2)2 при температуре 1000С. 166. При какой приблизительно температуре будет кипеть 50%-ный (по массе) водный раствор сахарозы С12Н22О11? 167. При какой приблизительно температуре будет кристаллизоваться 40%-ный (по массе) водный раствор этилового спирта С2Н5ОН? 168. В каком отношении должны находиться массы воды и этилового спирта, чтобы при их смешении получить раствор, кристаллизующийся при – 200С? 169. В радиатор автомобиля налили 9 л воды и прибавили 2 л метилового спирта (ρ = 0,8 г/мл). При какой наинизшей температуре можно после этого оставлять автомобиль на открытом воздухе, не опасаясь, что вода в радиаторе замерзнет? 170. Водно-спиртовый раствор, содержащий 15% спирта (ρ = 0,97 г/мл), кристаллизуется при –10,260С. Найти молекулярную массу спирта и осмотическое давление раствора при 293 К. 171. Температура кипения водного раствора сахарозы С12Н22О11 равна 101,40С. Вычислить моляльную концентрацию и массовую долю сахарозы в растворе. При какой температуре замерзает этот раствор? 172. При какой температуре будет кристаллизоваться 14,6%-ный водный раствор сахара С12Н22О11? 173. Определить температуру кипения водного раствора глицерина с концентрацией 6,45%. 174. Раствор нафталина в бензоле кипит при температуре 81,250С. Температура кипения бензола 80,20С. Определить массовую долю нафталина в растворе. 175. Водный раствор метанола имеет концентрацию растворенного вещества 4,85%. При какой температуре будет кристаллизоваться данный раствор? 176. Водный раствор сахарозы С12Н22О11 кипит при 1010С. Какова массовая доля сахарозы в растворе? 177. Водный раствор этилового спирта кристаллизуется при температуре –270С. Какова процентная концентрация (по массе) этого раствора? 178. Смешаны вода и этиловый спирт в массовом соотношении 2:1. При какой температуре будет кристаллизоваться этот раствор? 179. Какой объем метилового спирта (ρ = 0,8 г/мл) нужно добавить к 9 л воды, чтобы полученный раствор не замерзал до –80С? 180. Определить температуру кристаллизации водно-спиртового раствора, плотность которого ρ = 0,97 г/мл, содержащего 15% спирта с относительной молекулярной массой 32.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 508; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.179.120 (0.006 с.) |