
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гальваническими элементами называют устройства, в которых энергия окислительно-восстановительных реакций преобразуется непосредственно в электрическую.Содержание книги
Поиск на нашем сайте
Методика рассмотрения работы гальванических элементов: 1. Составляют схему гальванического элемента. – Me1 / Me1n+ // Me2m+ / Me2 + 2. По уравнению Нернста находят потенциалы электродов. 3. Указывают движение электронов во внешней цепи: от электрода с меньшим потенциалом к электроду с более высоким потенциалом. 4. Записывают уравнения электродных процессов, определяют характер этих процессов. 5. Составляют суммарное уравнение окислительно-восстановительной реакции, протекающей в гальваническом элементе. 6. Рассчитывают величину ЭДС гальванического элемента как разность потенциалов положительного и отрицательного электродов.
Пример 1. Гальванический элемент с водородным электродом 1. Схема гальванического элемента Zn / ZnSO4 // H2SO4, H2 / Pt.
2. Электродные потенциалы
3. Направление движения электронов во внутренней цепи – от цинкового электрода к водородному, так как потенциал цинкового электрода меньше. ē
(а) Zn / ZnSO4 // H2SO4 / H2 (Pt) (к)
Zn (–): Zn – 2ē = Zn2+ - процесс окисления Pt (+): 2Н+ + 2ē = Н2↑ - процесс восстановления. 5. Суммарные уравнения: Zn + 2H+ = Zn2+ + H2↑; Zn + H2SO4 = ZnSO4 + H2↑. 6. Расчет величины ЭДС. ЭДС = Е0Ох – Е0Red = 0 – (–0,76) = 0,76 В. Пример 2. Концентрационный гальванический элемент Оба электрода из одного металла, но растворы солей, в которые погружены электроды, разной концентрации. 1. Схема гальванического элемента. Ni / NiSO4 (
2. Вычисление электродных потенциалов по уравнению Нернста.
3. Направление движения электронов по внешней цепи от Ni1 электрода к Ni2, так как
(а) Ni1 / NiSO4 (10-4 M)// NiSO4 (1 M)/ Ni2 (к)
4. Уравнения электродных полуреакций. Ni1 (–): Ni – 2ē = Ni2+ - процесс окисления; Ni2 (+): Ni2+ + 2ē = Ni - процесс восстановления. 5. Расчет величины ЭДС. ЭДС =
Пример 3. Гальванический элемент на основе окислительно-восстановительной реакции с инертным (С) электродом: K2Cr2O7 + Zn + H2SO4 = Cr2(SO4)3 + 3 ZnSO4 + K2SO4 + 7 H2O Ох Red 1. Схема гальванического элемента – Zn / Zn2+ (1М) // 2. Используем значения стандартных электродных потенциалов, так как концентрации ионов в растворе равны 1 моль/л.
3. Направление движения электронов – от цинкового электрода к угольному, так как
– Zn / Zn2+ // 4. Уравнения электродных процессов. Zn (–): Zn – 2ē = Zn2+ - процесс окисления С (+): 5. Суммарные уравнения. 3 Zn + 3 Zn + K2Cr2O7 + 7 H2SO4 = 3 ZnSO4 + Cr2(SO4)3 + 7 H2O + K2SO4 6. Расчет величины ЭДС. ЭДС = Е0Ох – Е0Red = 1,36 – (–0,76) = 2,12 В.
Задания к разделу Гальванические элементы Укажите направление движения электронов в гальваническом элементе, используя значения электродных потенциалов. Напишите уравнения анодного и катодного процессов, суммарное ионное и молекулярное уравнения реакции. Рассчитайте ЭДС; если концентрация раствора не указана, используйте значение стандартного потенциала (таблица 3 приложения). 241. Zn | Zn(NO3)2 ║ Fe2(SО4)3, 0,005 М | Fe 242. Co | CoSО4 ║ Al2(SО4)3, 0,005M | Al 243. Pb | Pb(NO3)2 ║ Сr2(SО4)3, 0,05M | Сr 244. Cu | CuSО4 ║ Fe2(SО4)3, 0,05 М | Fe 245. Pb | PbSО4 ║ Al2(SО4)3, 0,05M | Al 246. Fe | FeSО4 ║ Al2(SО4)3, 0,025M | Al 247. Zn | ZnSО4║ Сr2(SО4)3, 0,025M | Сr 248. Cd | Cd(NO3)2 ║ Fe2(SО4)3, 0,025 М | Fe 249. Mg | MgSО4 ║ Сr2(SО4)3, 0,005M | Сr 250. Ag | AgNO3 ║ Al2(SО4)3, 0,005M | Al 251. Ni | NiSО4 ║ Fe2(SО4)3, 0,5 М | Fe 252. Sn | SnSО4 ║ Al2(SО4)3, 0,5M | Al 253. Co | CoSО4║ Сr2(SО4)3, 0,025M | Сr 254. Cu | Cu(NO3)2 ║ Сr2(SО4)3, 0,025M | Сr 255. Pb | PbSО4 ║ Сr2(SО4)3, 0,05M | Сr 256. Zn | Zn(NO3)2 ║ Al2(SО4)3, 0,5M | Al 257. Mg | Mg(NO3)2 ║ Al2(SО4)3, 0,025M | Al 258. Zn | ZnSО4║ Fe2(SО4)3, 0,5 М | Fe 259. Ni | Ni(NO3)2 ║ Сr2(SО4)3, 0,5M | Сr 260. Co | Co(NO3)2 ║ Fe2(SО4)3, 0,025 М | Fe
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 856; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.254.81 (0.009 с.) |

 = 1 моль/л,
= 1 моль/л,  = 1 моль/л, Т = 298 К, Р = 101,3 кПа.
= 1 моль/л, Т = 298 К, Р = 101,3 кПа. = 0 В,
= 0 В,  = – 0,76 В (при
= – 0,76 В (при 

 (-) (+)
(-) (+)


 4. Уравнения электродных процессов.
4. Уравнения электродных процессов. = 10–4 моль/л) // NiSO4 (
= 10–4 моль/л) // NiSO4 ( = – 0,25 В.
= – 0,25 В. =
=  +
+ 
 = – 0,25 +
= – 0,25 +  =
=  .
. ē
ē
 (-) (+)
(-) (+)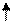
 , Cr3+ (1М) / С +
, Cr3+ (1М) / С + = – 0,76 В;
= – 0,76 В;  = 1,36 В.
= 1,36 В. .
.

 ē
ē


