
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электрохимическая коррозия металловСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Коррозией металлов называют самопроизвольное разрушение металлов под действием различных окислителей из окружающей среды. В реальных условиях коррозии обычно подвергаются технические металлы, содержащие примеси других металлов и неметаллических веществ. Механизм электрохимической коррозии в таких металлах аналогичен механизму процессов, протекающих в короткозамкнутых гальванических элементах, в которых на участках с более отрицательным потенциалом идет процесс окисления (разрушение металлов), а на участках с более положительным потенциалом процесс восстановления окислителя (коррозионной среды). Наиболее часто встречаются окислители (деполяризаторы): - ионы водорода (коррозия с водородной деполяризацией); уравнение восстановительного процесса: 2Н+ + 2ē = Н2 (в кислой среде), 2 H2O + 2ē = Н2 + 2OH– (в нейтральной и щелочной средах); - молекулы кислорода, растворенные в различных средах; уравнение восстановительного процесса: O2 + 4ē + 4Н+ = 2 H2O (в кислой среде); O2 + 4ē + 2 H2O = 4 OH– (в нейтральной и щелочной средах); Методика рассмотрения работы гальванопары при электрохимической коррозии. 1. Составляют схему гальванопары: Me1 / среда / Me2. 2. Выписывают стандартные потенциалы металлов и окислителей коррозионной среды (таблица 4 приложения), определяют восстановитель (меньший потенциал), окислитель (больший потенциал). 3. Записывают уравнения процессов окисления и восстановления и суммарное уравнение окислительно-восстановительной реакции, протекающей при гальванокоррозии. 4. Указывают направление движения электронов. Пример 1. Гальванопара алюминий – железо в воде (среда нейтральная). В воде растворен кислород. 1. Схема гальванопары: Al / Н2О, О2 / Fe 2. Потенциалы:
Восстановитель – Al, окислитель – О2.
Fe (+): 3 О2 + 4ē + 2 H2O = 4 OH– - процесс восстановления
4 Al + 3 О2 + 6 H2O = 4 Al(OН)3 4. Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом: ē
Пример 2. Определить процессы, протекающие при коррозии луженого железа (среда – влажный воздух, содержащий кислород, пары воды и ионы Н+), если нарушена сплошность покрытия. 1. Схема гальванопары Fe / Н2О, О2, Н+ / Sn 2. Потенциалы
Восстановитель – железо, окислитель – кислород.
Sn (+): 1 О2 + 4ē + 4 H+ = 2 H2O – процесс восстановления
2 Fe + О2 + 4 H+ = Fe2+ + 2 H2O При нарушении целостности покрытия будет разрушаться Fe. 4. Электроны движутся от участка с меньшим потенциалом к участку с большим потенциалом: ē
Пример 3. Рассмотреть коррозию детали из железа и алюминия в щелочной среде (КОН), если растворенный кислород отсутствует. 1. Схема гальванопары: Al / КОН / Fe 2. Потенциалы:
Восстановитель – алюминий, окислитель – вода.
Fe (+): 3 2 H2O + 2ē = 2 OH– + H2 – процесс восстановления
2 Al + 2 OH– + 2 H2O = 2 2 Al + 2 КОН + 2 H2O = 2 КAlO2 + 3 H2 Разрушается алюминий. 4. Направление перемещения электронов в системе: ē
Задание к разделу Электрохимическая коррозия металлов* Рассмотрите коррозию гальванопары, используя потенциалы (таблица 4 приложения), укажите анод и катод соответствующей гальванопары, рассчитайте ЭДС, напишите уравнения анодного и катодного процессов, молекулярное уравнение реакции коррозии, укажите направление перемещения электронов в системе. * - при решении задач этого раздела использовать таблицу 4 приложения.
ЭЛЕКТРОЛИЗ РАСТВОРОВ
|
|||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 657; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.113.71 (0.007 с.) |

 = – 1,88 В;
= – 1,88 В;  = – 0,46 В;
= – 0,46 В; = + 0,814 В.
= + 0,814 В. 3. Al (–): 4 Al – 3ē + 3 H2O = Al(OН)3 + 3 Н+ - процесс окисления
3. Al (–): 4 Al – 3ē + 3 H2O = Al(OН)3 + 3 Н+ - процесс окисления
 (–) Al / Fe (+) ē
(–) Al / Fe (+) ē О2, Н2О
О2, Н2О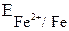 = – 0,44 В;
= – 0,44 В;  = – 0,46 В;
= – 0,46 В; = + 1,228 В.
= + 1,228 В. = – 2,36 В;
= – 2,36 В; 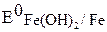 = – 0,874 В;
= – 0,874 В;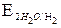 = – 0,827 В.
= – 0,827 В. 3. Al (–): 2 Al – 3ē + 4 OH– =
3. Al (–): 2 Al – 3ē + 4 OH– =  + 2 H2O – процесс окисления
+ 2 H2O – процесс окисления


