
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электролиз – это совокупность окислительно-восстановительных процессов, происходящих при прохождении электрического тока через электрохимическую систему, состоящую из двух электродов и электролита.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Электрод, на котором происходит восстановление, называется катодом, он заряжен отрицательно. Электрод, на котором происходит окисление, называется анодом, он заряжен положительно. При электролизе водных растворов протекают процессы, связанные с электролизом воды, т.е. растворителя. Катодные процессы На катоде возможно восстановление: - катионов металла Men+ + nē = Me; - катиона водорода (свободного или в составе молекул воды). 2Н++ 2ē = Н2↑ (в кислой среде); 2 H2O + 2ē = Н2 + OH– (в нейтральной и щелочной средах). Для выбора приоритетного процесса следует сравнить стандартные электродные потенциалы металла и водорода. Потенциал восстановления катионов водорода необходимо использовать с учетом перенапряжения, 1. Активные металлы (Li – Al) из-за низкой окислительной способности их ионов на катоде не осаждаются, вместо них идет восстановление ионов водорода. 2. Металлы средней активности (Mn, Zn, Sn) могут осаждаться на катоде с одновременным выделением водорода. 3. Неактивные металлы (стоящие в ряду напряжений после водорода) из-за высокой окислительной способности их ионов осаждаются на катоде без выделения водорода. Анодные процессы На аноде возможны процессы окисления: - материал анода Me – nē = Men+; - молекул воды 2 H2O – 4ē = О2↑ + 4Н+; - анионов солей 2 Cl– – 2ē = Cl2; Анионы кислородсодержащих кислот, имеющие в своем составе атом элемента в высшей степени окисления ( Пример 1. Электролиз водного раствора сульфата калия с инертными электродами: К2SO4 = 2 К+ +
Пример 2. Электролиз водного раствора хлорида олова с инертными электродами: SnCl2 = Sn2+ + 2Cl–
Пример 3. Электролиз сульфата меди с медным анодом: CuSО4 = Cu2+ +
Количественные соотношения при электролизе определяют в соответствии с законами, открытыми М. Фарадеем в 1834 г. Обобщенный закон Фарадея связывает количество вещества, образовавшегося при электролизе, со временем электролиза и силой тока: m = M где m – масса образовавшегося вещества, г; М – молярная масса вещества, г/моль; n – количество электронов, участвующих в электродном процессе; I – сила тока, А; t – время электролиза, с; F – постоянная Фарадея (96500 Кл/моль). Для газообразных веществ, выделяющихся при электролизе, формулу используют в виде V = V0 где V – объем газа, выделяющегося на электроде; V0 – объем 1 моль газообразного вещества при нормальных условиях (22,4 л/моль). Пример 4. Рассчитать массу олова и объем хлора при нормальных условиях, выделившихся при электролизе раствора хлорида олова с инертными электродами в течение 1 часа при силе тока 4 А. Решение: mSn = 118,7∙ Задание к разделу Электролиз Рассмотрите катодные и анодные процессы при электролизе водных растворов веществ с инертными электродами. Рассчитайте массу или (и) объем (при нормальных условиях для газов) продуктов, выделяющихся на электродах при пропускании через раствор в течение 1 часа тока силой 1 А:
S-ЭЛЕМЕНТЫ 301. Чем объясняется отсутствие гидролиза по катиону в водных растворах солей щелочных металлов? Какую среду имеют растворы NaHCO3 и почему значение рН для них имеет меньшее значение, чем для растворов Na2CO3 той же концентрации? 302. При помощи каких реакций можно осуществить следующие превращения: а) NaCl → NaOH → Na2CO3 → NaNO3 → NaNO2; б) NaCl → Na → Na2O2 → Na2O → Na2SO4. 303. Взаимодействием кальцинированной соды массой 10 т с гашеной известью получена каустическая сода массой 6,7 т. Определите выход продукта. 304. Какой объем СО2 при 170С и давлении 10,13·105 Па потребуется для получения кристаллической соды массой 143 кг из гидроксида натрия? 305. В дыхательном аппарате находится оксилит (прессованная в виде таблеток смесь порошков Na2O2 и КO2, взятых в эквимолярных количествах) массой 745 г. Вычислите объемы (н.у.) газов: а) поглощаемого СО2, б) выделяемого О2 при полном использовании оксилита. 306. Найдите массу гидроксида натрия, полученного электролизом хлорида натрия, взятого массой 1 т и содержащего 10% примесей. Выход по току составил 90%. 307. Электролизом хлорида натрия при силе тока 1050 А за 12 ч был выделен хлор объемом 4,48 м3 (н.у.). Найдите массу полученного при этом гидроксида натрия, если выход по току на аноде и катоде составляет одну и ту же величину. 308. Какой объем при 170С и давлении 12,156·105 Па займет СО2, который потребуется для насыщения раствора NaOH, объемом 5 л, концентрация которого 8 моль/л, с целью получения гидрокарбоната? 309. Чем объясняется увеличение термической устойчивости карбонатов от магния к барию? 310. Какой объем водорода, измеренного при 250С и давлении 755 мм.рт.ст. (100,7 кПа), выделится при взаимодействии с водой 1 г сплава, состоящего из 30% (масс.) калия и 70% (масс.) натрия? 311. При взаимодействии 10 г амальгамы натрия с водой получен раствор щелочи. Для нейтрализации этого раствора потребовалось 50 мл 0,5 н раствора кислоты. Определить процентное содержание натрия (по массе) в амальгаме. 312. Вычислить количество теплоты, которое выделится при 250С при взаимодействии 8 г гидрида натрия с водой. Стандартные энтальпии образования NaH и NaOH принять соответственно равными –56,4 и –425,6 кДж/моль. 313. Кусочек серебряной монеты массой 0,300 г растворили в азотной кислоте и осадили из полученного раствора серебро в виде AgCl. Масса осадка после промывания и высушивания оказалась равной 0,199 г. Сколько процентов серебра (по массе) содержалось в монете? 314. Из навески латуни массой 1,6645 г при анализе получено 1,3466 г Cu(SCN)2 и 0,0840 г SnO2. Вычислить массовую долю меди, олова и цинка в анализируемой пробе. 315. Произведение растворимости хромата бария 3,5·10-15. Какая масса этой соли содержится в ее насыщенном растворе объемом 100 мл? 316. Какая масса кальцинированной соды должна прореагировать с гашеной известью для получения каустической соды массой 6,7 т, если выход продукта составляет 88,74% 317. Чему равна концентрация ионов Ва2+ над осадком BaSO4, если концентрация сульфат-ионов в этом растворе составляет 10-2 моль/л? Был ли использован избыток серной кислоты при получении данного осадка? 318. При взаимодействии некоторого количества водородного соединения одновалентного металла со 100 г воды получился раствор с массовой долей вещества в нем 2,38%. Масса конечного раствора оказалась на 0,2 г меньше суммы масс воды и исходного водородного соединения. Определите, какое водородное соединение было взято. 319. При демонстрации опытов по изучению свойств щелочных металлов в стакан с 250 г воды небольшими порциями внесли 2,5 г лития. Определите массовую долю вещества в полученном растворе. Какой объем 10%-ной серной кислоты (ρ = 1,065) необходимо прилить к полученному раствору, чтобы сделать его нейтральным? 320. В трех пробирках находятся растворы соды, сульфатов алюминия и цинка. Как распознать эти вещества, не пользуясь другими реактивами?
ЖЕСТКОСТЬ ВОДЫ Жесткость воды обуславливается наличием в ней различных соединений кальция и магния. Термин жесткость стали применять в связи с тем, что соли кальция и магния образуют с мылами нерастворимые «жесткие» соединения. По качественному составу жесткость характеризуется следующим образом. Жесткость, создаваемая катионами кальция – кальциевая жесткость (ЖCa), катионами магния – магниевая жесткость (ЖMg). Гидрокарбонатные анионы ( Снижение жесткости или умягчение воды производят физическими методами (например, термическим), реагентным, катионированием. Термический метод основан либо на испарении воды с последующей дистилляцией пара (получают дистиллированную воду), либо просто нагреванием, при котором гидрокарбонаты переходят в карбонаты, растворимые гораздо хуже: t М(НСО3)2 → МСО3 + Н2О + СО2↑ Таким образом можно удалить только Жкарб. Остаточная жесткость зависит от растворимости образующихся карбонатов. Реагентные методы основаны на переводе солей кальция и магния в труднорастворимые (осаждение) или прочные комплексные соединения. В качестве осадителей используют известь Ca(OH)2, соду Na2CO3, соли фосфорной кислоты Na3PO4. В результате обработки воды осадителями образуются труднорастворимые соединения Mg(OH)2, CaCO3, Ca3(PO4)2, Mg3(PO4)2. Остаточная жесткость после реагентного умягчения определяется произведением растворимости образующихся соединений. Метод катионирования основан на способности некоторых соединений, практически нерастворимых в воде, вступать в реакции обмена с катионами, находящимися в воде. Такие соединения называют катионитами. Воду с определенной скоростью пропускают через катионит и происходит реакция обмена, например: 2NaR + Ca2+ = CaR2 + 2Na+ 2HR + Ca2+ = CaR2 + 2H+. В результате катионы кальция из воды удаляются, заменяясь на катионы натрия или водорода. После насыщения катионита катионами кальция и магния, катиониты регенерируют. В настоящее время жесткость принято выражать в градусах жесткости. За 10 жесткости принимают содержание в воде ионов Ca2+ и Mg2+, равное0,5·10-3 моль в литре воды. Пример 1. Вычислите жесткость воды, зная, что в 500 л ее содержится 202,5 г Са(НСО3)2. Решение. В одном литре воды содержится 202,5: 500 = 0,405 г Са(НСО3)2, что составляет 0,405: 162 = 2,5·10-3 моль Са(НСО3)2 или 2,5·10-3 моль. Таким образом, Ж = 2,5·10-3 / 0,5·10-3 = 50 Пример 2. Сколько граммов CaSO4 содержится в 1 м3 воды, если жесткость, обусловленная присутствием этой соли, равна 40? Решение. Молярная масса CaSO4 равна 136 г/моль. В 1 литре воды содержится 4·0,5·10-3 = 2·10-3 моль CaSO4, что составляет 2·10-3·136 = 2,72·10-1 г. В 1 м3 воды содержится 2,72·10-1·103 = 272 г CaSO4. Пример 3. Какую массу соды Na2CO3 надо добавить к 500 л воды, чтобы устранить ее жесткость, равную 50? Решение. Жесткость 10 соответствует 0,5·10-3 моль ионов Mе2+ (где Ме2+ ≡ Са2+ или Mg2+). По условию задачи содержание Mе2+ в 1 литре воды составляет 5·0,5·10-3 = 2,5·10-3 моль. В 500 л такой воды содержится 500·2,5·10-3 = 1,25 моль Mе2+. Устранение жесткости заключается в связывании ионов Mе2+ ионами Mе2+ + Согласно уравнению, число моль ионов
Задания к разделу Жесткость воды 321. Какую массу Na3PO4 надо прибавить к 500 л воды, чтобы устранить ее карбонатную жесткость, равную 50? 322. Какие соли обуславливают жесткость природной воды? Какую жесткость называют карбонатной, некарбонатной? Чему равна жесткость воды, в 100 л которой содержится 14,631 г гидрокарбоната магния? 323. Вычислите карбонатную жесткость воды, зная, что для реакции с гидрокарбонатом кальция, содержащемся в 200 см3 воды, требуется 15 см3 0,08н раствора HCl. 324. В 1 л воды содержится ионов магния 36,47 мг и ионов кальция 50,1 мг. Чему равна жесткость этой воды? 325. Какую массу карбоната натрия надо прибавить к 400 л воды, чтобы устранить жесткость, равную 30. 326. Вода, содержащая только сульфат магния, имеет жесткость 70. Какая масса сульфата магния содержится в 300 л этой воды? 327. Вычислите жесткость воды, зная, что в 600 л ее содержится 65,7 г гидрокарбоната магния и 61,2 г сульфата кальция. 328. В 220 л воды содержится 11 г сульфата магния. Чему равна жесткость этой воды? 329. Жесткость воды, в которой присутствует только гидрокарбонат кальция, равна 40. Какой объем 0,1н раствора HCl потребуется для реакции с гидрокарбонатом кальция, содержащимся в 75 см3 этой воды? 330. В 1м3 воды содержится 140 г сульфата магния. Вычислите жесткость этой воды. 331. Вода, содержащая только гидрокарбонат магния, имеет жесткость 3,50. Какая масса гидрокарбоната магния содержится в 200 л этой воды? 332. К 1 м3 жесткой воды прибавили 132,5 карбоната натрия. На сколько градусов понизилась жесткость? 333. Чему равна жесткость воды, если для ее устранения к 50 л воды необходимо прибавить 21,2 г карбоната натрия? 334. Какая масса CaSO4 содержится в 200 л воды, если жесткость, обуславливаемая этой солью, равна 80? 335. Вода, содержащая только гидрокарбонат кальция, имеет жесткость 90. Какая масса гидрокарбоната кальция содержится в 500 л воды? 336. Какие ионы надо удалить из природной воды, чтобы сделать ее мягкой? Введением каких ионов можно умягчить воду? Составьте уравнения соответствующих реакций. Какую массу Са(ОН)2 надо прибавить к 2,5 л воды, чтобы устранить ее жесткость, равную 4,430? 337. Какую массу карбоната натрия надо прибавить к 0,1 м3 воды, чтобы устранить ее жесткость, равную 40? 338. К 100 л жесткой воды прибавили 12,95 г гидроксида кальция. На сколько градусов понизилась карбонатная жесткость? 339. Чему равна карбонатная жесткость воды, если в 1 л ее содержится 0,292 г гидрокарбоната магния и 0,2025 г гидрокарбоната кальция? 340. Какую массу гидроксида кальция надо прибавить к 275 л воды, чтобы устранить ее карбонатную жесткость, равную 5,50? P-ЭЛЕМЕНТЫ 341. При гидролизе солей алюминия комплексный ион [Al(H2O)6]3+ ведет себя как слабая кислота. Покажите это уравнениями для трех ступеней гидролиза. 342. Если c (NH3·H2O) = 2 моль/л, то какой объем этого раствора был взят для осаждения Al(OH)3 из раствора (ρ = 1,3 г/мл) объемом 200 мл, в котором массовая доля AlCl3 составляет 30%? К полученному осадку до его полного растворения прибавлен раствор NaOH с концентрацией 0,5 моль/л. Найдите его объем. 343. Щавелевая кислота обесцвечивает подкисленный раствор KMnO4, окисляясь при этом до СО2. Ее раствор объемом 100 мл был приготовлен растворением кристаллогидрата Н2С2О4·2H2O массой 0,0630 г. На титрование 103 мл этого раствора был затрачен раствор KMnO4 объемом 8,3 мл. Вычислите молярную концентрацию эквивалента раствора KMnO4. 344. Какой объем раствора KMnO4 молярной концентрации эквивалента 0,1 моль/л потребуется для реакции с 10 мл раствора Н2С2О4·2H2O (ρ = 1,02 г/мл), в котором массовая доля кристаллогидрата составляет 7%? 345. Найдите объем раствора с массовой долей HNO3 20%, который потребуется для растворения «припоя», в котором массовые доли Sn и Pb соответственно равны 70 и 30%. Образец взят массой 100 г, а восстановление азотной кислоты приводит к выделению NO. 346. Вычислите Кд для реакции NH3·H2O ↔ 347. Все оксиды азота полностью реагируют с раскаленной медью, образуя оксид меди (II) и свободный азот. Какова формула оксида азота, если масса полученного CuO составила 0,7105 г и азот выделился объемом 200 мл (н.у.)? 348. Какой объем раствора нитрита натрия, молярная концентрация которого 0,15 моль/л, потребуется для реакции с 10 мл раствора KI (ρ = 1,12 г/мл), в котором массовая доля соли составляет 15%. В какой среде протекает эта реакция? Вычислите массу каждого из образующихся продуктов. 349. Какая масса PbO2 потребуется для окисления в присутствии серной кислоты нитрита натрия, находящегося в 200 мл 15 %-ного раствора (ρ = 1,12 г/мл)? 350. Найдите концентрацию молекул аммиака в растворе хлорида аммония, если c (NH4Сl) = 1 моль/л, а Кн ( 351. Вычислите концентрацию ионов Н+, образующихся за счет реакции 352. Вычислите молярную концентрацию раствора NH3 (ρ = 0,96 г/мл), в котором массовая доля NH3 составляет 10%. Сколько мл такого раствора потребуется для растворения хлорида серебра массой 7,16 г? 353. Найдите степень диссоциации HNО2 и значение рН в ее растворе, если c (HNО2) = 0,1 моль/л. 354. Растворимость H2S в воде при 200С характеризуется массовым отношением m (H2S) / m (H2O) = 4,47 г/1000г. По этим данным вычислите предельную молярную концентрацию раствора H2S при данной температуре, приняв ρ раствора равной 1. 355. Чему равна степень диссоциации α1 (H2S), [Н+] и рН в растворе H2S концентрации 0,1 моль/л? 356. Чему равен объем 40%-ного раствора H2SO4, который надо прибавить к 30%-ному олеуму массой 170 г для того, чтобы перевести его в 10%-ный? 357. Какой объем SO2 (н.у.) потребуется для полного обесцвечивания раствора KMnO4 объемом 250 мл, если его молярная концентрация эквивалента составляет 0,1 моль/л? 358. Вычислите концентрацию ионов водорода и рН для раствора хлорноватистой кислоты, концентрация которой равна 0,1 моль/л. 359. Газ, выделившийся при взаимодействии NaCl массой 5,85 г с концентрированной серной кислотой, пропущен через раствор AgNO3 (ρ = 1,1 г/мл) объемом 200 мл, в котором массовая доля соли равна 10%. Найдите массы образовавшегося при этом осадка и AgNO3, оставшегося в растворе. 360. Какая масса K2Cr2O7 потребуется, чтобы выделить из соляной кислоты хлор, необходимый для получения хлората калия массой 245 г?
D-ЭЛЕМЕНТЫ 361. Какой из гидроксидов проявляет более сильные основные свойства: а) Ti(OH)4 или Ti(OH)3, б) Ti(OH)4 или Zr(OH)4? Объясните. 362. При растворении VO и V2O3 в кислотах образуются соответственно аквакомплексы [V(H2O)6]2+ и [V(H2O)6]3+ зеленого цвета. Напишите уравнения этих реакций. Какой из ионов является очень сильным восстановителем? 363. Почему в водном растворе не может быть получен VCl4? 364. Какое из соединений Cr(OH)3, CrOHSO4 или [Cr(OH)2]2SO4 является преимущественным продуктом гидролиза Cr2(SO4)3? Объяснить. 365. Почему осадок гидроксида хрома (III) после растворения в избытке щелочи снова выпадает при разбавлении или кипячении раствора? 366. Какая масса нитрата серебра потребуется для осаждения хлорид-ионов из раствора [Cr(H2O)5Cl]Cl2 объемом 200 мл, если концентрация его равна 0,1 моль/л? 367. Какую массу CrO3 можно получить из К2Cr2O7 массой 147 г и какую массу этилового спирта можно окислить им до альдегида? 368. Какая масса хлорной извести потребуется для окисления сульфата хрома (III) массой 18 г? 369. Какой объем 3%-ного раствора Н2О2 (ρ = 1) потребуется для окисления КCr(SO4)2 в 0,5 л раствора, если концентрация соли 0,1 моль/л? 370. Какой объем раствора КОН с концентрацией 2 моль/л расходуется при взаимодействии Cl2 объемом 5,6 л (н.у.) с КCr(SO4)2? 371. Найдите объемы раствора КОН с концентрацией 2 моль/л и объем 3%-ного раствора Н2О2 (ρ = 1), которые потребуются для реакции с сульфатом хрома (III) массой 200 г? 372. Молярная концентрация эквивалента раствора К2Cr2O7 0,25 моль/л. Какой объем этого раствора надо взять для реакции с КI в подкисленном (какой кислотой?) растворе, содержащем иодид-ионы количеством вещества 0,01 моль? 373. Одинаковый ли продукт образуется при сплавлении MnO2 с Ca(OH)2 или смесью Ca(OH)2 и NaNO3? Покажите это уравнениями реакций. 374. Как можно из KMnO4 получить Mn2O7? Покажите свойства этого оксида уравнениями соответствующих реакций. 375. Найдите молярную концентрацию эквивалента для раствора перманганата калия по следующим данным: 20 мл раствора KMnO4 затрачено на титрование раствора щавелевой кислоты, взятого объемом 25 мл. Раствор кислоты был предварительно приготовлен в мерной колбе на 100 мл из навески Н2С2О4·2Н2О массой 0,0630 г. 376. Чему равна масса калийной селитры, которая расходуется на получение K2MnO4 из технического MnO2 массой 4,35 кг, содержащего примеси, массовая доля которых составляет 12%? 377. Черновая медь, в которой массовая доля примесей равна 4%, взята массой 1 т. Какая масса рафинированной меди может быть получена из нее, если выход по току составляет 92%? Где окажутся после электролиза серебро и железо, содержавшиеся в примеси? 378. Какую массу медного купороса можно получить из 1 т руды, в которой массовая доля медного колчедана CuFeS2 составляет 20%? 379. При обработке соляной кислотой 2г сплава меди с двухвалентным металлом выделился водород объемом 276 мл (н.у.). Оставшийся сплав растворился после нагревания с концентрированной серной кислотой, а на поглощение выделившегося при этом газа затрачен раствор NaОН объемом 18,75 мл с концентрацией 2 моль/л. Определите второй металл и его массовую долю в сплаве. 380. Какой объем воздуха расходуется при получении цинка массой 260 кг из цинковой обманки массой 1 т? Чему равна массовая доля сульфида цинка в используемой руде?
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ 381. Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях [Cu(NH3)4]SO4, K2[PtCl6], K[Ag(CN)2]. Напишите уравнения диссоциации этих соединений в водных растворах. 382. Составьте координационные формулы следующих комплексных соединений платины: PtCl4·6NH3, PtCl4·4NH3, PtCl4·2NH3. Координационное число платины (+4) равно шести. Напишите уравнения диссоциации этих соединений в водных растворах. Какое из них является комплексным неэлектролитом? 383. Составьте координационные формулы следующих комплексных соединений кобальта: CoCl3·6NH3, CoCl3·5NH3, CoCl3·4NH3. Координационное число кобальта (+3) равно шести. Напишите уравнения диссоциации этих соединений в водных растворах. 384. Определите, чему равны заряд комплексного иона, степень окисления и координационное число сурьмы в соединениях Rb[SbBr6], K[SbCl6], Ns[Sb(SO4)2]. Как диссоциируют эти соединения в водных растворах? 385. Составьте координационные формулы следующих комплексных соединений серебра: AgCl·2NH3, AgCN·KCN, AgNO2·NaNO2. Координационное число серебра (+1) равно двум. Напишите уравнения диссоциации этих соединений в водных растворах. 386. Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях K4[Fe(CN)6], K4[TiCl8], K2[HgI4]. Как диссоциируют эти соединения в водных растворах? 387. Из сочетания частиц Co3+, NH3, 388. Определите, чему равен заряд следующих комплексных ионов: [Cr(H2O)4Cl2], [HgBr4], [Fe(CN)6], если комплексообразователями являются Cr3+, Hg2+, Fe3+. Напишите формулы комплексных соединений, содержащих эти ионы. 389. Определите, чему равен заряд комплексных ионов: [Cr(NH3)5NO3], [Pd(NH3)Cl3], [Ni(CN)4], если если комплексообразователями являются Cr3+, Pd2+ и Ni2+. Напишите формулы комплексных соединений, содержащих эти ионы. 390. Из сочетания частиц Cr3+, H2O Cl– и K+ можно составить семь координационных формул комплексных соединений хрома, одна из которых [Cr(H2O)6]Cl3. Составьте формулы других шести соединений и напишите уравнения их диссоциации в водных растворах. 391. Составьте координационные формулы следующих комплексных соединений кобальта: 3NaNO2·Co(NO2)3, CoCl3·3NH3·2H2O, 2KNO2·NH3·Co(NO2)3. Координационное число кобальта (+3) равно шести. Напишите уравнения диссоциации этих соединений в водных растворах. 392. Напишите выражения для констант нестойкости комплексных ионов [Ag(NH3)2]+, (Fe(CN)6]4–, [PtCl6]2–. Чему равны степень окисления и координационное число комплексообразователей в этих ионах? 393. Константы нестойкости комплексных ионов [Co(CN)4]2–, [Hg(CN)4]2–, [Cd(CN)4]2– соответственно равны 8·10–20, 4·10–41, 1,4·10–17. В каком растворе, содержащем эти ионы (при равной молярной концентрации), ионов CN– больше? Напишите выражения для констант нестойкости указанных комплексных ионов. 394. Напишите выражения для констант нестойкости следующих комплексных ионов: [Ag(CN)2]–, [Ag(NH3)2]+, [Ag(NCS)2]–. Зная, что они соответственно равны 1,0·10–21, 6,8·10–8, 2,0·10–11, укажите, в каком растворе, содержащем эти ионы (при равной молярной концентрации), больше ионов Ag+. 395. При прибавлении раствора KCN к раствору [Zn(NH3)4]SO4 образуется растворимое комплексное соединение K2[Fe(CN)4]. Напишите молекулярное и ионное уравнения реакции. Константа нестойкости какого иона: [Zn(NH3)4]2+ или [Zn(CN)4]2– больше? Почему? 396. Напишите уравнения диссоциации солей K3[Fe(CN)6] и NH4Fe(SO4)2 в водном растворе. К каждой из них прилили раствор щелочи. В каком случае выпадает осадок гидроксида железа? Напишите молекулярное и ионное уравнения реакции. Какие комплексные соединения называются двойными солями? 397. Составьте координационные формулы следующих комплексных соединений платины (+2), координационное число которой равно четырем: PtCl2·3NH3, PtCl2·NH3·KCl, PtCl2·2NH3. Напишите уравнения диссоциации этих соединений в водных растворах. Какое из них является комплексным неэлектролитом? 398. Хлорид серебра растворяется в растворах аммиака и тиосульфата натрия. Дайте этому объяснение и напишите молекулярные и ионные уравнения соответствующих реакций. 399. Какие комплексные соединения называются двойными солями? Напишите уравнения диссоциации солей K4[Fe(CN)6] и (NH4)2Fe(SO4)2 в водном растворе. В каком случае выпадает осадок гидроксида железа, если к каждой из них прилить раствор щелочи? Напишите молекулярное и ионное уравнения реакции. 400. Константы нестойкости комплексных ионов [Co(NH3)6]3+, [Fe(CN)6]4–, [Fe(CN)6]3– соответственно равны 6,2·10–36, 1,0·10–37, 1,0·10–44. Какой из этих ионов является более прочным? Напишите выражения для констант нестойкости указанных комплексных ионов и формулы соединений, содержащих эти ионы.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 983; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.130.96 (0.011 с.) |

 ≈ – 1 В. Все металлы по своему поведению при электролизе водных растворов можно разделить на 3 группы:
≈ – 1 В. Все металлы по своему поведению при электролизе водных растворов можно разделить на 3 группы: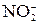 – 2ē + H2O →
– 2ē + H2O → 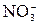 + 2Н+.
+ 2Н+. ,
,  .
. = - 2,92B,
= - 2,92B, 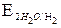 ≈ - 1B,
Так как
≈ - 1B,
Так как  ≈ 1,8 В
2Н2О – 4ē = О2 + 4Н+.
Среда кислая.
≈ 1,8 В
2Н2О – 4ē = О2 + 4Н+.
Среда кислая.
 = - 0,136 B,
= - 0,136 B,
 = + 1,36 В
= + 1,36 В
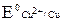 = + 0,34 В;
= + 0,34 В; 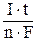 ,
, = 8,86 г; VCl2 = 22,4∙
= 8,86 г; VCl2 = 22,4∙ 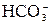 ) создают карбонатную или временную жесткость, остальные анионы – постоянную жесткость (Жпост). Сумму ЖCa и ЖMg называют общей жесткостью (Жобщ).
) создают карбонатную или временную жесткость, остальные анионы – постоянную жесткость (Жпост). Сумму ЖCa и ЖMg называют общей жесткостью (Жобщ). :
: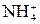 + ОН–, зная, что степень диссоциации α (NH3·H2O) = 0,43% в растворе концентрации 1 моль/л. По найденному значению константы вычислите α (NH3·H2O) в растворе c концентрацией 0,1 моль/л.
+ ОН–, зная, что степень диссоциации α (NH3·H2O) = 0,43% в растворе концентрации 1 моль/л. По найденному значению константы вычислите α (NH3·H2O) в растворе c концентрацией 0,1 моль/л.


