
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Законы электролиза (законы Фарадея)Содержание книги
Поиск на нашем сайте
Электрохимия Электрохи́мия — раздел химической науки, в котором рассматриваются системы и межфазные границы при протекании через них электрического тока, исследуются процессы в проводниках, на электродах (из металлов или полупроводников, включая графит) и в ионных проводниках (электролитах). Электрохимия исследует процессы окисления и восстановления, протекающие на пространственно-разделённых электродах, перенос ионов и электронов. • Электрохимия – раздел физической химии, который изучает системы, содержащие ионы, а также процессы и явления с участием заряженных частиц, имеющие место на границе раздела двух фаз. Разделы электрохимии • Теория растворов электролитов • Равновесные свойства • Неравновесные явления в растворах электролитов • Термодинамика электрохимических систем • Кинетика электрохимических систем Теория растворов – свойства однофазных систем. Э/х термодинамика и кинетика – общие условия равновесия на заряженных границах раздела фаз, строение этих границ, механизм и кинетические закономерности перехода заряженных частиц через межфазные поверхности. Электрохимия является разделом физической химии, в котором изучаются законы взаимосвязи химических и электрических явлений. Основным предметом электрохимии являются процессы, протекающие на электродах при прохождении тока через растворы, - электродные процессы. Химическая реакция: • Контакт частиц • Малый путь электрона • Хаотичность столкновений и ненаправленность электронных переходов • Энергетические эффекты проявляются в виде теплоты Электрохимическая реакция: • Сопровождается протеканием тока • Длинный путь электрона • Иная кинетика по сравнению с химическими реакциями • Скорость реакции зависит от потенциала на границе раздела фаз • Гетерогенны на поверхности • Перенос зарядов возможен при достаточном приближении к электроду • Большая роль границы раздела в кинетике • Пространственное разделение процессов ox & red • Направленность потоков процессов ox & red • Большую часть энергии ок-восст. Р-ции превращается в электрическую. Электрохим. Цепь
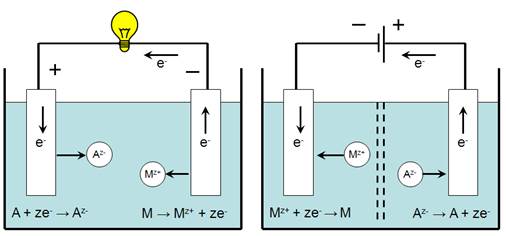
Как видно из рис. 1, для осуществления электрохимической реакции необходима некоторая система — электрохимическая цепь. Основные элементы такой цепи — металлические или полупроводниковые электроды, проводник второго рода1 (конденсированная ионная система — раствор электролита, его расплав или твердый электролит) и границы раздела фаз: между металлом или полупроводником и электролитом, между двумя различными металлами и/или полупроводниками и между двумя различными электролитами.
Электрохимические ячейки. Электрохимическая ячейка обычно состоит из двух полуэлементов, каждый из которых представляет собой электрод, погруженный в свой электролит. Электроды изготавливают из электропроводящего материала (металла или углерода), реже из полупроводника. Полуэлементы разделяются перегородкой, которая не мешает движению ионов, но предотвращает перемешивание электролитов. Роль такой перегородки может выполнять солевой мостик, трубка с водным раствором, закрытая с обоих концов стекловатой, ионообменная мембрана, пластина из пористого стекла. Оба электрода электролитической ячейки могут быть погружены в один электролит.
Электрохимические ячейки бывают двух типов: гальванические элементы и электролитические ячейки (электролизеры).
Электродный потенциал. Основные электрические параметры электрохимических ячеек - сила тока (ее измеряют в амперах, A) и потенциал (измеряемый в вольтах, В). Сила тока определяется скоростью электродных реакций, а потенциал - химической энергией протекающих в ячейке процессов. Он равен энергии (измеряемой в джоулях, Дж), отнесенной к количеству электричества (измеряемому в кулонах, Кл), т.е. 1 В = 1 Дж/Кл. Следовательно, потенциал элемента (электродвижущая сила, ЭДС) - это мера энергии, вырабатываемой в ходе протекающих в нем реакций. Если внешняя цепь разомкнута, то никакие электродные реакции не идут. Кулонометры и кулонометрия Закон Фарадея точно соблюдается, поэтому он лежит в основе самого точного метода измерения количества электричества, прошедшего через цепь, по количеству выделенного на электроде вещества. Для таких измерений используют кулонометры. В качестве кулонометров используют электрохимические системы, в которых нет параллельных электрохимических и побочных химических реакций. По методам определения количества образующихся веществ кулонометры подразделяют на электрогравиметрические, газовые и титрационные.
1) Примером электрогравиметрических кулонометров являются серебряный и медный кулонометры. Действие серебряного кулонометра Ричардсона, представляющего собой электролизер (–) AgïAgNO3×aqïAg (+), основано на взвешивании массы серебра, осевшей на катоде во время электролиза. При пропускании 96500 Кл (1 фарадея) электричества на катоде выделится 1 г-экв серебра (107 г). При пропускании nF электричества на катоде выделяется экспериментально определенная масса (Dmк). Число пропущенных фарадеев электричества определяется из соотношения n = Dm/107. Аналогичен принцип действия медного кулонометра. 2) В газовых кулонометрах продуктами электролиза являются газы, и количества выделяющихся на электродах веществ определяют измерением их объемов. Примером прибора такого типа является газовый кулонометр, основанный на реакции электролиза воды. При электролизе на катоде выделяется водород: 2Н2О + 2е– = 2ОН– + Н2, а на аноде – кислород: Н2О = 2Н+ + ½ О2 + 2е–. Число фарадеев электричества, прошедшее через раствор, равно
где р – внешнее давление, Па; 3) В титрационных кулонометрах количество вещества, образовавшегося в процессе электролиза, определяют титриметрически. К этому типу кулонометров относится титрационный кулонометр Кистяковского, представляющий собой электрохимическую систему (–) PtïKNO3, HNO3ïAg (+). В процессе электролиза серебряный анод растворяется, образуя ионы серебра, которые оттитровывают. Число фарадеев электричества определяют по формуле n = mVc, где m – масса раствора, г; V – объем титранта, пошедший на титрование 1 г анодной жидкости; c – концентрация титранта, г-экв/см3 Классические методы исследования растворов эл-литов. Измерение осмотического давления, давления пара над раствором, криоскопия, эбулиоскопия, тепловой эффект реакции нейтрализации, корреляция между каталитическим действием кислот и их электропроводностью.
Недостатки ™ Степень диссоциации, определенная разными методами, может быть различной. ™ Для концентрированных растворов экспериментальное значение степени диссоциации может превышать единицу. ™ Константа диссоциации, определенная по Аррениусу, для сильных электролитов зависит от концентрации. ™ Не указаны причины ионизации электролитов в растворе. ™ Пренебрежение ион-дипольным взаимодействием делает невозможным объяснить процесс образования ионов и устойчивость ионных систем, ведь именно это взаимодействие является физической основой образования ионов в растворе при растворении электролита. Энтропия сольватации
Энергии и теплоты сольватации электролитов впервые были рассчитаны Борном и Габером (1919) при помощи циклов, основанных на законе Гесса. NaCl (кр)
Na+ (aq) + Cl– (aq)
DHNaCl – изменение энтальпии в ходе разрушения кристаллической решетки хлорида натрия (связь с энергией решетки: DGp = DHNaCl – TDS; при 298К TDS составляет приблизительно 15 кДж/моль); DHL – теплота растворения хлорида натрия, экстраполированная на бесконечно разбавленный раствор соли;
DHs+, DHs– – теплоты сольватации катиона и аниона. Из этого цикла для теплоты сольватации хлорида натрия получаем: DHsNaCl = DHs+ + DHs– = DHL – DHNaCl = 4 – 772 = – 768 кДж/моль. Данное уравнение позволяет найти теплоту гидратации, если известны теплоты растворения и энергия решетки. Теплоты растворения находят экспериментально, а энергии решеток рассчитывают либо по соответствующим уравнениям, либо из циклов, используя другие экспериментально определимые величины. Полученное значение достаточно хорошо согласуется с энергией решетки, подсчитанной по уравнению Борна.
Фрумкин
Ионная ассоциация
2.6) механизмы образования р-ров эл-литов, сольватация, гидратация кат, ан, м-л. Числа сольватации. Корреляционные подходы к сравнению р-лей. Их хар-ки. 2 механизма обр-ния р-ров: растворение ионофоров, полное разрушение крист. Решетки; и потенциальных электролитов - ионогенов: химич. Вз-вие с молекулами р-ля. И для ионофоров, и для ионогенов конечными продуктами взаимодействия между растворяемым веществом и растворителем являются сольватированные ионы, а энергетические эффекты проявляются как энергии сольватации. Чтобы доказать это, надо рассчитать энергию сольватации и сопоставить ее с энергией кристаллической решетки (энергией химической связи). Если эти энергии окажутся близкими, то вывод о разрушении решетки соли (нейтральной молекулы ионогена) за счет ион-дипольного взаимодействия можно считать правильным. Энергии и теплоты сольватации электролитов впервые были рассчитаны Борном и Габером (1919) при помощи циклов, основанных на законе Гесса. NaCl (кр)
Na+ (aq) + Cl– (aq)
DHNaCl – изменение энтальпии в ходе разрушения кристаллической решетки хлорида натрия (связь с энергией решетки: DGp = DHNaCl – TDS; при 298К TDS составляет приблизительно 15 кДж/моль); DHL – теплота растворения хлорида натрия, экстраполированная на бесконечно разбавленный раствор соли; DHs+, DHs– – теплоты сольватации катиона и аниона. Из этого цикла для теплоты сольватации хлорида натрия получаем: DHsNaCl = DHs+ + DHs– = DHL – DHNaCl = 4 – 772 = – 768 кДж/моль. Данное уравнение позволяет найти теплоту гидратации, если известны теплоты растворения и энергия решетки. Теплоты растворения находят экспериментально, а энергии решеток рассчитывают либо по соответствующим уравнениям, либо из циклов, используя другие экспериментально определимые величины. Как видно из расчета, теплоты гидратации имеют тот же порядок, что и энергия решеток, и могут обеспечить распад кристалла на отдельные ионы.
Полиэлектролиты
3.1) Общая характеристика неравновесных явлений в растворах электролитов. Причины возникновения.
Общий поток ионов
Если ионы сорта i в среднем не перемещаются в растворе, т.е. Нернста-Эйнтшейна
Электрохимический потенциал определяют также как умноженную на число Авогадро работу переноса заряженной частицы i из бесконечно удаленной точки в вакууме в данную фазу
где Подвижность: Если ион движется с постоянной скоростью v, то сила, действующая со стороны электрического поля, равна по абсолютной величине силе трения. Сила трения равна F трения = k трения v, где k трения – коэффициент трения. Так как две силы равны, то Скорость движения пропорциональна напряженности электрического поля.
• Коэффициент пропорциональности называют электрической подвижностью иона (u). Если ион радиуса r движется со скоростью v, то для него kтрения = 6πηr где η – вязкость среды. Так как |Fполя| = |Fтрения|, то • Это значит, что большие ионы движутся медленнее маленьких • Однако в водных растворах u(Cs+) > u(K+) > u(Na+) > u(Li+). Это обусловлено более сильной гидратацией ионов металлов с меньшим радиусом. • Для отдельных ионов λ + = u + ∙v + ∙z + ∙F λ – = u – ∙v – ∙z – ∙F Молярная Λm - молярная электропроводность Единицы измерения См∙м2∙моль-1 Типичные значения ~0.01 См∙м2∙моль-1 Молярная электропроводность – электропроводность раствора, содержащего 1 моль соответствующих ионов
Закон Кольрауша ™ В бесконечно разбавленном растворе электролита перенос электричества осуществляется всеми ионами независимо друг от друга: Λ m = v + λ + + v – λ – где λ +, λ – - подвижности ионов электролита M v + A v –. ™ Из подвижностей ионов можно рассчитать молярную электропроводность электролита. ™ Часто в справочниках молярную электропроводность приводят не на 1 моль ионов, а на 1 /z + или 1 /z – ионов, например ½Ca2+. ™ Зависимость молярной электропроводности для слабых электролитов выражена более сильно, чем для сильных из-за уменьшения их степени диссоциации с ростом концентрации. ™ Для них Λ m = αΛ ¥m где α – степень диссоциации
методичка стр.22 3.6) Числа переноса и их экспериментальное определение методами движущейся границы и Гитторфа. Определение чисел переноса путём измерения диффузионного потенциала. Числом переноса ионов называется доля прошедшего через электролит электричества, перенесенная данным родом ионов: t+ = Таким образом, число переноса равно отношению скорости движения (или подвижности) данного иона к сумме скоростей движения (или подвижностей) катиона и аниона.
Определение чисел переноса ™ Числа переноса зависят от природы электролита, его концентрации, температуры и т.д. ™ Для определения чисел переноса используют различные методы: – метод движущейся границы – метод Гитторфа – метод э.д.с. Метод движущейся границы ™ ™ Если граница перемещается на расстояние L, то ионами Cd2+ переносится с 1 LSz + F Кл электричества. ™ Тогда ™ У электролитов должен быть один общий ион (Cl –) ™ Плотность нижнего раствора больше, чем плотность верхнего ™ Для сохранения границы между растворами подвижность иона в верхнем растворе должна превышать подвижность иона в нижнем (H+ и Cd2+) ™ В методе используется различие в показателях преломления исследуемого и индикаторного растворов, и положение границы регистрируется специальной оптической системой.
Рассмотрим схему движения ионов (переноса электричества) в растворе HCl при электролизе. Разделим мысленно ванну с электролитом на три отделения: I - анодная часть (анолит), II - центральная часть, III - катодная часть (католит). В процессе электролиза в отделении II концентрация электролита не изменяется, в отделениях I и III - изменяется. Отношение убыли электролита у анода Dса и убыли электролита у катода Dск, Dса/Dск равно отношению абсолютных скоростей катиона и аниона и равно отношению их подвижностей. t+ = Определенные по методу Гитторфа числа переноса называются кажущимися числами переноса; они не являются истинными, т.к. этот метод не учитывает сольватации ионов.
Электрохимия Электрохи́мия — раздел химической науки, в котором рассматриваются системы и межфазные границы при протекании через них электрического тока, исследуются процессы в проводниках, на электродах (из металлов или полупроводников, включая графит) и в ионных проводниках (электролитах). Электрохимия исследует процессы окисления и восстановления, протекающие на пространственно-разделённых электродах, перенос ионов и электронов. • Электрохимия – раздел физической химии, который изучает системы, содержащие ионы, а также процессы и явления с участием заряженных частиц, имеющие место на границе раздела двух фаз. Разделы электрохимии • Теория растворов электролитов • Равновесные свойства • Неравновесные явления в растворах электролитов • Термодинамика электрохимических систем • Кинетика электрохимических систем Теория растворов – свойства однофазных систем. Э/х термодинамика и кинетика – общие условия равновесия на заряженных границах раздела фаз, строение этих границ, механизм и кинетические закономерности перехода заряженных частиц через межфазные поверхности. Электрохимия является разделом физической химии, в котором изучаются законы взаимосвязи химических и электрических явлений. Основным предметом электрохимии являются процессы, протекающие на электродах при прохождении тока через растворы, - электродные процессы. Химическая реакция: • Контакт частиц • Малый путь электрона • Хаотичность столкновений и ненаправленность электронных переходов • Энергетические эффекты проявляются в виде теплоты Электрохимическая реакция: • Сопровождается протеканием тока • Длинный путь электрона • Иная кинетика по сравнению с химическими реакциями • Скорость реакции зависит от потенциала на границе раздела фаз • Гетерогенны на поверхности • Перенос зарядов возможен при достаточном приближении к электроду • Большая роль границы раздела в кинетике • Пространственное разделение процессов ox & red • Направленность потоков процессов ox & red • Большую часть энергии ок-восст. Р-ции превращается в электрическую. Электрохим. Цепь
Как видно из рис. 1, для осуществления электрохимической реакции необходима некоторая система — электрохимическая цепь. Основные элементы такой цепи — металлические или полупроводниковые электроды, проводник второго рода1 (конденсированная ионная система — раствор электролита, его расплав или твердый электролит) и границы раздела фаз: между металлом или полупроводником и электролитом, между двумя различными металлами и/или полупроводниками и между двумя различными электролитами. Электрохимические ячейки. Электрохимическая ячейка обычно состоит из двух полуэлементов, каждый из которых представляет собой электрод, погруженный в свой электролит. Электроды изготавливают из электропроводящего материала (металла или углерода), реже из полупроводника. Полуэлементы разделяются перегородкой, которая не мешает движению ионов, но предотвращает перемешивание электролитов. Роль такой перегородки может выполнять солевой мостик, трубка с водным раствором, закрытая с обоих концов стекловатой, ионообменная мембрана, пластина из пористого стекла. Оба электрода электролитической ячейки могут быть погружены в один электролит.
Электрохимические ячейки бывают двух типов: гальванические элементы и электролитические ячейки (электролизеры).
Электродный потенциал. Основные электрические параметры электрохимических ячеек - сила тока (ее измеряют в амперах, A) и потенциал (измеряемый в вольтах, В). Сила тока определяется скоростью электродных реакций, а потенциал - химической энергией протекающих в ячейке процессов. Он равен энергии (измеряемой в джоулях, Дж), отнесенной к количеству электричества (измеряемому в кулонах, Кл), т.е. 1 В = 1 Дж/Кл. Следовательно, потенциал элемента (электродвижущая сила, ЭДС) - это мера энергии, вырабатываемой в ходе протекающих в нем реакций. Если внешняя цепь разомкнута, то никакие электродные реакции не идут. Законы электролиза (законы Фарадея) Поскольку прохождение электрического тока через электрохимические системы связано с химическими превращениями, между количеством протекающего электричества и количеством прореагировавших веществ должна существовать определенная зависимость. Она была открыта Фарадеем и получила свое выражение в первых количественных законах электрохимии, названных впоследствии законами Фарадея. Первый закон Фарадея. Количества веществ, превращённых при электролизе, пропорциональны количеству электричества, прошедшего через электролит: Dm = k э q = k э It, Dm – количество прореагировавшего вещества; k э – некоторый коэффициент пропорциональности; q – количество электричества, равное произведению силы тока I на время t. Если q = It = 1, то Dm = k э, то есть коэффициент k э представляет собой количество вещества, прореагировавшего в результате протекания единицы количества электричества. Коэффициент k э называется электрохимическим эквивалентом. Второй закон Фарадея отражает связь, существующую между количеством прореагировавшего вещества и его природой: при постоянном количестве прошедшего электричества массы различных веществ, испытывающие превращение у электродов (выделение из раствора, изменение валентности), пропорциональны химическим эквивалентам этих веществ: Dm i /A i = const. Можно объединить оба закона Фарадея в виде одного общего закона: для выделения или превращения с помощью тока 1 г-экв любого вещества (1/z моля вещества) необходимо всегда одно и то же количество электричества, называемое числом Фарадея (или фарадеем): Dm = Точно измеренное значение числа Фарадея F = 96484,52 ± 0,038 Кл/г-экв. Таков заряд, несомый одним грамм-эквивалентом ионов любого вида. Умножив это число на z (число элементарных зарядов иона), получим количество электричества, которое несёт 1 г-ион. Законы, открытые Фарадеем в 1833 г., строго выполняются для проводников второго рода. Наблюдаемые отклонения от законов Фарадея являются кажущимися. Они часто связаны с наличием неучтённых параллельных электрохимических реакций. Отклонения от закона Фарадея в промышленных установках связаны с утечками тока, потерями вещества при разбрызгивании раствора и т.д. В технических установках отношение количества продукта, полученного при электролизе, к количеству, вычисленному на основе закона Фарадея, меньше единицы и называется выходом по току: ВТ =
Кулонометры и кулонометрия Закон Фарадея точно соблюдается, поэтому он лежит в основе самого точного метода измерения количества электричества, прошедшего через цепь, по количеству выделенного на электроде вещества. Для таких измерений используют кулонометры. В качестве кулонометров используют электрохимические системы, в которых нет параллельных электрохимических и побочных химических реакций. По методам определения количества образующихся веществ кулонометры подразделяют на электрогравиметрические, газовые и титрационные. 1) Примером электрогравиметрических кулонометров являются серебряный и медный кулонометры. Действие серебряного кулонометра Ричардсона, представляющего собой электролизер (–) AgïAgNO3×aqïAg (+), основано на взвешивании массы серебра, осевшей на катоде во время электролиза. При пропускании 96500 Кл (1 фарадея) электричества на катоде выделится 1 г-экв серебра (107 г). При пропускании nF электричества на катоде выделяется экспериментально определенная масса (Dmк). Число пропущенных фарадеев электричества определяется из соотношения n = Dm/107. Аналогичен принцип действия медного кулонометра. 2) В газовых кулонометрах продуктами электролиза являются газы, и количества выделяющихся на электродах веществ определяют измерением их объемов. Примером прибора такого типа является газовый кулонометр, основанный на реакции электролиза воды. При электролизе на катоде выделяется водород: 2Н2О + 2е– = 2ОН– + Н2, а на аноде – кислород: Н2О = 2Н+ + ½ О2 + 2е–. Число фарадеев электричества, прошедшее через раствор, равно
где р – внешнее давление, Па; 3) В титрационных кулонометрах количество вещества, образовавшегося в процессе электролиза, определяют титриметрически. К этому типу кулонометров относится титрационный кулонометр Кистяковского, представляющий собой электрохимическую систему (–) PtïKNO3, HNO3ïAg (+). В процессе электролиза серебряный анод растворяется, образуя ионы серебра, которые оттитровывают. Число фарадеев электричества определяют по формуле n = mVc, где m – масса раствора, г; V – объем титранта, пошедший на титрование 1 г анодной жидкости; c – концентрация титранта, г-экв/см3
|
|||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 753; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.93.70 (0.015 с.) |



 ,
, – давление насыщенного пара воды при температуре опыта, Па; V – суммарный объем выделенного газа, м3.
– давление насыщенного пара воды при температуре опыта, Па; V – суммарный объем выделенного газа, м3.





 Na+(газ) + Cl–(газ)
Na+(газ) + Cl–(газ)















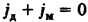

 Формально электрохимический потенциал разбивают на два слагаемых, характеризующих хим. и электрич. составляющие такой работы:
Формально электрохимический потенциал разбивают на два слагаемых, характеризующих хим. и электрич. составляющие такой работы:
 - хим. потенциал частиц i в фазе
- хим. потенциал частиц i в фазе  zi - зарядовое число этих частиц;
zi - зарядовое число этих частиц;  - внутр. потенциал фазы
- внутр. потенциал фазы  , F — число Фарадея.
, F — число Фарадея.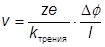

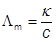 κ = (u + ∙v + ∙z + + u – ∙v – ∙z –) c∙F
κ = (u + ∙v + ∙z + + u – ∙v – ∙z –) c∙F  =
= 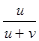 =
=  , t- =
, t- =  =
=  =
= 
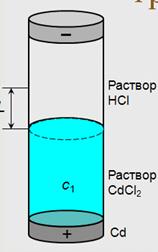 Определяют расстояние, на которое за известный промежуток времени переместится под действием внешнего тока граница между двумя растворами с одним общим анионом
Определяют расстояние, на которое за известный промежуток времени переместится под действием внешнего тока граница между двумя растворами с одним общим анионом
 по изменению концентрации ионов у электродов (метод Гитторфа).
по изменению концентрации ионов у электродов (метод Гитторфа). =
= 

 It =
It =  It.
It. =
=  .
.


