
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Снижение диффузионного потенциалаСодержание книги Поиск на нашем сайте ¨ Наличие Δ φ д не позволяет проводить точные измерения э.д.с. электрохимических систем ¨ Для его уменьшения используют метод солевого моста ¨ Между двумя растворами помещают промежуточный концентрированный раствор электролита с близкими значениями подвижностей катионов и анионов. В этом случае одна граница между двумя растворами заменяется на две границы с меньшим потенциалом. Кроме того, потенциалы на этих границах будут меньшими по знаку. ¨ В качестве солевых мостов используют растворы KCl и NH4NO3. 5)Удельная, эквивалентная и молярная электропроводности электролитов. определение. Размерность. Закон Кольрауша. Практическое приложение з-на Кольрауша, определение Константы скорости эд.дис., ПР труднорастворимых солей, Кондуктометрическре титрование. Удельная электропроводность – электропроводность раствора или расплава, заключенного между двумя электродами площадью по 1 м2, расстояние между которыми равно 1 м ™ R – электрическое сопротивление ™ G – электрическая проводимость (электропроводность) ™ G измеряется в Ом-1 или сименсах (См) 1 Ом-1 = 1 См
™ κ – удельная электропроводность (Ом-1см-1) ™ При увеличении концентрации сильного электролита удельная электропроводность увеличивается вследствие увеличения общего числа ионов в растворе. Дальнейший рост концентрации приводит к уменьшению подвижности ионов вследствие их взаимодействия друг с другом ™ Удельная электропроводность растворов слабых электролитов значительно ниже удельной электропроводности растворов сильных электролитов вследствие их малой степени диссоциации kt = k25 × [1 + a (t - 25)+ β(t-25)2 ] Эквивалентная электропроводность L [в м2/(г-экв×Ом)] - это электропроводность объема раствора, в котором содержится 1 г-экв растворенного вещества, причем электроды находятся на расстоянии 1 м друг от друга. Зависимость l - l = l¥ - А l¥ - предельная эквивалентная электропроводность при бесконечном разведении: с ® 0, j ® ¥. l Или закон кубического корня при более высоких концентрациях l = l¥ - B Зависимость от т l(T)= l(T=0)*(1+αt+βt2) Молярная Λm - молярная электропроводность Единицы измерения См∙м2∙моль-1 Типичные значения ~0.01 См∙м2∙моль-1 Молярная электропроводность – электропроводность раствора, содержащего 1 моль соответствующих ионов
Закон Кольрауша ™ В бесконечно разбавленном растворе электролита перенос электричества осуществляется всеми ионами независимо друг от друга: Λ m = v + λ + + v – λ – где λ +, λ – - подвижности ионов электролита M v + A v –. ™ Из подвижностей ионов можно рассчитать молярную электропроводность электролита. ™ Часто в справочниках молярную электропроводность приводят не на 1 моль ионов, а на 1 /z + или 1 /z – ионов, например ½Ca2+. ™ Зависимость молярной электропроводности для слабых электролитов выражена более сильно, чем для сильных из-за уменьшения их степени диссоциации с ростом концентрации. ™ Для них Λ m = αΛ ¥m где α – степень диссоциации
методичка стр.22 3.6) Числа переноса и их экспериментальное определение методами движущейся границы и Гитторфа. Определение чисел переноса путём измерения диффузионного потенциала. Числом переноса ионов называется доля прошедшего через электролит электричества, перенесенная данным родом ионов: t+ = Таким образом, число переноса равно отношению скорости движения (или подвижности) данного иона к сумме скоростей движения (или подвижностей) катиона и аниона. Определение чисел переноса ™ Числа переноса зависят от природы электролита, его концентрации, температуры и т.д. ™ Для определения чисел переноса используют различные методы: – метод движущейся границы – метод Гитторфа – метод э.д.с. Метод движущейся границы ™ ™ Если граница перемещается на расстояние L, то ионами Cd2+ переносится с 1 LSz + F Кл электричества. ™ Тогда ™ У электролитов должен быть один общий ион (Cl –) ™ Плотность нижнего раствора больше, чем плотность верхнего ™ Для сохранения границы между растворами подвижность иона в верхнем растворе должна превышать подвижность иона в нижнем (H+ и Cd2+) ™ В методе используется различие в показателях преломления исследуемого и индикаторного растворов, и положение границы регистрируется специальной оптической системой.
Рассмотрим схему движения ионов (переноса электричества) в растворе HCl при электролизе. Разделим мысленно ванну с электролитом на три отделения: I - анодная часть (анолит), II - центральная часть, III - катодная часть (католит). В процессе электролиза в отделении II концентрация электролита не изменяется, в отделениях I и III - изменяется. Отношение убыли электролита у анода Dса и убыли электролита у катода Dск, Dса/Dск равно отношению абсолютных скоростей катиона и аниона и равно отношению их подвижностей. t+ = Определенные по методу Гитторфа числа переноса называются кажущимися числами переноса; они не являются истинными, т.к. этот метод не учитывает сольватации ионов.
|
||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 622; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |

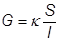 или
или 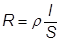
 : для сильных электролитов соблюдается медленное линейное уменьшение l с увеличением
: для сильных электролитов соблюдается медленное линейное уменьшение l с увеличением 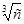

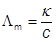 κ = (u + ∙v + ∙z + + u – ∙v – ∙z –) c∙F
κ = (u + ∙v + ∙z + + u – ∙v – ∙z –) c∙F  =
= 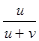 =
=  , t- =
, t- =  =
=  =
= 
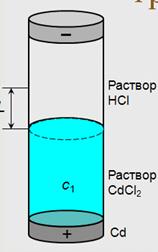 Определяют расстояние, на которое за известный промежуток времени переместится под действием внешнего тока граница между двумя растворами с одним общим анионом
Определяют расстояние, на которое за известный промежуток времени переместится под действием внешнего тока граница между двумя растворами с одним общим анионом
 по изменению концентрации ионов у электродов (метод Гитторфа).
по изменению концентрации ионов у электродов (метод Гитторфа). =
= 




