
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Последовательность разрядки ионов при электролизе на катоде.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Первоначально и преимущественно восстанавливаются ионы или молекулы воды и в целом осуществляются процессы восстановления, характеризующиеся большей величиной стандартного потенциала. На аноде первоначально и преимущественно протекают процессы окисления анионов или молекул характеризующихся меньшей величиной электронного потенциала. В целом анионы на аноде окисляются в следующей последовательности S2-, J-, Br -, Cl-, H2O, OH-, но для системы, При электролизе растворов хлорида на аноде первоначально окисляются анионы хлора, несмотря на то, что их окислительно-восстановительный потенциал больше. Это связано с высоким перенапряжением выделения кислорода на аноде при окислении воды. Не окисляются анионы NO3-, PO43-, MnO4-, так как степени окисления азота, фосфора и марганца в этих анионах максимальна. Анион SO42- окисляется, но имеет высокий окислительно-восстановительный потенциал Электролиз водных растворов электролитов. Молекулы воды могут окисляться и восстанавливаться, следовательно, на катоде и аноде конкурируют реакции восстановления и окисления катионов и анионов и молекул воды.
На катоде К(С): K++1е 2J- -2e
При электролизе водных растворов металла, характерная величена стандартного электродного потенциала меньше, чем Электролиз с растворенным анодом. В случае использования в качестве анода металла анодов наряду с процессами окисления анионов молекул может происходить окисление анода. Если в металле анод окисляется, он переходит в виде катиона в электролит, следовательно, имеет место растворение анода. Кроме того, некоторые металлы можно подвергать окислению с участием кислорода и тогда окисление электрода приводит к покрытию металла пленкой окисла. Такие процессы называют анодным оксидированием, и они используются для нанесения антикоррозионных и уплотняющих покрытий на поверхность металла. Чаще всего анодно оксидируют алюминий конструкции. Законы Фарадея. Масса вещества, выделившегося на электроде, прямо пропорциональна количеству электричества прошедшего через раствор. m(B)=kIt It=Q
где I – постоянный ток; t – время пропускания тока; k – электрохимический эквивалент; М – молярная масса вещества; F – постоянная Фарадея; z – число электронов участвующих в процессе. Следствие: при прохождении одинакового количества электронов через систему последовательно соединенных электролизеров масса веществ, превращающихся на электродах пропорциональны их эквивалентным массам (соблюдается закон эквивалентов). В реальных условиях на электролизере, возможно, протекает одновременно несколько реакций, в этих случаях на получение данного продукта затрачивается доля общего количества электричества, которое выражают в процентах и называют выход по току.
Применение электролиза: 1. нанесение покрытий на поверхности твердых тел (металлом или оксидами металла); 2. получение щелочных, щелочноземельных металлов и алюминия; 3. получение самых активных окислителей. Коррозия металла. Самопроизвольно протекающий процесс разрушения металлов в результате взаимодействия с окружающей средой, происходящий с выделением энергии и рассеиванием вещества (рост энтропии), называется коррозией. Коррозионные процессы протекают самопроизвольно и необратимо в соответствии со вторым началом термодинамики. Химческая сторона коррозии – это всегда окисление металла, которое сопровождается переходом его Физическая сторона этого процесса связана: 1. диффузия компонентов среды поверхности металла; 2. возникновение электродных потенциалов; 3. если есть превращение одних веществ металла в другие (окислы, соли). Происходит изменение физических свойств в зависимости от условия протекания, а следовательно, среды эксплуатации конструкции различают: - газовую (высокотемпературную); - атмосферную; - почвенную; - в водной среде; - коррозию в жидких не электролитах (бензине, маслах); - в электролитах, при кислотных дождях. В зависимости от условий коррозии имеет различный механизм, газовая в сокотемпературная и коррозия в не электролитах протекает как химическая коррозия, то есть имеет место непосредственного взаимодействия металла с кислородом или другими окислителями.
Во всех других случаях коррозия протекает как электрохимическая коррозия так как во всех жизненных средах (атмосфера, водоем, почвы) присутствуют кислород и вода, а также пары кислот, соли, то есть среда всегда электролитическая, металл оказывается погруженным в электролит (он всегда является электродом). На его поверхности возникает электродный потенциал (на разных участках возникают разные электродные потенциалы). Участки с разными электродными потенциалами оказываются замкнутыми самим элементом конструкций. То есть на поверхности материала возникают гальванические элементы, участки которых с меньшим потенциалом служат анодом (на них идет окисление компонентов среды), а участки с большим потенциалом - катодом (на них идет восстановление компонентов среды). Медленное выделение тепловой энергии почти без повышения температуры или электрической энергии с ничтожно малыми разностями потенциалов не даёт возможности использовать выделяющуюся энергию – происходит рассеивание энергии (рост тепловой части энтропии). Продукты коррозии, как правило, рассеиваются в процессе эксплуатации металлических конструкций, что ведёт к росту энтропии (концентрационная часть энтропии). Электрохимическая коррозия, идущая в электролитной среде под действием внутренних микро- или макро гальванических пар или внешней разности потенциалов. Оба типа коррозионных процессов определяются термодинамически- изменением свободной энергии Гиббса.
Процессы высокотемпературной химической коррозии определяется константой равновесия обратимых гетерогенных реакций, и для исследования их мы используем первую часть равенства. Кроме термодинамической вероятности процесса необходимо рассматривать кинетику процесса, т. к. она определяет долговечность и надёжность машин и конструкций, работающих в коррозионных средах. Существенно влияет на коррозионные процессы уровень внешних или внутренних напряжений и их распределение в металле изделия.
Условия возникновения коррозионных гальванических элементов.
Механизм электрохимической коррозии. Частные с меньшим потенциалом являются анодами: 1 случай: (-) А(Fe) Fe-2e (+) K(Fe) O2+H2O+4e 2Fe+O2+H2O 2 случай: в кислой среде в присутствии кислорода. (-) А(Fe) Fe-2e (+) K(Fe) O2+4H++4e 2Fe+O2+4H+ 3 случай: коррозия в кислых средах. (-) А(Fe) Fe-2e (+) K(Fe) 2H++2e Fe+2H+ Термодинамические характеристики процесса коррозии.
Кинетические характеристики процесса коррозии. Коррозия – это сложный процесс, то есть состоит из нескольких стадий, влияющих на скорость коррозии. В целом скорость разрушения материала определяется скоростью самой медленной стадии – лимитирующая. Таким образом, управлять скоростью коррозии можно, замедляя одну из ее стадий: 1. перенос реагирующих веществ на поверхности раздела фаз; 2. собственно гетерогенная реакция на анодных и катодных реакциях; 3. отвод продуктов реакции из реакционной зоны. (Все три стадии протекают одновременно на поверхности материала и определяют скорость друг друга.) Из термодинамики и кинематики процесса коррозии следует: 1. коррозия неизбежна; 2. можно управлять скоростью этого процесса; 3. предотвратить его можно путем изоляции поверхности материала от внешней среды. Решая эту задачу необходимо: - сохранить однородность материала; - само покрытие должно обеспечивать сохранение прочностных характеристик. Защита металлов от коррозии. Можно выделить несколько направлений борьбы с коррозией: I группа: структурирование материала на стадии получения сплавов. Первое направление обусловлено учетом условий коррозии при конструировании технических устройств. Если в техническом устройстве в качестве конструкционных материалов одновременно используются медь и железо, цинк и железо и т. д., то, очевидно, такое техническое устройство будет быстро коррозировать. II группа: нанесение покрытий. Нанесению покрытий должно предшествовать подготовка поверхности материала, а при нанесении необходимо соблюдать технологические режимы это обеспечивает сохранение однородности материала. Второе направление борьбы с коррозией — это тщательная покраска технического устройства. Например, автомобилисты покрывают днище, крылья и двери автомобиля специальной мастикой, которая препятствует проникновению к поверхности металла воздуха и влаги. III группа: электрохимические методы защиты. Третье направление защиты от коррозии — так называемая протекторная защита металла. Для защиты металла специально создаются условия для электрохимической коррозии. Но делают это так, чтобы нужный металл не разрушался, а коррозировал специально закрепленный другой металл. Например, если к стальной поверхности прикрепить цинковые пластинки, то коррозировать будет цинк. Стальная поверхность, таким образом, будет защищена. У нас в стране был опыт использования протекторной защиты автомобилей. Для этого государственные регистрационные номера изготовляли из цинка. Предполагалось, что в процессе эксплуатации разрушаться будут номера, а автомобиль — нет. Но эксплуатация таких «защищенных» автомобилей в условиях крупных городов, в которых зимой дороги посыпаются солью, приводит к настолько быстрой коррозии, что протекторная защита не спасает. Кроме того, через несколько лет цинковые номера настолько сильно разрушились, что возникла проблема их замены. IV группа: активирование или пассивирование поверхности материала. Четвертое направление защиты от коррозии — это покрытие одного металла другим, более устойчивым к коррозии. Так, иногда части технических устройств покрывают никелем или хромом. Они выглядят очень привлекательно и устойчивы к коррозии.
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 622; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.227.3 (0.01 с.) |

 а для воды
а для воды  В.
В. и окисление связано с образованием над сернистых соединений.
и окисление связано с образованием над сернистых соединений. Электролиз водных растворов KJ.
Электролиз водных растворов KJ. К0
К0 


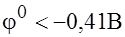 , из водных растворов катионы таких металлов не восстанавливаются. Эти металлы можно получить только при электролизе металлов их солей (металлы щелочные, щелочноземельные, алюминий).
, из водных растворов катионы таких металлов не восстанавливаются. Эти металлы можно получить только при электролизе металлов их солей (металлы щелочные, щелочноземельные, алюминий).









