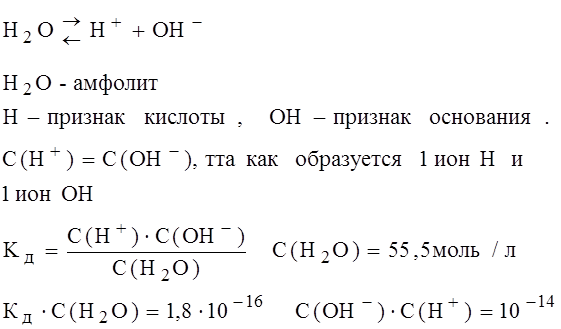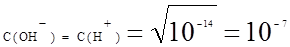Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энергетические эффекты при растворении.Содержание книги
Поиск на нашем сайте
Процессы растворения – физико-химические процессы. Их физическая частота заключается в том, что растворение связано с распределением структурных единиц одного вещества между структурными единицами другого. Для этого необходимы затраты энергии. · Теплосодержание (энтропия) увеличивается, если · Химическая сторона при растворении имеет место взаимодействия между молекулами растворенного вещества и растворителя. Если растворитель вода он называется гидротацией.
Электролитическая диссоциация. Законы Рауля не соблюдаются для растворов кислот, оснований и солей. Пример: если приготовить одномолярный раствор KCl, то температура его замерзания будет приблизительно равна –3,5˚С (должна быть равна -2˚С). На практике оказывается, что
i-изотонический коэффициент. Такую аномалию можно объяснить только тем, что число частиц растворенных между структурными единицами растворителя почти в два раза выше, чем число молекул KCl. На основании этого шведский ученый Аррениус предположил, что при растворении в воде кислот, оснований и солей их молекулы распадаются, то есть диссоциируют на ионы, что легло в основу теории электролитической диссоциации. Электролитическая диссоциация – это распад веществ на ионы под действием молекул растворителя.
Соединения способные к диссоциации называют электролитами, их водные растворы проводят электрический ток. Их называют проводники второго рода с ионной проводимостью. Электролитическая диссоциация. Степень диссоциации По величине степени диссоциации электролиты делятся на слабые Степень диссоциации зависит от природы растворителя, от температуры раствора, от концентрации раствора. Сильные электролиты. К сильным электролитам относится: минеральные кислоты (серная, соляная, азотная, фосфорная), гидроксиды щелочных и щелочноземельных металлов, металлы I, II группы ПСХЭ (водные растворы таких гидросксидов называются щелочами), большинство солей (имеют ионный тип связи и в узлах кристаллической решетки находятся ионы). Молекулы воды являются диполями (окружающиеся ионы ориентируясь отрицательным полюсом к катиону и положительным к аниону) тем самым разрушая ионную связь. Степень диссоциации таких соединений теоретически должна быть равна 100%, но концентрация ионов, которую можно обнаружить в растворе практическим путем (путем определения электропроводимости раствора) оказывается всегда меньшей, чем теоретически ожидаемая. Поэтому сильные электролиты принято характеризовать величиной (a) активной концентрации (активность). Активная концентрация ионов – это концентрация ионов в растворе, которая фактически проявляется в определенной величине электропроводности раствора и в целом в химических взаимодействиях иона. Понижение активности по сравнению с заданной концентрации связано с тем, что ионы в растворе окружены противоионами, молекулами растворителя и при своем движении несут с собой так называемую ионную атмосферу. В связи с этим приготовив раствор определенной концентрации данного электролита, необходимо и возможно рассчитать активность металлов a=f·С, где f – коэффициент активности ионов, он зависит от природы растворителя и от концентрации раствора, то что активность иона всегда ниже их концентрации объясняется тем, что ион в растворе взаимодействует с другими ионами, с молекулами воды, окружающей ионной атмосферой, которая снижает его реакционную способность. Зависит от с f=f(С), как правило, f возрастает при снижении С, f=const, С – концентрация ионов в растворе С(KCl)=1моль/л, С(K+)=1моль/л, С(Cl–)=1моль/л. Кислоты, основания, соли с точки зрения теории электрической диссоциации. 1. Кислоты – это электролиты в водных растворах, которых всегда присутствуют катионы H (протоны); это электролиты, которые диссоциируют катион водорода (H+ - HCl, HNO3, H2SO4) и анион кислотного остатка. HCl→H++Cl- HNO3→ H++ NO3- Многоосновные кислоты (серная, фосфорная) диссоциируют ступенчато.
Кислыми считаются растворы, в которых присутствуют катионы водорода. Протоны в воде гидротируются 2. Основания – это электролиты, которые при диссоциации образуют анион гидроксильной группы OH- и катион металла 3. Соли – это электролиты, которые диссоциируют на катионы металла и анионы кислотного остатка.
Слабые электролиты. К слабым электролитам относятся: вода, гидроксид аммония, основания, образованные всеми другими металлами, кроме щелочных и щелочноземельных, органические кислоты (пример: CH3COOH), некоторые минеральные кислоты (пример: H2S, H2CO3). В водных растворах таких электролитов при данной температуре и концентрации электролита устанавливают равновесие между ионной и молекулярными формами электролита, то есть процесс диссоциации обратим. Пример: Наряду с диссоциацией идет ассоциация (между ионной и молекулярной формой). Такое равновесие характеризуется величиной константой равновесия (или константа диссоциации).
Кд слабых электролитов можно найти в справочных таблицах. Закон разбавления Оствальда.
С – концентрация электролита. Он дает возможность рассчитать Ионное произведение воды. Водородный показатель.
Произведение концентрации ионов водорода и концентрации гидродных групп называют ионным произведением воды, для стандартных условий есть величина постоянная, равная 10-14 Водородный показатель (pH) pH= -lgC(H+) pH= -lg10-7 Если в воде растворить кислоту, равновесие смещается в сторону ассоциации, а ионное произведение воды остается постоянным.
Учитывая, что вода чаще всего используется в качестве среды для многих реакций, протекающих в природе, технике, быту и живых организмах принято говорить о кислой, щелочной и нейтральной реакции среды, характеризуя ее по значению pH. Величину pH можно определить электрохимическим путем с помощью потенциометра. Кроме того, величину pH можно определить с помощью кислотно-щелочных индикаторов- это органические соединения, окраска которых изменяется в зависимости от концентрации ионов водорода в водном растворе. К ним относятся: лакмус, фенолфталеин (бесцветный до pH=9, pH>9 – малиновый), метилоранж (желтый до pH>5, 3<pH<5 – оранжевый, pH<3 – красный). На практике используется универсальный кислотно-щелочной индикатор, с помощью которого pH можно измерить с точность до 1. Его окраска изменяется от красного до светло зеленого в нейтральной среде, и фиолетовый в щелочной среде. Частота этой окраски зависит от частоты вещества. Гидролиз солей. Гидролиз солей – это их необратимое взаимодействие с водой, гидролизу подвергаются соли образованные сильным основанием и слабой кислотой (Na2CO3), а также соли образованные сильной кислотой и слабым основанием (Al2(SO4)3), при растворении таких солей в воде происходит их гидролиз. 1.
Гидролиз таких солей происходит за счет связывания катионов металла гидроксильными ионами воды. В растворе появляется избыток катионов H, pH водных растворов таких солей меньше 5, значит, водные растворы таких солей являются слабыми кислотами. Пример: ZnCl2, FeCl3 их водные растворы слабые кислоты. Часто поверхность металлов перед нанесением покрытия «травят» кислотами для удаления пленок окислов (используя их как слабые электролиты). 2.
Такие соли являются слабыми щелочами. Таким образом, процессы гидролиза позволяют использовать их водные растворы как слабые кислоты или как слабые основания.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 400; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.91.157 (0.006 с.) |

 >0, H2>H1,
>0, H2>H1,  ;
;
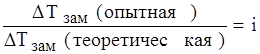 , где
, где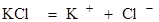
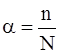 - отношение числа молекул распавшихся на ионы (n) к общему числу растворенных молекул (N).
- отношение числа молекул распавшихся на ионы (n) к общему числу растворенных молекул (N).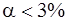 и сильные
и сильные  между 0,03 и 0,3 электролиты средней силы.
между 0,03 и 0,3 электролиты средней силы.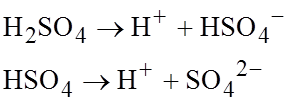
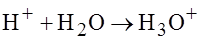 с образованием иона гидраксония.
с образованием иона гидраксония. ; это электролиты, в водных растворах которых присутствуют анионогидраксильной группы (OH – гидроксильный анион) и катионы Me (
; это электролиты, в водных растворах которых присутствуют анионогидраксильной группы (OH – гидроксильный анион) и катионы Me (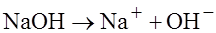 ). Растворы гидроксидов, щелочных и щелочноземельных металлов называют щелочами. В них всегда присутствует OH и в целом водные растворы, в которых присутствует гидроксид-ион, называют щелочными.
). Растворы гидроксидов, щелочных и щелочноземельных металлов называют щелочами. В них всегда присутствует OH и в целом водные растворы, в которых присутствует гидроксид-ион, называют щелочными. .
.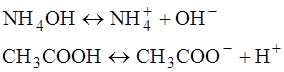
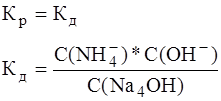
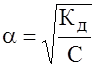
 - степень диссоциации электролита;
- степень диссоциации электролита;