
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электролиз водного раствора KIСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Повторите опыт 2.1, используя 0,5 М раствора KI. Обратите внимание на выделение пузырьков газа на катоде. Что наблюдается в анодном пространстве? Опыт проводите в течение 2–3 мин, после чего выключите выпрямитель, осторожно, не перемешивая содержимое электролизера, достаньте электроды. В катодное пространство добавьте несколько капель фенолфталеина, в анодное – раствора крахмала. Как изменилась окраска растворов в обоих случаях? Появление малиновой окраски в катодном пространстве свидетельствует об изменении характера среды. Какая среда образовалась в катодном пространстве и какой газ выделился на катоде? Восстанавливаются ли ионы калия на катоде и как это связано с их активностью? Почему раствор в анодном пространстве окрасился в синий цвет? Какие ионы окислились на аноде? Согласуются ли полученные результаты с теоретическими положениями? Исходя из результатов опыта составьте схему электролиза раствора KI. на графитовых электродах, запишите уравнения анодно-катодных процессов, а также уравнения вторичных процессов, протекающих на катоде. Составьте суммарное уравнение. Вылейте отработанный раствор в сосуд для отходов, тщательно промойте электролизер водой. Обработайте электроды: катод в 10 %-ном растворе HCl, анод в 5 %-ном растворе Na2S2O3, после чего тщательно промойте электроды водой и просушите салфеткой.
Электролиз водного раствора NaCl Используя методику предыдущих опытов 2.1и 2.2, проведите электролиз 0,5 М раствора NaCl. Обратите внимание на выделение пузырьков газа на обоих электродах. Спустя 2–3 мин после начала опыта отключите электролизер от источника и осторожно достаньте электроды. В катодное пространство добавьте несколько капель фенолфталеина, в анодное – иодокрахмального раствора (крахмал + KI). Как изменилась окраска растворов в обоих случаях? Какая среда образовалась в катодном пространстве и какой газ выделился на катоде? Восстанавливались ли ионы натрия на катоде и как это связано с их активностью? Объясните, почему раствор в анодном пространстве окрасился в синий цвет? Объясните влияние поляризации и перенапряжения на характер анодной реакции. Какие ионы окислились на аноде? Запишите уравнение качественной реакции на молекулярный хлор. Согласуются ли полученные данные с теоретическими положениями? Исходя из результатов опыта составьте схему электролиза раствора NaCl на графитовых электродах, запишите уравнения анодно-катодных процессов, а также уравнения вторичных процессов, протекающих на катоде. Составьте суммарное уравнение. Обработайте электроды, как указано в предыдущем опыте. Вылейте отработанный раствор в сосуд для отходов и промойте тщательно электролизер и электроды водой. При анализе результатов ответьте на поставленные в опытах вопросы и сделайте обобщенный вывод об особенностях процессов электролиза водных растворов электролитов на инертных электродах. Какие из ионов восстанавливались на катоде и окислялись на аноде? Как это связано с их активностью? Исходя из результатов опыта, укажите основные факторы, определяющие природу продуктов электролиза.
3. Контрольные вопросы
1. Составьте схему электролиза 1М раствора AgNO3 на инертных электродах. Запишите уравнения анодно-катодных процессов и суммарное уравнение электролиза. Рассчитайте выход по току(Вт), если за 25мин. при силе тока 3А масса катода увеличилась на 4,8г. Какое вещество и сколько его по массе и объему (н.у.) выделилось на аноде? Как изменятся процессы на аноде и катоде, если электролиз раствора AgNO3 проводить на электродах из серебра? Составьте схему электролиза и уравнения анодно-катодных процессов. 2. Приведите схему электролизной системы для получения металлического кальция. Запишите уравнения электродных реакций и рассчитайте количество электричества, необходимое для получения 1 моля кальция. 3. Составьте простейшую электрохимическую систему для получения на стальной детали никелевого покрытия и запишите уравнения анодно-катодных процессов Рассчитайте, какое время потребуется для нанесения покрытия из никеля (r = 8,7 г/см3) толщиной 8мкм на стальную деталь, поверхность которой равна 500 см2, при силе тока 12А и выходе по току 100%.
Литература 1. Стромберг, А. Г. Физическая химия / А. Г. Стромберг, Д.П. Семченко. – М.: Высш. шк., 1988. 2. Коровин, Н. В. Общая химия / Н. В. Коровин. – М.: Высш. шк., 2000. 3.Фролов, В. В. Химия / В. В. Фролов. – М.: Высш. шк., 1986. 4. Боднарь, И. В. Метод. пособие к решению задач по курсу «Химия» / И. В. Боднарь, А. П. Молочко, Н. П. Соловей. – Минск: БГУИР, 2001.
Лабораторная работа № 4 ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ И МЕТОДЫ ЗАЩИТЫ ОТ КОРРОЗИИ Цель работы: на конкретных примерах ознакомиться с основными видами электрохимической коррозии и методами защиты металлов от коррозии. 1. Теоретическая часть Коррозией называется самопроизвольный процесс разрушения металлов под воздействием окружающей среды. Критерием самопроизвольности процессов коррозии является термодинамическая нестабильность металлов и уменьшение свободной энергии Гиббса (∆ G) при переходе их в окисленное состояние. Скорость коррозии зависит от активности металла, характера коррозионной среды, условий взаимодействия с ней и природы продуктов коррозии. В зависимости от условий протекания коррозия делится на атмосферную, почвенную, в среде электролита и др. По механизму протекания коррозионных процессов различают химическую и электрохимическую коррозию. Химическая коррозия протекает без возникновения электрического тока: газовая – в газах или парах без конденсата влаги на поверхности металла (окисление металлов под действием О2, Cl2 и т.д. при высоких температурах); жидкостная – в растворах неэлектролитов (органические жидкости). Основные продукты химической коррозии – оксидные пленки, пассивирующие поверхность металлов. Электрохимическая коррозия – это окисление металлов в среде электролита с возникновением электрического тока. Причиной электрохимической коррозии являетсяконтакт металлов, различных по химической природе, неоднородность металлов по химическому и фазовому составу, наличие нарушенных оксидных или других пленок, примесей и др. В результате в присутствии электролита возникают короткозамкнутые макро‑ или микрогальванические элементы, в которых протекают сопряженные анодно - катодные процессы. Следует заметить, что анодом является металл с меньшим значением j; катодные участки – это металл или примесные центры с большим значением j. Таким образом, электрохимическая коррозия – это анодное окисление металла с катодным восстановлением окислителя окружающей среды. Врезультате окисления анода электроны перемещаются к катодным участкам и поляризуют их, т.е.уменьшают их потенциалы. Окислитель среды, связывающий эти электроны, называется деполяризатором. Если окислителем являются ионы Н+, то коррозия протекает с водородной деполяризацией. В наиболее простом виде она может быть выражена уравнениями A: К: 2H+ + 2e = H2 (pH < 7), 2H2O + 2e = H2 + 2OH (pH ³ 7) Как правило, с водороднойдеполяризацией корродируют металлы высокой химической активности, так как условием протекания электрохимической коррозии является положительный знак ЭДС( Если окислителем является О2, то коррозия протекает с кислородной деполяризацией и выражается уравнениями
С кислородной деполяризацией корродируют все металлы, за исключением благородных или пассивирующихся. Термодинамическим условием протекания коррозии является D G 0<0 Скорость электрохимической коррозии зависит от активности металла, величины рН электролита, присутствия активаторов коррозии (О2, Cl- и др.), температуры, природы катодных участков и др. Так, например, скорость коррозии с водородной деполяризацией может быть замедлена снижением температуры, увеличением рН, очисткой металлов от примесей, катализирующих выделение Н2 (Со, Ni, Pt и др.). При кислородной деполяризации скорость коррозии замедляется при уменьшении концентрации О2 (деаэрация), снижении его парциального давления, введении в электролит восстановителя. Активирующее действие ионов Сl- (соленые почвы, морская вода и др.) объясняется их высокой адсорбируемостью на поверхности металлов, разрушением пассивирующих оксидных пленок или предотвращением их образования. Особенно большое влияние оказывают ионы Cl- на коррозию Al, Cr, Fe, Ni и др. Кроме того, все металлы, за исключением Ag, Рb, образуют хорошо растворимые хлориды, что также способствует коррозии. И наоборот, вторичные реакции, приводящие к образованию, например, основных гидроксидов Fe(ОН)2 или Fe(OH)3, труднорастворимых в нейтральной или щелочной средах, тормозят коррозионные процессы. Гидроксиды же амфотерных металлов (Zn, Cr, Sn, Al и др.) нерастворимы только в нейтральных средах, поэтому для таких металлов опасны не только кислая, но и щелочная среды. Рассмотрим термодинамическую возможность коррозии стальной детали с медными заклепками в условиях влажной атмосферы (Н2О, О2), pH = 7. В результате контакта Fe с Cu возникает короткозамкнутый гальванический элемент по схеме
2e
А (-) Fe H2O, O2 Cu К (+) pH = 7
A: K:
Возникающая при этом ЭДС равна
а так как
Для борьбы с коррозией разрабатываются разнообразные способы защиты, выбор которых зависит от природы защищаемого металла, вида и габаритов изделий или оборудования, условий их эксплуатации, природы коррозионной среды и т.д. Все методы защиты условно делятся на следующие группы: а) легирование металлов; б) защитные покрытия (неметаллические и металлические); в) электрохимическая защита (протекторная и электрозащита); г) изменение свойств коррозионной среды. Остановимся подробнее на отдельных из перечисленных методов защиты. Неметаллические защитные покрытия. Они могут быть как органическими (лаки, краски, смолы, полимерные пленки и др.), так и неорганическими (эмали, соединения хрома, фосфора и др.). Оксидирование, химическое и электрохимическое (анодирование), – образование на поверхности металлов пассивирующих оксидных пленок. Анодное оксидирование (анодирование) широко используется для повышения коррозионной стойкости таких металлов, как Al, Ti, Nb, Ta и др. Кроме того, такие защитные пленки имеют высокую твердость, эластичность, электросопротивление (1014 Ом×см). Анодирование используется для получения изолирующих слоев на лентах, применяемых в электрических конденсаторах и других устройствах. При анодировании алюминия электролитом служат растворы хромовой, серной, щавелевой или лимонной кислот. Катодом выбирают металл, не взаимодействующий с электролитом, чаще всего свинец или сталь, анодом – изделие из алюминия. Схему для получения анодированного алюминия можно представить в виде
H+ SO42– H2O H2O
4Al + 3O2 = 2Al2O3.
Металлические покрытия: анодные – металл покрытия имеет меньший потенциал, чем защищаемый. В случае нарушения целостности анодного покрытия возникает гальванический элемент, в котором анодом служит покрытие и корродирует, а изделие является катодом и не подвергается коррозии. Катодные покрытия – металл покрытия имеет больший потенциал, чем защищаемый В случае повреждения катодного покрытия защищаемый металл служит анодом в образующемся гальваническом элементе и коррозия его усиливается, а покрытие является катодом и не подвергается коррозии. Более надежным является анодное покрытие. Электрохимическая защита – протекторная и электрозащита (катодная). Протекторная защита – это присоединение к защищаемой конструкции вспомогательного электрода – протектора, имеющего потенциал меньший, чем у защищаемого металла конструкции. Вследствие образования макрогальванического элемента протектор, служащий анодом, разрушается, а на защищаемой конструкции – катоде идут процессы восстановления окислителя среды. Протектор при работе не должен покрываться оксидными пленками или труднорастворимыми соединениями. Используется для защиты крупногабаритных изделий в условиях хорошо проводящей среды. В условиях плохо проводящей среды используют катодную защиту – подсоединение защищаемой конструкции к отрицательному полюсу внешнего источника тока, а к положительному полюсу – вспомогательного электрода, любого по активности. Через такую систему пропускают электрический ток. В результате создается электролизная система, в которой защищаемая конструкция является катодом, на нем идут процессы восстановления окислителя из окружающей среды. На положительном электроде (аноде) идут процессы окисления: самого анода (электрод растворимый) или восстановителя среды (электрод инертный). Например, приведем схему защиты подземного стального оборудования в условиях нейтральной почвы (Н2О, О2, Na+, К+ и др.). Составим схему катодной защиты, используя в качестве вспомогательных электродов: а) отходы железа; б) графитовый стержень:
а) б)
2. Экспериментальная часть 2.1. Коррозия, возникающая при контакте двух металлов, различных по природе
Порядок выполнения опыта. В стеклянную трубку, согнутую под углом, поместите гранулу цинка и добавьте 3–4 мл 0,01 н раствора НClили H2SO4. Что наблюдаете? Какой газ и почему выделяется на цинковой грануле? Запишите уравнение химической окислительно-восстановительной реакции. Возьмите полоску из меди и, поместив ее в стеклянную трубку, приведите в контакт с раствором кислоты таким образом, чтобы она не касалась гранулы цинка. Что наблюдаете? Объясните, почему отсутствуют признаки реакции? Затем медную пластинку приведите в контакт с гранулой цинка. Что наблюдаете? На каком металле выделяются пузырьки газа? Сравните интенсивность их выделения в первом и в данном случаях. Объясните, почему при контакте цинка и меди интенсивность выделения пузырьков газа на меди значительно больше. Составьте электрохимическую схему короткозамкнутого гальванического элемента (типа Вольта), образующегося при контакте цинка и меди. Установите, какой металл является анодом, какой катодом. Запишите уравнения анодно-катодных процессов коррозии и суммарное уравнение электрохимической реакции. При оформлении результатов опыта: Объясните, какой металл подвергается коррозии и с какой деполяризацией? Возможна ли в таких условиях коррозия меди? Ответ необходимо обосновать. Как называется такая коррозия? Напишите обобщенный вывод, следующий из результатов опыта.
2.2. Коррозия, возникающая при образовании микрогальванопар
Порядок выполнения опыта. Поместите в пробирку гранулу цинка, налейте 2–3 мл разбавленного раствора H2SO4 и добавьте несколько капель раствора сульфата меди CuSO4. Запишите результаты наблюдений. 1. Напишите уравнения химических окислительно-восстанови-тельных реакций взаимодействия цинка с раствором CuSO4 и цинка с раствором H2SO4 в молекулярной и краткой ионной формах, укажите окислитель и восстановитель в каждой реакции. Сравните окислительные свойства ионов Cu2+ и Н+(по значениям электродных потенциалов) и объясните, почему реакция взаимодействия цинка и CuSO4 предпочтительней. Как изменилась поверхность цинковой гранулы, что выделилось на ней?Объясните обесцвечиваниераствора. Учитывая, что процесс идет в присутствии кислотыH2SO4, объясните, какой газ и на каких участках выделяется. 2. Составьте электрохимическую схему микрогальванических элементов, образующихся в результате вытеснения меди из раствора CuSO4 и выделения ее на цинке, укажите какой (и почему) металл является анодом, какой катодом. 3. Запишите уравнения анодно-катодных процессов коррозии и суммарное уравнение электрохимической реакции. Какой металл подвергается коррозии? 4. В каких случаях имеет место коррозия при образовании микрогальванопар? 2.3. Активирующее действие ионов CI- на процессы коррозии
Порядок выполнения опыта. Налейте в две пробирки по 2–3 мл раствора CuSO4, подкисленного разбавленным раствором H2SO4. В каждую из пробирок поместите по кусочку Al (в виде гранул или проволоки). В одну из пробирок добавьте несколько капель раствора NaCl. Запишите результаты наблюдений. При оформлении результатов опыта выполните следующие задания и ответьте на вопросы: 1. Объясните отсутствие признаков реакции в первой пробирке (без NaCl) и интенсивное выделение пузырьков газа, наблюдаемое во второй пробирке, спустя 3–5 мин после добавления раствора NaCl. 2. Напишите уравнения химических реакций, протекающих в пробирке с раствором NaCl, учитывая активирующее действие ионов Cl-, связанное с разрушением пассивирующих слоев на металлах (оксидных пленок), а также результаты опыта 2.2. 3. Составьте схему микрогальванических элементов, образующихся при восстановлении из раствора CuSO4 меди на грануле алюминия в присутствии H2SO4, и уравнения анодно-катодных процессов коррозии. Какой металл подвергается коррозии? С какой деполяризацией протекает коррозия? 4. Напишите обстоятельный вывод о влиянии ионов хлора на процессы коррозии металлов 2.4. Анодные и катодные защитные покрытия
Порядок выполнения опыта. В два химических стакана емкостью 50 мл налейте по 5–7 мл 3 %‑ного раствора NaCl и добавьте в каждый из них по несколько капель раствора К3[Fe(CN)6] (индикатора на ионы Fe2+). Опустите в один стакан кусочек оцинкованного железа, а в другой – луженого (покрытого оловом), предварительно сделав на их поверхности глубокие царапины. Спустя 2-3 мин тщательно осмотрите места царапин в оцинкованном и луженом железе. Запишите результаты наблюдений. При оформлении анализа результатов опыта выполните следующие задания и ответьте на вопросы: 1. Объясните появление синей окраски в стакане с луженым железом и отсутствие последней в стакане с оцинкованным железом, записав схемы образующихся макрогальванических элементов в обоих случаях, уравнения анодно-катодных процессов коррозии, а такжеуравнение образования турнбулевой синиFe3[Fe(CN)6]2. 2. Запишите уравнения вторичных реакций и суммарные уравнения коррозии. Какое влияние оказывает природа вторичных продуктов на скорость коррозии? 3. Сделайте вывод о надежности защитных покрытий.
2.5. Протекторная защита
Порядок выполнения опыта. Возьмите два химических стакана емкостью 50 мл. В один из них поместите гранулу свинца, во второй- гранулы цинка и свинца так, чтобы они имели хороший контакт. Осторожно прилейте в оба стакана по 5–10 мл разбавленного раствора (0,2–0,4 н) СН3СООН и несколько капель раствора KI (индикатора на ионы Pb2+).Запишите результаты наблюдений. В каком из стаканов появилась золотистая окраска ( PbI2 )? Объясните появление ее в первом стакане и отсутствие во втором. При оформлении результатов опыта выполните следующие задания и ответьте на вопросы, поставленные в опыте: 1. Напишите уравнения химических реакций взаимодействия свинца с уксусной кислотой (первичная реакция) и образования PbI2 (вторичная реакция), протекающих в первом стакане. Оцените коррозионную устойчивость свинца в данном электролите. 2. Составьте электрохимическую схему образующегося макрогальванического элемента во втором стакане, уравнения анодно-катодных процессов коррозии. Разрушается ли свинец в данном случае? Какой металл является протектором и почему? Какие требования прдьявляются к протектору? 3. Оцените надежность протекторной защиты и в каких случаях на практике ее можно использовать? 2.6. Катодная защита (электрозащита)
Порядок выполнения опыта. В химический стакан емкостью 50 мл налейте 30–35 мл –3%-ного раствора NaCl и добавьте несколько капель индикатора на ионы Fe2+- K3[Fe(CN)6]. Опустите стальной электрод и спустя 2-3мин запишите результаты наблюдений. Обратите внимание на поверхность электрода.Почему синее окрашивание появляется лишь на отдельных участках стального образца? О чем это свидетельствует? Запишите схемы микрогальванических элементов, образующихся на стальном электроде, учитывая, что участки чистого железа яляются анодными, а участки с примесями являются катодными. Раствор NaCl имеет нейтральную среду (РН=7). Запишите уравнения реакций, протекающих на аноде и катоде. С какой деполяризацией протекает коррозия стального образца? Запишите химическое уравнение образования турнбулевой сини Fe3[Fe(CN)6]2. Для проведения катодной защиты стального электрода в химический стакан емкостью 200 мл налейте до 2/3 объема такого же раствора NaCl с добавлением K3[Fe(CN)6]. Закрепите стальной электрод в штативе для электродов и, не опуская в стакан с электролитом, подсоедините угольный электрод к положительному полюсу источника постоянного тока, стальной – к отрицательному. Опуская электроды в стакан с раствором NaCl, одновременно включайте источник тока, пропуская ток в течение 1–2 мин при напряжении не более 10 В. Что Вы наблюдаете на стальном электроде и на угольном? Появилось ли синее окрашивание на стальном электроде?
|
|||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1657; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.183.77 (0.011 с.) |

 ;
;
 ) или
) или  .
.
 ;
; .
.
 , B -0,44 + 0,34
, B -0,44 + 0,34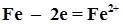
 B;
B; -
-  B.
B. В,
В, , то коррозия стальных изделий в таких условиях термодинамически возможна. Однако скорость коррозионных процессов снижается со временем вследствие вторичных реакций образования малорастворимых в нейтральной и щелочной средах основных гидроксидов железа и образования ржавчины:
, то коррозия стальных изделий в таких условиях термодинамически возможна. Однако скорость коррозионных процессов снижается со временем вследствие вторичных реакций образования малорастворимых в нейтральной и щелочной средах основных гидроксидов железа и образования ржавчины:
 – ржавчина.
– ржавчина.

 K: 12H+ + 12e = 6H2; A: 6H2O – 12e = 3O2 + 12H+.
K: 12H+ + 12e = 6H2; A: 6H2O – 12e = 3O2 + 12H+.




