
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ионное произведение воды. Водородный показательСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Вода, являясь слабым электролитом, диссоциирует по уравнению Н2О ↔ Н+ + ОН–. Согласно уравнению (2.8)
Произведение КД и
Тогда
В нейтральных средах На практике характер водной среды растворов оценивают с помощью водородного показателя рН или гидроксильного показателя рОН. Водородный показатель (рН) или гидроксильный показатель (рОН) – отрицательный десятичный логарифм мольной концентрации ионов водорода ( pН = - lg
Тогда при 298К: рН = рОН = 7 - нейтральная среда; (2.14) рН < 7 до 0 – кислая среда; (2.15) рН > 7 до 14 – щелочная среда. (2.16) При этом рН +рОН= 14.
1.2. Электродные потенциалы
Система, состоящая из двух контактирующих фаз: одна из которых вещество с металлической проводимостью, другая – с ионной проводимостью называется электродом. Электроды делятся на инертные, не участвующие в окислительно-восстановительном процессе, например графитовые или платиновые, и активные, выполненные из любого металла, кроме благородного, способные сами окисляться. Наряду с металлическими к активным электродам относятся и газовые, в частности водородный и кислородный. Рассмотрим систему: активный металлический электрод – водный раствор его соли. Под действием полярных молекул воды ионы металла поверхностного слоя в гидратированном состоянии переходят в раствор. В результате на поверхности металла остается нескомпенсированный отрицательный заряд, в растворе создается избыточный положительный заряд с максимальной плотностью в слое, прилегающем к электроду. По мере перехода ионов металла в раствор увеличивается как отрицательный заряд электрода, так и положительный заряд раствора, при этом ввиду обратимости процесса ионы металла из раствора все чаще притягиваются на металлический электрод. Наконец скорости прямого и обратного процессов сравняются, т.е. установится химическое равновесие, которое можно выразить уравнением
Me + mH20 ↔ Men+·mH20 + nē. (2.17)
Состояние равновесия зависит как от активности металла, так и от концентрации его ионов в растворе и численно характеризуется константой равновесия, которая для данной гетерогенной системы при
В случае активных металлов (Zn, Fe, Cr и др.) равновесие (2.17) смещено вправо ( В случае малоактивных металлов (Cu, Ag, Hg и др.) равновесие (2.17) смещается влево ( Таким образом, на границе металл-раствор электролита возникает двойной электрический слой, т.е. разность потенциалов между электродом и раствором электролита. Потенциал, возникающий на металлическом электроде, находящемся в равновесии с собственными ионами в растворе электролита, называется равновесным электродным потенциалом ( Схематически электроды записываются в молекулярной или ионной формах, например:
Zn │ZnSO4 или Zn│Zn2+; Cu│CuSO4 или Cu│Cu2+. Газовые (водородный и кислородный) электроды записываются в виде
Pt, H2│H2SO4 или Pt, H2│2H+; Pt, О2│2КОН или Pt, О2│2ОH-.
Вертикальная черта характеризует поверхность раздела между двумя фазами и показывает обратимость между восстановленными (Zn, Cu, H2, OH-) и окисленными (Zn2+, Cu2+, 2H+, O2) формами электродов, что можно выразить уравнениями соответствующих электродных реакций:
Zn – 2e = Zn2+ – реакции окисления – Cu –2e = Cu2+ Zn2+ + 2e =Zn – реакции восстановления – Cu2+ + 2e = Cu
Для газовых электродов:
H2 - 2e = 2H+ – реакции окисления – 2OH- -2e = 1/2O2 + H2O 2H+ + 2e = H2 – реакции восстановления – Электроды, обратимые относительно собственных ионов в растворе электролита, называются электродами 1-го рода. Численные значения равновесных электродных потенциалов (
где Переходя от натурального логарифма к десятичному (коэффициент перевода 2,3) и подставляя численные значения постоянных
Принимая
Из уравнений (2.20), (2.23) и (2.24) следует, что при С учетом вышесказанного, используя табличное значение
Значения
Из двух возможных реакций предпочтительней та, для которой неравенство (2.27) выполняется в большей степени. Следует заметить также, что отсутствие признаков реакции при выполнении условия (2.27) в ряде случаев связано с торможением процесса, обусловленного наличием пассивирующих (оксидных) слоев на поверхности активных металлов (Al2O3, Cr2O3 и др.). 1.3. Гальванические элементы
Замкнутая электрохимическая система, состоящая из двух электродов, различных по химической природе, называется химическим гальваническим элементом. Электрод с меньшим значением Классическим примером химического гальванического элемента служит элемент Даниэля-Якоби, состоящий из цинкового электрода,опущенного в 1М раствор ZnSO4и медного электрода в 1М раствореCuSO4. Так как А(-):Zn│ZnSO4║CuSO4│Cu:К(+) или в ионном А(-):Zn│Zn2+║ Cu2+│Cu:К(+) М 1 М 1моль/л 1моль/л Двойная черта в схеме показывает, что два электролита пространственно разделены. Они соединяются посредством проводника второго рода (электролитического мостика). Во внешней цепи электроды соединены металлическим проводником первого рода. При соединении электродов равновесие нарушается вследствие перехода электронов по внешней цепи от цинкового электрода (анода) к медному (катоду), а анионов А: Zn – 2e = Zn2+, К: Cu2+ + 2e = Cu0, Суммируя электродные реакции, получим токообразующую реакцию:
где При условиях, отличных от стандартных, значения В результате самопроизвольных процессов система (гальванический элемент) совершает максимально полезную электрическую работу
где
С другой стороны, при обратимом процессе (
Сопоставляя уравнения (2.28) и (2.29), имеем
Но
где 0,059 = 2,3×8,314×298/96500.
Так как А: Zn – 2e = Zn2+, К: 2H+ + 2e = H20. Суммируя электродные реакции, получим
Первоначальное значение ЭДС равно контактной разности стандартных потенциалов цинкового и медного электродов, т.е.
С течением времени ЭДС элемента падает, что вызвано изменением величин электродных потенциалов катода и анода. Явление смещения величин электродных потенциалов от их равновесных значений при прохождении тока называется поляризацией электродов. В зависимости от природы возникновения поляризация делится на химическую и концентрационную. Химическая поляризация обусловлена изменением химической природы электродов при выделении на них продуктов электрохимической реакции. Например, в элементе Вольта потенциал катода (медного электрода) уменьшается за счет выделения на нем молекулярного водорода (Н2) и изменения химической природы электрода. При этом потенциал катода в пределе становится равным потенциалу водородного электрода, т.е.
Концентрационная поляризация обусловлена изменением концентрации потенциалопределяющих ионов в приэлектродных слоях при прохождении тока. При этом потенциал анода увеличивается за счет возрастания концентрации положительных ионов при окислении анода (например ионов Zn2+ в элементе Вольта). Таким образом, в указанном элементе анод поляризуется концентрационно, а катод – химически. В химических элементах типа Даниэля-Якоби имеет место концентрационная поляризация. При этом потенциал анода растет за счет увеличения концентрации положительных ионов при окислении анода, а потенциал катода уменьшается за счет снижения концентрации положительных ионов при их восстановлении на катоде. Поляризация электродов при работе гальванических элементов тормозит электрохимические процессы и, как следствие, обусловливает уменьшение ЭДС элементов. Явление уменьшения поляризации называется деполяризацией. Механическое удаление пузырьков газа с поверхности электрода или перемешивание электролита, снижающее концентрацию потенциалопределяющих ионов в приэлектродных слоях, – это физическая деполяризация, а введение в электролит химических соединений – сильных окислителей (K2Cr2O7, MnO2, O2 и др.) и веществ, связывающих избыточные ионы в труднорастворимые или малодиссоциирующие соединения или комплексы – химическая деполяризация. Например, для уменьшения химической поляризации катода в элементе Вольта в катодное пространство добавляется несколько капель бихромата калия K2Cr2O7. При этом протекает окислительно-восстановительная реакция, приводящая к окислению восстановленного на катоде водорода (Н2) и,как следствие, к увеличению ЭДС:
Зависимость величины электродного потенциала от концентрации потенциалопределяющих ионов обусловливает существование концентрационных гальванических элементов,например
А(-):Ni│NiSO4║NiSO4│Ni:К(+) или А(-):Ni│Ni2+║Ni2+│Ni:К(+) C1 < C2 C1 < C2 Электрод в растворе электролита с меньшей концентрацией – анод (меньшее значение
А: Ni – 2e = Ni2+, К: Ni2+ + 2e = Ni.
Возникающая при этом ЭДС зависит от соотношения концентраций и определяется по уравнению
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 427; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.198.250 (0.008 с.) |


 дает новую постоянную, называемую константой воды (
дает новую постоянную, называемую константой воды (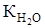 ) или ионным произведением воды (
) или ионным произведением воды (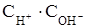 ). Для воды и водных растворов
). Для воды и водных растворов  (2.13)
(2.13)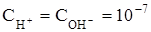 моль/л. В кислых –
моль/л. В кислых –  моль/л, достигая максимального значения 1 моль/л. В щелочных –
моль/л, достигая максимального значения 1 моль/л. В щелочных –  при минимальном значении 10-14 моль/л.
при минимальном значении 10-14 моль/л.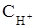 , моль/л) в растворе или мольной концентрации ионов ОН- (Сон-, моль/л) в растворе, т. е.
, моль/л) в растворе или мольной концентрации ионов ОН- (Сон-, моль/л) в растворе, т. е.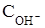 .
. равна
равна . (2.18)
. (2.18)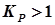 ). При погружении электрода из указанных металлов в водный раствор его соли для достижения равновесной концентрации ионы металла будут переходить в раствор и поверхность электрода зарядится отрицательно, а раствор электролита – положительно.
). При погружении электрода из указанных металлов в водный раствор его соли для достижения равновесной концентрации ионы металла будут переходить в раствор и поверхность электрода зарядится отрицательно, а раствор электролита – положительно. ). Если электрод из таких металлов погрузить в водный раствор его соли, то ионы металла из раствора будут переходить на поверхность металла и поверхность электрода зарядится положительно, а раствор электролита – отрицательно.
). Если электрод из таких металлов погрузить в водный раствор его соли, то ионы металла из раствора будут переходить на поверхность металла и поверхность электрода зарядится положительно, а раствор электролита – отрицательно. , В). Для активных металлов он отрицателен, для малоактивных положителен.
, В). Для активных металлов он отрицателен, для малоактивных положителен. O2 + H2O + 2e = 2OH-.
O2 + H2O + 2e = 2OH-. ) рассчитываются по уравнению Нернста:
) рассчитываются по уравнению Нернста: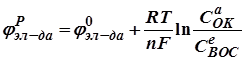 , (2.19)
, (2.19) – стандартный электродный потенциал, В; R – универсальная газовая постоянная, равная 8,314 Дж/моль×К; T – температура, К; F – постоянная Фарадея, равная 96 500 Кл; n – число электронов-участников в данной электродной реакции (для металлических электродов совпадает с зарядом иона металла);
– стандартный электродный потенциал, В; R – универсальная газовая постоянная, равная 8,314 Дж/моль×К; T – температура, К; F – постоянная Фарадея, равная 96 500 Кл; n – число электронов-участников в данной электродной реакции (для металлических электродов совпадает с зарядом иона металла); 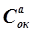 и
и  – концентрации окисленных и восстановленных форм электродов в степени стехиометрических коэффициентов, стоящих в уравнениях соответствующих электродных реакций.
– концентрации окисленных и восстановленных форм электродов в степени стехиометрических коэффициентов, стоящих в уравнениях соответствующих электродных реакций. и
и  , при
, при  298 К получим уравнение Нернста в упрощенном виде, позволяющим вычислять потенциалы металлических и газовых электродов:
298 К получим уравнение Нернста в упрощенном виде, позволяющим вычислять потенциалы металлических и газовых электродов: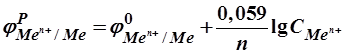 ; (2.20)
; (2.20)
 ; (2.21)
; (2.21) . (2.22)
. (2.22) и
и  равные 1 атм (101 кПа), выражения (2.21, 2.22) примут вид:
равные 1 атм (101 кПа), выражения (2.21, 2.22) примут вид: , (2.23)
, (2.23) . (2.24)
. (2.24) ,
,  ,
,  равных 1 моль/л,
равных 1 моль/л,  . Отсюда стандартный потенциал электрода (
. Отсюда стандартный потенциал электрода ( ) – это потенциал, возникающий на электроде при стандартных условиях (Т = 298 К;
) – это потенциал, возникающий на электроде при стандартных условиях (Т = 298 К;  1 атм;
1 атм;  1 моль/л). Для водородного электрода он принят за нуль, т.е.
1 моль/л). Для водородного электрода он принят за нуль, т.е.  . Для всех остальных электродов
. Для всех остальных электродов 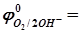 0,4 В и принимая во внимание, что
0,4 В и принимая во внимание, что  ,
, 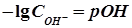 и
и 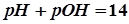 , получим
, получим , (2.25)
, (2.25)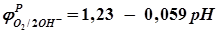 . (2.26)
. (2.26)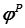 указывают на меру восстановительной способности атомов металлов и Н2 и окислительной способности их ионов и О2. Чем меньше значение
указывают на меру восстановительной способности атомов металлов и Н2 и окислительной способности их ионов и О2. Чем меньше значение  , тем ярче выражены восстановительные свойства (способность окисляться). Чем больше значение
, тем ярче выражены восстановительные свойства (способность окисляться). Чем больше значение  . (2.27)
. (2.27) называется анодом (А(-)), на нем идут процессы окисления. Электрод с большим значением
называется анодом (А(-)), на нем идут процессы окисления. Электрод с большим значением  1 моль/л, то
1 моль/л, то  – 0,76 В;
– 0,76 В;  = + 0,34 В (табл. П. 2). Цинковый электрод имеет меньшее значение электродного потенциала по сравнению с медным, следовательно, цинковый электрод является анодом, медный- катодом. Схема такого элемента в молекулярном виде имеет вид:
= + 0,34 В (табл. П. 2). Цинковый электрод имеет меньшее значение электродного потенциала по сравнению с медным, следовательно, цинковый электрод является анодом, медный- катодом. Схема такого элемента в молекулярном виде имеет вид: по внутренней цепи в обратном направлении. Возникает самопроизвольный анодно-катодный процесс по схеме
по внутренней цепи в обратном направлении. Возникает самопроизвольный анодно-катодный процесс по схеме - 0,76 B;
- 0,76 B;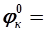 + 0,34 B.
+ 0,34 B. ,
, 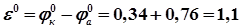 В,
В, – стандартная электродвижущая сила (ЭДС) элемента, В.
– стандартная электродвижущая сила (ЭДС) элемента, В. , равную
, равную , (2.28)
, (2.28) – количество прошедшего электричества, Кл;
– количество прошедшего электричества, Кл; – число электронов-участников в данной электрохимической реакции.
– число электронов-участников в данной электрохимической реакции. ;
;  , (2.29)
, (2.29) (2.30)
(2.30) , где
, где  – константа равновесия, равная в данном случае отношению
– константа равновесия, равная в данном случае отношению 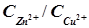 . Тогда
. Тогда (2.31)
(2.31) , (2.32)
, (2.32) Замкнутая электрохимическая система из двух электродов в одном и том же электролите называется химическим гальваническим элементом типа Вольта. Элемент Вольта состоит из медного и цинкового электродов в растворе серной кислоты. Схема его записывается в виде
Замкнутая электрохимическая система из двух электродов в одном и том же электролите называется химическим гальваническим элементом типа Вольта. Элемент Вольта состоит из медного и цинкового электродов в растворе серной кислоты. Схема его записывается в виде , анодом будет цинковый электрод, катодом – медный электрод. Учитывая, что медь не взаимодействует с разбавленной серной кислотой, уравнения анодно-катодных процессов имеют вид
, анодом будет цинковый электрод, катодом – медный электрод. Учитывая, что медь не взаимодействует с разбавленной серной кислотой, уравнения анодно-катодных процессов имеют вид .
.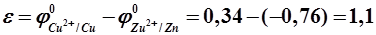 В.
В.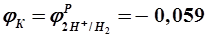 рН.
рН.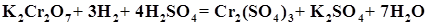


 , где
, где  . (2.33)
. (2.33)


