
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физико-химические основы радиоэлектроникиСодержание книги
Поиск на нашем сайте
ЛАБОРАТОРНЫЙ ПРАКТИКУМ ДЛЯ СТУДЕНТОВ СПЕЦИАЛЬНОСТИ 1-27 01 01 11 «ЭКОНОМИКА И ОРГАНИЗАЦИЯ ПРОИЗВОДСТВА (РАДИОЭЛЕКТРОНИКА И ИНФОРМАЦИОННЫЕ УСЛУГИ)»
Минск 2010
Содержание
Общие требования к составлению отчета по лабораторным работам........................................................................................................... 3
Лабораторная работа № 1 Кинетика физико-химических процессов. Химическое равновесие............................................................................... 5
Лабораторная работа № 2 Электродные потенциалы. Гальванические элементы......................... 18
Лабораторная работа № 3 Электролиз водных растворов электролитов....................................... 34
Лабораторная работа № 4 Электрохимическая коррозия и методы защиты от коррозии........... 41
Приложения................................................................................................ 50
Общие требования к составлению отчета По лабораторным работам
Отчет оформляется студентом индивидуально с учетом задания. Он должен быть составлен аккуратно, грамотно, с последовательным изложением материала. Графики выполняются на миллиметровой бумаге с использованием прямоугольной системы координат. На ось абсцисс откладываются численные значения независимой переменной Х, на ось ординат – значения функции Y. Графики и таблицы должны быть пронумерованы и подписаны (например, «Рис.1», «Табл.1» и т.д.). Расчетные математические формулы, уравнения реакций записываются посередине строки с интервалом от текстовой части. Отчет оформляется по следующей схеме.
Название лабораторной работы Цель работы (приводится к каждой лабораторной работе).
Экспериментальная часть 1. Название опыта (из лабораторного практикума).
1.1. Ход и данные опыта. Используя данную в пособии методику проведения эксперимента, кратко опишите ход опыта, указав основные его этапы. (Исключается переписывание инструкции по выполнению опыта из методического пособия в отчет). При этом непременно приведите уравнение в молекулярной и ионной формах той реакции, которая лежит в основе эксперимента. Укажите также. условия проведения опыта (концентрации веществ, температура и т.д.), обратив внимание на постоянство этих параметров или их изменение.
Данные опыта можно оформить в виде таблицы или в виде краткого описания. Опишите наблюдаемый внешний признак реакции (изменение окраски, выпадение осадка, выделение газа).
1.2. Расчет и анализ данных или анализ результатов наблюдений (для качественного опыта). Приведите расчетные формулы в общем виде, подставьте данные в формулы, учитывая размерность величин, и проведите необходимые расчеты. Постройте, если необходимо, графические зависимости. В анализе данных объясните полученные результаты, т.е.; – установите характер наблюдаемой зависимости; – выясните причину наблюдаемой зависимости, используя теоретический материал; – дайте исчерпывающие ответы на поставленные в каждом опыте вопросы.
1.3. Выводы. Вывод – это краткое сообщение (установлено, показано и т.д.) о полученном результате с элементами обобщения. Установленная в данном опыте зависимость на примере конкретной реакции подается в выводе с использованием обобщенных понятий.
1.4. Контрольные вопросы. Вопросы или условия задач приводятся в полном виде. Ответы следует располагать после каждого вопроса или задачи. Ответы и решение задач должны быть полными и исчерпывающими.
К защите лабораторной работы допускаются студенты, выполнившие данную работу и оформившие отчет в соответствии с вышеуказанными требованиями.
Лабораторная работа № 1 КИНЕТИКА ФИЗИКО-ХИМИЧЕСКИХ ПРОЦЕССОВ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Цель работы: изучить влияние различных факторов на скорость и равновесие физико-химических процессов. 1. Теоретическая часть 1.1. Скорость физико-химических процессов Химическая кинетика – раздел химии, изучающий скорость и механизм протекания физико-химических процессов. Изучение кинетики превращений дает возможность выяснить реальный механизм протекания процесса, позволяет управлять им, осуществлять математическое моделирование, решать задачи по его оптимизации и автоматизации. В химической кинетике различают гомогенные и гетерогенные процессы. Гомогенные процессы протекают во всем объеме, реагирующие вещества находятся в одной фазе, молекулы всех реагирующих веществ находятся в одинаковых условиях. Гетерогенные процессы протекают на границе раздела фаз, реагирующие вещества находятся в различных фазах. Они широко применяются в радиоэлектронике: окисление и травление металлов и полупроводников, получение защитных покрытий и т.д.
В основе физико-химических процессов лежит химическое превращение одних веществ в другие, т.е. химическая реакция. Следовательно, такие физико-химические взаимодействия можно характеризовать скоростью. Скорость физико-химического процесса – изменение количества реагирующих веществ в единицу времени в единице реакционного пространства. Реакционным пространством в гомогенной системе служит объем сосуда, в котором происходит взаимодействие, в гетерогенной – поверхность раздела фаз. Выражение для средней скорости процесса имеет вид
где Dn = n2 – n1, Dt = t2 – t1; n1 и n2 – количество молей изменяющегося в реакции вещества в моменты времени τ1 и τ2;V – объем реакционного пространства, Скорость физико-химического процесса всегда величина положительная, поэтому перед дробью ставят знак Количество вещества (моль), отнесенное к занимаемому им объему (n/V), есть мольная концентрация (С). Поэтому скорость гомогенного процесса можно определить как изменение концентрации одного из реагирующих веществ в единицу времени. Если в моменты времени τ1 и τ2 концентрация реагирующего вещества была соответственно
Скорость гетерогенных процессов измеряется количеством вещества, вступающего в реакцию или образующегося в единицу времени на единицу поверхности. Так как процесс осуществляется не в объеме твердого вещества, а на поверхности, концентрация его остается постоянной, поэтому скорость гетерогенных реакций определяется изменением концентрации газов или жидкостей. Скорость физико-химических процессов зависит от природы реагирующих веществ, их концентрации, температуры, давления (для реакций с участием газов), присутствия в системе катализаторов, от поверхности взаимодействия реагирующих веществ (в случае гетерогенной реакции) и т.д.
|
||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 399; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.201.114 (0.01 с.) |


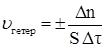 , (2.1)
, (2.1) ; S – площадь межфазной поверхности,
; S – площадь межфазной поверхности,  .
. . Измеряется скорость: моль/л·с, моль/м2·с.
. Измеряется скорость: моль/л·с, моль/м2·с. и
и  , то отношение выражает среднюю скорость гомогенного процесса.
, то отношение выражает среднюю скорость гомогенного процесса. . (2.2)
. (2.2)


