
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
И. В. Боднарь, А. П. Молочко, Н. П. СоловейСодержание книги
Поиск на нашем сайте
БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИНФОРМАТИКИ И РАДИОЭЛЕКТРОНИКИ КАФЕДРА ХИМИИ
И.В. БОДНАРЬ, А.П. МОЛОЧКО, Н.П. СОЛОВЕЙ
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ РАДИОЭЛЕКТРОНИКИ
ЛАБОРАТОРНЫЙ ПРАКТИКУМ ДЛЯ СТУДЕНТОВ СПЕЦИАЛЬНОСТИ 1-27 01 01 11 «ЭКОНОМИКА И ОРГАНИЗАЦИЯ ПРОИЗВОДСТВА (РАДИОЭЛЕКТРОНИКА И ИНФОРМАЦИОННЫЕ УСЛУГИ)»
Минск 2010
Содержание
Общие требования к составлению отчета по лабораторным работам........................................................................................................... 3
Лабораторная работа № 1 Кинетика физико-химических процессов. Химическое равновесие............................................................................... 5
Лабораторная работа № 2 Электродные потенциалы. Гальванические элементы......................... 18
Лабораторная работа № 3 Электролиз водных растворов электролитов....................................... 34
Лабораторная работа № 4 Электрохимическая коррозия и методы защиты от коррозии........... 41
Приложения................................................................................................ 50
Общие требования к составлению отчета По лабораторным работам
Отчет оформляется студентом индивидуально с учетом задания. Он должен быть составлен аккуратно, грамотно, с последовательным изложением материала. Графики выполняются на миллиметровой бумаге с использованием прямоугольной системы координат. На ось абсцисс откладываются численные значения независимой переменной Х, на ось ординат – значения функции Y. Графики и таблицы должны быть пронумерованы и подписаны (например, «Рис.1», «Табл.1» и т.д.). Расчетные математические формулы, уравнения реакций записываются посередине строки с интервалом от текстовой части. Отчет оформляется по следующей схеме.
Название лабораторной работы Цель работы (приводится к каждой лабораторной работе).
Экспериментальная часть 1. Название опыта (из лабораторного практикума).
1.1. Ход и данные опыта. Используя данную в пособии методику проведения эксперимента, кратко опишите ход опыта, указав основные его этапы. (Исключается переписывание инструкции по выполнению опыта из методического пособия в отчет). При этом непременно приведите уравнение в молекулярной и ионной формах той реакции, которая лежит в основе эксперимента. Укажите также. условия проведения опыта (концентрации веществ, температура и т.д.), обратив внимание на постоянство этих параметров или их изменение. Данные опыта можно оформить в виде таблицы или в виде краткого описания. Опишите наблюдаемый внешний признак реакции (изменение окраски, выпадение осадка, выделение газа).
1.2. Расчет и анализ данных или анализ результатов наблюдений (для качественного опыта). Приведите расчетные формулы в общем виде, подставьте данные в формулы, учитывая размерность величин, и проведите необходимые расчеты. Постройте, если необходимо, графические зависимости. В анализе данных объясните полученные результаты, т.е.; – установите характер наблюдаемой зависимости; – выясните причину наблюдаемой зависимости, используя теоретический материал; – дайте исчерпывающие ответы на поставленные в каждом опыте вопросы.
1.3. Выводы. Вывод – это краткое сообщение (установлено, показано и т.д.) о полученном результате с элементами обобщения. Установленная в данном опыте зависимость на примере конкретной реакции подается в выводе с использованием обобщенных понятий.
1.4. Контрольные вопросы. Вопросы или условия задач приводятся в полном виде. Ответы следует располагать после каждого вопроса или задачи. Ответы и решение задач должны быть полными и исчерпывающими.
К защите лабораторной работы допускаются студенты, выполнившие данную работу и оформившие отчет в соответствии с вышеуказанными требованиями.
Лабораторная работа № 1 КИНЕТИКА ФИЗИКО-ХИМИЧЕСКИХ ПРОЦЕССОВ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Цель работы: изучить влияние различных факторов на скорость и равновесие физико-химических процессов. 1. Теоретическая часть 1.1. Скорость физико-химических процессов Химическая кинетика – раздел химии, изучающий скорость и механизм протекания физико-химических процессов. Изучение кинетики превращений дает возможность выяснить реальный механизм протекания процесса, позволяет управлять им, осуществлять математическое моделирование, решать задачи по его оптимизации и автоматизации. В химической кинетике различают гомогенные и гетерогенные процессы. Гомогенные процессы протекают во всем объеме, реагирующие вещества находятся в одной фазе, молекулы всех реагирующих веществ находятся в одинаковых условиях. Гетерогенные процессы протекают на границе раздела фаз, реагирующие вещества находятся в различных фазах. Они широко применяются в радиоэлектронике: окисление и травление металлов и полупроводников, получение защитных покрытий и т.д. В основе физико-химических процессов лежит химическое превращение одних веществ в другие, т.е. химическая реакция. Следовательно, такие физико-химические взаимодействия можно характеризовать скоростью. Скорость физико-химического процесса – изменение количества реагирующих веществ в единицу времени в единице реакционного пространства. Реакционным пространством в гомогенной системе служит объем сосуда, в котором происходит взаимодействие, в гетерогенной – поверхность раздела фаз. Выражение для средней скорости процесса имеет вид
где Dn = n2 – n1, Dt = t2 – t1; n1 и n2 – количество молей изменяющегося в реакции вещества в моменты времени τ1 и τ2;V – объем реакционного пространства, Скорость физико-химического процесса всегда величина положительная, поэтому перед дробью ставят знак Количество вещества (моль), отнесенное к занимаемому им объему (n/V), есть мольная концентрация (С). Поэтому скорость гомогенного процесса можно определить как изменение концентрации одного из реагирующих веществ в единицу времени. Если в моменты времени τ1 и τ2 концентрация реагирующего вещества была соответственно
Скорость гетерогенных процессов измеряется количеством вещества, вступающего в реакцию или образующегося в единицу времени на единицу поверхности. Так как процесс осуществляется не в объеме твердого вещества, а на поверхности, концентрация его остается постоянной, поэтому скорость гетерогенных реакций определяется изменением концентрации газов или жидкостей. Скорость физико-химических процессов зависит от природы реагирующих веществ, их концентрации, температуры, давления (для реакций с участием газов), присутствия в системе катализаторов, от поверхности взаимодействия реагирующих веществ (в случае гетерогенной реакции) и т.д.
Реагирующих веществ Необходимым условием протекания физико-химических процессов является взаимное столкновение взаимодействующих частиц. Точнее говоря, при взаимодействии молекулы должны сблизится настолько, чтобы атомы одного вещества испытывали действие электрических полей, созданныхдругими атомами. Только при таких условиях могут произойти те переходы электронов и перегруппировки атомов, в результате которых образуются новые вещества. Естественно, столкновение в некотором объеме происходит тем чаще, чем больше частиц находится в этом объеме, т. е. чем больше концентрация. Зависимость скорости реакции от концентрации реагирующих веществ выражается основным законом химической кинетики – законом действия масс (ЗДМ): скорость гомогенной химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции. Для реакции aA + bB = cC + dD
где Физический смысл константы скорости (k): k показывает, с какой скоростью протекает реакция при концентрациях взаимодействующих веществ, равных 1 моль/л.
Константа скорости k зависит от природы реагирующих веществ, их структуры, от температуры, присутствия катализатора, но не зависит от концентрации реагирующих веществ и парциальных давлений (для газов). Если реагирующие вещества находятся в газообразном состоянии, то вместо концентраций в законе действия масс можно использовать их парциальные давления (учитывая уравнение Клапейрона-Менделеева Р = сRТ). Тогда
В случае гетерогенных процессов в закон действия масс входят концентрации только тех веществ, которые находятся в газовой фазе или растворе. Концентрации веществ, находящихся в твердой фазе, постоянны и включены в константу скорости. Тогда ЗДМ для нижеприведенных реакций имеет вид:
Так как гетерогенные процессы протекают на границе раздела фаз, то чем больше поверхность взаимодействия, тем больше вероятность столкновения взаимодействующих частиц, находящихся в разных фазах, и, следовательно, больше скорость гетерогенной реакции. Закон действия масс справедлив только для простых реакций, протекающих в газах или растворах. Для сложных гомогенных реакций закон применим для каждой отдельной стадии, но не для всей реакции в целом. Скорость сложных реакций определяется самой медленной (лимитирующей) стадией. В гетерогенных процессах, отличающихся сложностью и многостадийностью (подвод реагирующих веществ к границе раздела фаз, химическая реакция на поверхности, отвод продуктов реакции от поверхности и т.д.), закон действия масс применим лишь тогда, когда лимитирующей стадией является непосредственно сама химическая реакция.
Электролитами называются вещества, которые в растворе (или в расплаве) полностью или частично состоят из ионов и способны проводить электрический ток. Электропроводность электролитов обусловлена направленным движением ионов в электрическом поле, поэтому их называют ионными проводниками или проводниками второго рода. К ним относятся расплавы многих солей, оксидов и гидроксидов, гидридов s-металлов, а также водные растворы кислот, гидроксидов и солей. Далее будут рассмотрены только водные растворы электролитов. Важной характеристикой растворов электролитов является их концентрация – содержание растворенных веществ в определенном объеме раствора или растворителя. Известны различные способы выражения концентраций растворов, но наиболее часто используют следующие: а) массовая доля (w) – отношение массы растворенного вещества (m', г) к массе раствора (m, г):
где m" – масса растворителя, г. Массовая доля растворенного вещества, выраженная в процентах (процентная концентрация), – масса растворенного вещества в 100 г раствора. Например: 15%-й раствор NaCl состоит из 15 г кристаллической соли NaCl и 85 г воды в 100 г раствора; б) молярная концентрация, или молярность (СМ или М), – число молей растворенного вещества в 1 л раствора:
где М – молярная (мольная) масса растворенного вещества, г/моль; V – объем раствора, л. Например: 2 М раствор H2SO4 содержит в 1 л раствора 2 моля Н2SO4, или 2×98 = 196 г ( в) эквивалентная концентрация, или нормальность (Сн или н), – число эквивалентов растворенного вещества в 1 л раствора:
где mЭ – эквивалентная масса растворенного вещества, г/моль;
Примечание Эквивалент элемента (Э) – такое его количество, которое соединяется с 1 моль атомов водорода или ½ моль атомов кислорода. Масса одного эквивалента, выраженная в граммах, называется эквивалентной массой (mЭ) Эквивалент выражается в молях, эквивалентная масса – в граммах на моль. Эквивалент водорода равен 1 молю его атомов, а эквивалентная масса равна 1 г/моль. Эквивалент кислорода равен ½ моля его атомов, а эквивалентная масса равна 8 г/моль. Эквивалентную массу простого вещества можно вычислить делением мольной массы его атомов (М) на валентность (В): mЭ = Например: mЭ Са = 40/2 = 20 г/моль, а Э = ½ моля его атомов.
Эквивалентные массы сложных веществ: кислот, оснований, солей – определяются из соотношений: mЭ К-ТЫ = где МК-ТЫ, МОСН, МСОЛИ – мольные массы соответственно кислоты, основания, соли; Учитывая, что мольная масса (М) – масса 1 моля вещества, выраженная в граммах, соотношения (2.5) для вычисления эквивалентов имеют вид: Э К-ТЫ = Пример: 2 н раствор H2SO4 содержит в 1 л раствора 2 Э Н2SO4, или 2× М 1 М 1моль/л 1моль/л Двойная черта в схеме показывает, что два электролита пространственно разделены. Они соединяются посредством проводника второго рода (электролитического мостика). Во внешней цепи электроды соединены металлическим проводником первого рода. При соединении электродов равновесие нарушается вследствие перехода электронов по внешней цепи от цинкового электрода (анода) к медному (катоду), а анионов А: Zn – 2e = Zn2+, К: Cu2+ + 2e = Cu0, Суммируя электродные реакции, получим токообразующую реакцию:
где При условиях, отличных от стандартных, значения В результате самопроизвольных процессов система (гальванический элемент) совершает максимально полезную электрическую работу
где
С другой стороны, при обратимом процессе (
Сопоставляя уравнения (2.28) и (2.29), имеем
Но
где 0,059 = 2,3×8,314×298/96500.
Так как А: Zn – 2e = Zn2+, К: 2H+ + 2e = H20. Суммируя электродные реакции, получим
Первоначальное значение ЭДС равно контактной разности стандартных потенциалов цинкового и медного электродов, т.е.
С течением времени ЭДС элемента падает, что вызвано изменением величин электродных потенциалов катода и анода. Явление смещения величин электродных потенциалов от их равновесных значений при прохождении тока называется поляризацией электродов. В зависимости от природы возникновения поляризация делится на химическую и концентрационную. Химическая поляризация обусловлена изменением химической природы электродов при выделении на них продуктов электрохимической реакции. Например, в элементе Вольта потенциал катода (медного электрода) уменьшается за счет выделения на нем молекулярного водорода (Н2) и изменения химической природы электрода. При этом потенциал катода в пределе становится равным потенциалу водородного электрода, т.е.
Концентрационная поляризация обусловлена изменением концентрации потенциалопределяющих ионов в приэлектродных слоях при прохождении тока. При этом потенциал анода увеличивается за счет возрастания концентрации положительных ионов при окислении анода (например ионов Zn2+ в элементе Вольта). Таким образом, в указанном элементе анод поляризуется концентрационно, а катод – химически. В химических элементах типа Даниэля-Якоби имеет место концентрационная поляризация. При этом потенциал анода растет за счет увеличения концентрации положительных ионов при окислении анода, а потенциал катода уменьшается за счет снижения концентрации положительных ионов при их восстановлении на катоде. Поляризация электродов при работе гальванических элементов тормозит электрохимические процессы и, как следствие, обусловливает уменьшение ЭДС элементов. Явление уменьшения поляризации называется деполяризацией. Механическое удаление пузырьков газа с поверхности электрода или перемешивание электролита, снижающее концентрацию потенциалопределяющих ионов в приэлектродных слоях, – это физическая деполяризация, а введение в электролит химических соединений – сильных окислителей (K2Cr2O7, MnO2, O2 и др.) и веществ, связывающих избыточные ионы в труднорастворимые или малодиссоциирующие соединения или комплексы – химическая деполяризация. Например, для уменьшения химической поляризации катода в элементе Вольта в катодное пространство добавляется несколько капель бихромата калия K2Cr2O7. При этом протекает окислительно-восстановительная реакция, приводящая к окислению восстановленного на катоде водорода (Н2) и,как следствие, к увеличению ЭДС:
Зависимость величины электродного потенциала от концентрации потенциалопределяющих ионов обусловливает существование концентрационных гальванических элементов,например
А(-):Ni│NiSO4║NiSO4│Ni:К(+) или А(-):Ni│Ni2+║Ni2+│Ni:К(+) C1 < C2 C1 < C2 Электрод в растворе электролита с меньшей концентрацией – анод (меньшее значение
А: Ni – 2e = Ni2+, К: Ni2+ + 2e = Ni.
Возникающая при этом ЭДС зависит от соотношения концентраций и определяется по уравнению
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
На величину ЭДС
Порядок выполнения опыта. 1. Запишите схему цинкового электрода в электролите ZnSO4 и медного электрода в электролите CuSO4.. Рассчитайте концентрации потенциалопределяющих ионов Zn2+ и Cu2+ (см. выражение 2.7) в растворах 0,001М ZnSO4 и 1М CuSO4. Используя уравнение Нернста (2.20), вычислите численные значения потенциалов цинкового и медного электродов. Установите и обоснуйте, что является анодом и катодом в медно-цинковом гальваническом элементе. 2. Составьте электрохимическую схему такого гальванического элемента в молекулярной и ионной формах, запишите уравнения реакций, протекающих на аноде и на катоде, суммарное уравнение токообразующей реакции. Рассчитайте теоретические значения ЭДС при использовании вышеуказанных концентраций растворов и для 1М-ных ZnSO4 и CuSO4. 3. Соберите медно-цинковый гальванический элемент: для этого налейте в два химических стакана, емкостью 100 мл до 2/3 объема растворы солей: в один – 0,001М ZnSO4, в другой – 1М СuSО4. Погрузите в них предварительно обработанные электроды: цинковый в ZnSO4, медный в CuSO4. Соедините электролиты в стаканах электролитическим мостиком (U-образная стеклянная трубка, заполненная раствором КС1). Подсоедините электроды к измерительному прибору и запишите значение ЭДС. По окончании опыта цинковый электрод отсоедините, промойте дистиллированной водой и просушите фильтровальной бумагой. Замените в данном элементе 0,001М раствор ZnSO4 на 1М. Для этого вылейте 0,001М ZnSO4 в исходную емкость, налейте в этот же стакан 1М раствор ZnSO4 и вновь, как указано выше, соберите гальванический элемент и измерьте ЭДС. Затем электроды отсоедините, промойте дистиллированной водой, просушите фильтровальной бумагой. Электролиты вылейте обратно в исходные емкости, а электролитический мостик поместите в исходный стакан с раствором. Сравните теоретические значения ЭДС с экспериментальными. Объясните, почему экспериментальные значения ЭДС меньше теоретических. Рассчитайте для стандартного элемента изменение свободной энергии Гиббса (D G 0), максимально полезную работу (A 'м) и константу равновесия (К p). 4. Не проводя эксперимента, рассчитайте значение ЭДС исследуемого элемента при концентрации растворов 1М ZnSO4 и 0,001М СuSO4. 5. Сравните полученные значения ЭДС с величиной стандартной ЭДС и сделайте заключение о влиянии концентраций потенциалопределяющих ионов на величины электродных потенциалов и значения ЭДС.
2.2.2. Влияние природы электродов на численное значение ЭДС Гальванических элементтов Порядок выполнения опыта: 1. Запишите схемы электродов:цинкового в 1М растворе ZnSO4, никелевого в 1М растворе NiSO4, медного в 1М растворе CuSO4, выпишите из табл. (П.2) численные значения потенциалов. Установите анод и катод в цинк-никелевом и никель-медном гальванических элементах. 2. Составьте схемы цинк-никелевого и никель-медного гальванических элементов в молекулярном и ионном виде. Запишите уравнения анодно-катодных процессов и суммарные уравнения токообразующих реакций. Рассчитайте теоретические значения ЭДС. 3. Аналогично медно-цинковому элементу, соберите поочередно гальванические элементы, состоящие из следующих стандартных электродов, при этом электролитический мостик и химические стаканы каждый раз тщательно промывайте дистиллированной водой:
Подсоедините электроды к измерительному прибору и запишите значения ЭДС. Электроды отсоедините, промойте дистиллированной водой, просушите фильтровальной бумагой. Электролиты вылейте обратно в соответствующие исходные емкости, а электролитический мостик поместите в исходный стакан с раствором 3.Сравните теоретические значения ЭДС с экспериментальными. С учетом стандартного медно-цинкового элемента (см. схему и расчеты ЭДС в опыте 2.2.1) объясните различия в значениях ЭДС. От какого фактора зависит численное значение ЭДС в данном опыте? Как получить элемент с наибольшей величиной ЭДС? 4. Сделайте заключение о влиянии природы электродов на численные значения потенциалов электродов и величину ЭДС.
2.2.3. Влияние поляризации и деполяризации на величину ЭДС гальванического элемента
Как изменятся процессы, если Zn и Cu -электроды (оба) поместить в раствор серной кислоты H2SO4? Как называется такой элемент? По значениям стандартных потенциалов установите, какой электрод является анодом и какой катодом в таком элементе и запишите его схему. Учитывая, что медь не взаимодействует с серной кислотой, запишите уравнения реакций, протекающих на аноде и катоде и суммарное уравнение токообразующей реакции. Рассчитайте теоретическое значение ЭДС. Объясните, почему с течением времени в таком элементе значения ЭДС уменьшаются? Какая поляризация имеет место в элементе Вольта? Какими способами можно уменьшить поляризацию и увеличить численное значение ЭДС? Как изменится ЭДС, если 2-3 раза осторожно поднять и опустить катод (медный электрод)? Объясните механизм действия деполяризатора K2Cr2O7 Как изменится значение ЭДС при добавлении деполяризатора? Запишите уравнение реакции в молекулярной и ионной формах с химическим деполязатором (K2Cr2O7). Анализируя результаты опытов 2.2.1,2.2.2,2.2.3 сделайте обобщенный вывод, от каких факторов зависит численное значение ЭДС химических гальванических элементов.
3. Контрольные вопросы 1. Исходя из основного условия протекания окислительно-восстано-вительных реакций в растворах электролитов, объясните, какая из двух ниже приведенных реакций возможна: а) Sn + ZnSO4 = SnSO4 + Zn б) Sn + H2SO4 = SnSO4 + H2 Ответ подтвердите расчетами. 2. Рассчитайте величину потенциала кислородного электрода, погруженного в 0,001М раствор NH4OH (Кд(NH4OH) = 1,8 10-5) при стандартных условиях. Запишите схему электрода и уравнение электродной реакции. 3. Составьте схему гальванического элемента из стандартного свинцового электрода и водородного, находящегося в электролите с РН=5. Запишите уравнения анодно-катодных процессов, суммарное уравнение токообразующей реакции, рассчитайте значение ЭДС, изменение свободной энергии Гиббса (D G 0) электрохимической реакции и значение константы равновесия (Кр). Как изменится характер электродных процессов и ЭДС, если оба электрода будут стандартными. Ответ подтвердите расчетами и схемой элемента. 4. Составьте схему концентрационного гальванического элемента, состоящего из двух водородных электродов, один из которых опущен в 0,1М раствор HCl, другой – в 0.1М раствор уксусной кислоты CH3COOH (Kд = 1,8 10-5). Запишите уравнения анодно-катодных процессов и вычислите ЭДС. Литература 1. Стромберг, А. Г. Физическая химия / А. Г. Стромберг, Д. П. Семченко. – М.: Высш. шк., 1988. 2. Коровин, Н. В. Общая химия / Н. В. Коровин. – М.: Высш. шк., 3. Фролов, В. В. Химия / В. В. Фролов. – М.: Высш. шк., 1986. 4. Боднарь, И. В. Метод. пособие к решению задач по курсу «Химия» / И. В. Боднарь, А. П. Молочко, Н. П. Соловей. – Минск: БГУИР, 2001
Лабораторная работа № 3 Процессы электролиза
Цель работы: на конкретных примерах изучить физико-химические процессы, протекающие при электролизе водных растворов электролитов на инертных электродах
1. Теоретическая часть
Электрохимические системы, в которых электрическая энергия превращается в химическую называются электролизными. Простейшая электролизная система состоит из электролизера (электролитическая ванна), электродов (инертных или активных), электролита (раствора или расплава), источника постоянного тока. Электрод, подключенный к отрицательному полюсу источника тока, называется катодом, к положительному – анодом. Зависимость между количеством электричества (Q), прошедшего через электролизер, и массой (объемом) веществ, претерпевших превращение на электродах и в электролите, выражается двумя законами Фарадея, которые можно записать уравнениями, приведенными ниже: 1-й закон Фарадея- массы (объемы) выделившихся веществ на электродах прямо пропорцианальны количеству прошедшего электричества:
где k – коэффициент пропорциональности, при этом k = m, если Q = 1 Кл; m (V) – массы (объемы) веществ, претерпевших превращения, г(л); I – сила тока, А; 2-й закон Фарадея – одинаковые количества электричества преобразуют эквивалентные количества веществ:
где m Э1, m Э2 и Из второго закона Фарадея следует, что при
где k – электрохимический эквивалент вещества, г/Кл или л/Кл.
Отсюда можно записать уравнение, объединяющее 1- и 2-й законы
Следует заметить, что количества веществ, полученных практически, всегда меньше рассчитанных, что численно характеризуется величиной выхода по току (ВТ), при этом ВТ < 1.
С учетом выхода по току (ВТ) уравнения (3.4) примут вид
Снижение выхода по току обусловлено различными причинами, важнейшими из которых являются поляризация и перенапряжение при прохождении тока. Накопление продуктов электролиза на электродах изменяет их природу и величину электродных потенциалов (химическая поляризация). При этом в электролизере возникает внутренний гальванический элемент, ЭДС которого направлена встречно внешней ЭДС и называется ЭДС поляризации (
Таким образом, характер и скорость процессов электролиза (восстановления на катоде и окисления на аноде) зависят: 1) от активности частиц в электролите, численно определяемой величиной | ||||
|
| Поделиться: |


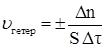 , (2.1)
, (2.1) ; S – площадь межфазной поверхности,
; S – площадь межфазной поверхности,  .
. . Измеряется скорость: моль/л·с, моль/м2·с.
. Измеряется скорость: моль/л·с, моль/м2·с. и
и  , то отношение выражает среднюю скорость гомогенного процесса.
, то отношение выражает среднюю скорость гомогенного процесса. . (2.2)
. (2.2)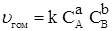 , (2.3)
, (2.3) – скорость реакции;
– скорость реакции; 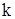 – константа скорости химической реакции; СА и СВ – концентрации реагирующих веществ, моль/л; а, b – стехиометрические коэффициенты в уравнении реакции.
– константа скорости химической реакции; СА и СВ – концентрации реагирующих веществ, моль/л; а, b – стехиометрические коэффициенты в уравнении реакции. . (2.4)
. (2.4) ;
;  или
или  ;
; ;
;  .
.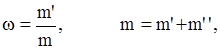 (2.1)
(2.1) (2.2)
(2.2)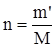 – количество вещества, моль;
– количество вещества, моль; = 98 г/моль);
= 98 г/моль); (2.3)
(2.3)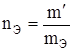 – число моль- эквивалентов.
– число моль- эквивалентов. , а эквивалент равен Э =
, а эквивалент равен Э =  . (2.4)
. (2.4) ; mЭ ОСН =
; mЭ ОСН =  ; mЭ СОЛИ =
; mЭ СОЛИ =  ; (2.5)
; (2.5) ,
, 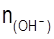 – число ионов водорода (гидроксильных групп), вступивших в реакцию; ВМе – валентность металла; nМе – число атомов металла в молекуле соли.
– число ионов водорода (гидроксильных групп), вступивших в реакцию; ВМе – валентность металла; nМе – число атомов металла в молекуле соли.
 , (моль); Э ОСН =
, (моль); Э ОСН =  , (моль); Э СОЛИ =
, (моль); Э СОЛИ =  , (моль).
, (моль). = 98 г (
= 98 г ( – эквивалентная масса Н2SO4).
– эквивалентная масса Н2SO4). по внутренней цепи в обратном направлении. Возникает самопроизвольный анодно-катодный процесс по схеме
по внутренней цепи в обратном направлении. Возникает самопроизвольный анодно-катодный процесс по схеме - 0,76 B;
- 0,76 B;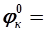 + 0,34 B.
+ 0,34 B. ,
, 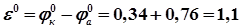 В,
В, – стандартная электродвижущая сила (ЭДС) элемента, В.
– стандартная электродвижущая сила (ЭДС) элемента, В.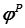 рассчитываются по уравнению Нернста (2.20).
рассчитываются по уравнению Нернста (2.20). , равную
, равную , (2.28)
, (2.28) – количество прошедшего электричества, Кл;
– количество прошедшего электричества, Кл; – число электронов-участников в данной электрохимической реакции.
– число электронов-участников в данной электрохимической реакции. ;
;  ) совершаемая системой работа равна убыли свободной энергии Гиббса, D G°:
) совершаемая системой работа равна убыли свободной энергии Гиббса, D G°: , (2.29)
, (2.29) (2.30)
(2.30) , где
, где  – константа равновесия, равная в данном случае отношению
– константа равновесия, равная в данном случае отношению 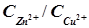 . Тогда
. Тогда (2.31)
(2.31) , (2.32)
, (2.32) Замкнутая электрохимическая система из двух электродов в одном и том же электролите называется химическим гальваническим элементом типа Вольта. Элемент Вольта состоит из медного и цинкового электродов в растворе серной кислоты. Схема его записывается в виде
Замкнутая электрохимическая система из двух электродов в одном и том же электролите называется химическим гальваническим элементом типа Вольта. Элемент Вольта состоит из медного и цинкового электродов в растворе серной кислоты. Схема его записывается в виде , анодом будет цинковый электрод, катодом – медный электрод. Учитывая, что медь не взаимодействует с разбавленной серной кислотой, уравнения анодно-катодных процессов имеют вид
, анодом будет цинковый электрод, катодом – медный электрод. Учитывая, что медь не взаимодействует с разбавленной серной кислотой, уравнения анодно-катодных процессов имеют вид .
.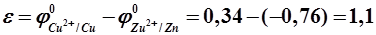 В.
В.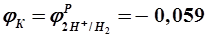 рН.
рН.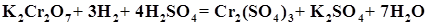


 ), с большей – катод (большее значение
), с большей – катод (большее значение  , где
, где  . (2.33)
. (2.33) или
или  , (3.1)
, (3.1) – время прохождения тока, с.
– время прохождения тока, с. или
или  или
или  , (3.2)
, (3.2) ,
,  – эквивалентные массы и эквивалентные объемы (н.у.) веществ, претерпевших превращения. Для вычисления эквивалентных объемов газообразных веществ. необходимо сравнить их мольную и эквивалентную массы. Во сколько раз эквивалентная масса меньше мольной, во столько раз эквивалентный объем меньше мольного объема(22,4 л). Эквивалентный объем водорода равен 11,2 л, а эквивалентный объм кислорода равен 5,6 л.
– эквивалентные массы и эквивалентные объемы (н.у.) веществ, претерпевших превращения. Для вычисления эквивалентных объемов газообразных веществ. необходимо сравнить их мольную и эквивалентную массы. Во сколько раз эквивалентная масса меньше мольной, во столько раз эквивалентный объем меньше мольного объема(22,4 л). Эквивалентный объем водорода равен 11,2 л, а эквивалентный объм кислорода равен 5,6 л. 96500 Кл (или 26,8 А·ч), m = m Э или
96500 Кл (или 26,8 А·ч), m = m Э или  , тогда
, тогда или
или 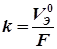 , (3.3)
, (3.3) или
или 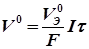 . (3.4)
. (3.4) или
или  . (3.5)
. (3.5) или
или  . (3.6)
. (3.6) ). Для преодоления поляризации извне на электроды подается избыточное напряжение, называемое перенапряжением (
). Для преодоления поляризации извне на электроды подается избыточное напряжение, называемое перенапряжением (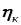 и
и  ). Численное значение
). Численное значение  зависит от природы выделяемых на электродах веществ, природы электродов и состояния их поверхности, плотности тока (i = I / S, A/см2 ) и других факторов. При этом
зависит от природы выделяемых на электродах веществ, природы электродов и состояния их поверхности, плотности тока (i = I / S, A/см2 ) и других факторов. При этом  , отсюда ЭДС разложения электролита будет равна
, отсюда ЭДС разложения электролита будет равна . (3.7)
. (3.7) или
или 


