
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Примечание: Выражение (2.33) необходимо использовать только при вычислении ЭДС концентрационных гальванических элементов.Содержание книги
Поиск на нашем сайте
Таким образом, главным критерием возможности протекания электрохимических процессов в гальваническом элементе является положительный знак ЭДС, т.е. неравенство
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Установить химическую активность металлов в водных растворах электролитов и их положение в электрохимическом ряду активностей. Порядок выполнения опыта. Налейте в три пробирки по 2-3 мл 0,5н растворов солей Аl2(SO4)3, FeCl3, CuSO4. Опустите в пробирки с растворами гранулы (кусочки) Zn. В пробирку с раствором FeCl3 добавьте несколько капель красной кровяной соли (железосинеродистый калий) K3[Fe(CN)6] – индикатор на ионы Fe2 +. Спустя 2-3 минуты запишите результаты наблюдений. Обратите внимание на появление синего окрашивания (турнбулевой сини) Fe3[Fe(CN)6]2 в пробирке с FeCl3, что свидетельствует о наличии ионов Fe2+. Вылейте содержимое пробирок в сосуд для отходов и сполосните пробирки дистиллированной водой. Повторите опыт в той же последовательности с растворами солей Al2(SO4)3, ZnSO4 и FeCl3, поместив в них кусочки Сu. В пробирку с FeCl3 добавьте индикатор на ионы Fe2+. Запишите результаты наблюдений. Аналогично предыдущим опытам, поместите в пробирки с растворами солей ZnSO4, FeCl3, и CuSO4 гранулы Аl. Запишите результаты наблюдений. Объясните, почему отсутствуют явные признаки реакций. При оформлении анализа результатов опыта выполните следующие задания: 1. Запишите для всех случаев уравнения окислительно-восстанови-тельных реакций в молекулярной и краткой ионной формах. Укажите, что является окислителем, восстановителем и запишите полуреакции окисления и восстановления. 2. Выпишите из табл. П.2 для каждой окислительно-восстанови-тельной реакции соответствующие значения стандартных электродных потенциалов: А13+/Al, Zn2+/Zn, Cu2+/Cu, Fe3+/Fe, Fe3+/Fe2 + и дайте обоснованное объяснение характеру указанных реакций, используя основные условия их протекания. Почему для реакций с раствором FeCl3 необходимо использовать электродный потенциал Fe3+/Fe2 +? 3. Расположите исследуемые металлы по убыванию их активности в водных растворах. 4. Сделайте вывод о химической активности металлов в водных растворах электролитов. Запишите основное условие протекания окислительно-восстановительных реакций. Укажите влияние пассивирующих (оксидных) слоев на поверхности активных металлов на характер протекания окислительно-восстановительных реакций.
2.2. Определение ЭДС химических гальванических элементов. 2.2.1. Влияние концентрации потенциалопределяющих ионов На величину ЭДС
Порядок выполнения опыта. 1. Запишите схему цинкового электрода в электролите ZnSO4 и медного электрода в электролите CuSO4.. Рассчитайте концентрации потенциалопределяющих ионов Zn2+ и Cu2+ (см. выражение 2.7) в растворах 0,001М ZnSO4 и 1М CuSO4. Используя уравнение Нернста (2.20), вычислите численные значения потенциалов цинкового и медного электродов. Установите и обоснуйте, что является анодом и катодом в медно-цинковом гальваническом элементе. 2. Составьте электрохимическую схему такого гальванического элемента в молекулярной и ионной формах, запишите уравнения реакций, протекающих на аноде и на катоде, суммарное уравнение токообразующей реакции. Рассчитайте теоретические значения ЭДС при использовании вышеуказанных концентраций растворов и для 1М-ных ZnSO4 и CuSO4. 3. Соберите медно-цинковый гальванический элемент: для этого налейте в два химических стакана, емкостью 100 мл до 2/3 объема растворы солей: в один – 0,001М ZnSO4, в другой – 1М СuSО4. Погрузите в них предварительно обработанные электроды: цинковый в ZnSO4, медный в CuSO4. Соедините электролиты в стаканах электролитическим мостиком (U-образная стеклянная трубка, заполненная раствором КС1). Подсоедините электроды к измерительному прибору и запишите значение ЭДС. По окончании опыта цинковый электрод отсоедините, промойте дистиллированной водой и просушите фильтровальной бумагой. Замените в данном элементе 0,001М раствор ZnSO4 на 1М. Для этого вылейте 0,001М ZnSO4 в исходную емкость, налейте в этот же стакан 1М раствор ZnSO4 и вновь, как указано выше, соберите гальванический элемент и измерьте ЭДС. Затем электроды отсоедините, промойте дистиллированной водой, просушите фильтровальной бумагой. Электролиты вылейте обратно в исходные емкости, а электролитический мостик поместите в исходный стакан с раствором. Сравните теоретические значения ЭДС с экспериментальными. Объясните, почему экспериментальные значения ЭДС меньше теоретических. Рассчитайте для стандартного элемента изменение свободной энергии Гиббса (D G 0), максимально полезную работу (A 'м) и константу равновесия (К p). 4. Не проводя эксперимента, рассчитайте значение ЭДС исследуемого элемента при концентрации растворов 1М ZnSO4 и 0,001М СuSO4. 5. Сравните полученные значения ЭДС с величиной стандартной ЭДС и сделайте заключение о влиянии концентраций потенциалопределяющих ионов на величины электродных потенциалов и значения ЭДС.
2.2.2. Влияние природы электродов на численное значение ЭДС Гальванических элементтов Порядок выполнения опыта: 1. Запишите схемы электродов:цинкового в 1М растворе ZnSO4, никелевого в 1М растворе NiSO4, медного в 1М растворе CuSO4, выпишите из табл. (П.2) численные значения потенциалов. Установите анод и катод в цинк-никелевом и никель-медном гальванических элементах. 2. Составьте схемы цинк-никелевого и никель-медного гальванических элементов в молекулярном и ионном виде. Запишите уравнения анодно-катодных процессов и суммарные уравнения токообразующих реакций. Рассчитайте теоретические значения ЭДС. 3. Аналогично медно-цинковому элементу, соберите поочередно гальванические элементы, состоящие из следующих стандартных электродов, при этом электролитический мостик и химические стаканы каждый раз тщательно промывайте дистиллированной водой:
Подсоедините электроды к измерительному прибору и запишите значения ЭДС. Электроды отсоедините, промойте дистиллированной водой, просушите фильтровальной бумагой. Электролиты вылейте обратно в соответствующие исходные емкости, а электролитический мостик поместите в исходный стакан с раствором 3.Сравните теоретические значения ЭДС с экспериментальными. С учетом стандартного медно-цинкового элемента (см. схему и расчеты ЭДС в опыте 2.2.1) объясните различия в значениях ЭДС. От какого фактора зависит численное значение ЭДС в данном опыте? Как получить элемент с наибольшей величиной ЭДС? 4. Сделайте заключение о влиянии природы электродов на численные значения потенциалов электродов и величину ЭДС.
2.2.3. Влияние поляризации и деполяризации на величину ЭДС гальванического элемента
Как изменятся процессы, если Zn и Cu -электроды (оба) поместить в раствор серной кислоты H2SO4? Как называется такой элемент? По значениям стандартных потенциалов установите, какой электрод является анодом и какой катодом в таком элементе и запишите его схему. Учитывая, что медь не взаимодействует с серной кислотой, запишите уравнения реакций, протекающих на аноде и катоде и суммарное уравнение токообразующей реакции. Рассчитайте теоретическое значение ЭДС. Объясните, почему с течением времени в таком элементе значения ЭДС уменьшаются? Какая поляризация имеет место в элементе Вольта? Какими способами можно уменьшить поляризацию и увеличить численное значение ЭДС? Как изменится ЭДС, если 2-3 раза осторожно поднять и опустить катод (медный электрод)? Объясните механизм действия деполяризатора K2Cr2O7 Как изменится значение ЭДС при добавлении деполяризатора? Запишите уравнение реакции в молекулярной и ионной формах с химическим деполязатором (K2Cr2O7). Анализируя результаты опытов 2.2.1,2.2.2,2.2.3 сделайте обобщенный вывод, от каких факторов зависит численное значение ЭДС химических гальванических элементов.
3. Контрольные вопросы 1. Исходя из основного условия протекания окислительно-восстано-вительных реакций в растворах электролитов, объясните, какая из двух ниже приведенных реакций возможна: а) Sn + ZnSO4 = SnSO4 + Zn б) Sn + H2SO4 = SnSO4 + H2 Ответ подтвердите расчетами. 2. Рассчитайте величину потенциала кислородного электрода, погруженного в 0,001М раствор NH4OH (Кд(NH4OH) = 1,8 10-5) при стандартных условиях. Запишите схему электрода и уравнение электродной реакции. 3. Составьте схему гальванического элемента из стандартного свинцового электрода и водородного, находящегося в электролите с РН=5. Запишите уравнения анодно-катодных процессов, суммарное уравнение токообразующей реакции, рассчитайте значение ЭДС, изменение свободной энергии Гиббса (D G 0) электрохимической реакции и значение константы равновесия (Кр). Как изменится характер электродных процессов и ЭДС, если оба электрода будут стандартными. Ответ подтвердите расчетами и схемой элемента. 4. Составьте схему концентрационного гальванического элемента, состоящего из двух водородных электродов, один из которых опущен в 0,1М раствор HCl, другой – в 0.1М раствор уксусной кислоты CH3COOH (Kд = 1,8 10-5). Запишите уравнения анодно-катодных процессов и вычислите ЭДС. Литература 1. Стромберг, А. Г. Физическая химия / А. Г. Стромберг, Д. П. Семченко. – М.: Высш. шк., 1988. 2. Коровин, Н. В. Общая химия / Н. В. Коровин. – М.: Высш. шк., 3. Фролов, В. В. Химия / В. В. Фролов. – М.: Высш. шк., 1986. 4. Боднарь, И. В. Метод. пособие к решению задач по курсу «Химия» / И. В. Боднарь, А. П. Молочко, Н. П. Соловей. – Минск: БГУИР, 2001
Лабораторная работа № 3 Процессы электролиза
Цель работы: на конкретных примерах изучить физико-химические процессы, протекающие при электролизе водных растворов электролитов на инертных электродах
1. Теоретическая часть
Электрохимические системы, в которых электрическая энергия превращается в химическую называются электролизными. Простейшая электролизная система состоит из электролизера (электролитическая ванна), электродов (инертных или активных), электролита (раствора или расплава), источника постоянного тока. Электрод, подключенный к отрицательному полюсу источника тока, называется катодом, к положительному – анодом. Зависимость между количеством электричества (Q), прошедшего через электролизер, и массой (объемом) веществ, претерпевших превращение на электродах и в электролите, выражается двумя законами Фарадея, которые можно записать уравнениями, приведенными ниже: 1-й закон Фарадея- массы (объемы) выделившихся веществ на электродах прямо пропорцианальны количеству прошедшего электричества:
где k – коэффициент пропорциональности, при этом k = m, если Q = 1 Кл; m (V) – массы (объемы) веществ, претерпевших превращения, г(л); I – сила тока, А; 2-й закон Фарадея – одинаковые количества электричества преобразуют эквивалентные количества веществ:
где m Э1, m Э2 и Из второго закона Фарадея следует, что при
где k – электрохимический эквивалент вещества, г/Кл или л/Кл.
Отсюда можно записать уравнение, объединяющее 1- и 2-й законы
Следует заметить, что количества веществ, полученных практически, всегда меньше рассчитанных, что численно характеризуется величиной выхода по току (ВТ), при этом ВТ < 1.
С учетом выхода по току (ВТ) уравнения (3.4) примут вид
Снижение выхода по току обусловлено различными причинами, важнейшими из которых являются поляризация и перенапряжение при прохождении тока. Накопление продуктов электролиза на электродах изменяет их природу и величину электродных потенциалов (химическая поляризация). При этом в электролизере возникает внутренний гальванический элемент, ЭДС которого направлена встречно внешней ЭДС и называется ЭДС поляризации (
Таким образом, характер и скорость процессов электролиза (восстановления на катоде и окисления на аноде) зависят: 1) от активности частиц в электролите, численно определяемой величиной 2) от концентрации частиц в электролите; 3) от величины перенапряжения,
Катодные процессы С учетом названных факторов при сопоставимой концентрации частиц ряд напряжений металлов по восстановительной способности их ионов условно разбивается на три группы: 1) ионы металлов повышенной химической активности от Li до Al включительно из водных растворов не восстанавливаются, ВТ( Ме ) = 0, а восстанавливается Н2 по уравнениям 2H+ + 2e = H2 (pH < 7) или 2H20 + 2e = H2 + 2OH- (pH ³ 7); 2) ионы металлов средней активности от Mn до Н восстанавливаются наряду с водородом, ВТ( Ме ) < 100 %, так как
 ( ( ) или ) или
3) ионы металлов малоактивных, стоящих в ряду напряжений после Н, восстанавливаются без участия водорода по уравнению
Анодные процессы Характер и вид анодных процессов зависят также от природы анода. В случае инертного (нерастворимого) анода (С, Pt) на нем идут процессы окисления частиц электролита в следующей последовательности: 1) сложные кислородсодержащие анионы (
2) элементарные анионы (
В случае активного (растворимого) анода окисляется сам анод по уравнению
При электролизе расплавов электролитов реакции, связанные с разложением воды, исключаются. Последовательность разрядаионов зависит от их активности и концентрации. Пример схемы электролиза 1М раствора ZnSO4 ( а) Запишем схему электролизной системы:
Суммарное уравнение электролиза: 2ZnSO4 +2H2O = 2Zn + O2 + 2H2SO4.
б) Схема электролизной системы и уравнения электродных процессов:
Пример электролиза расплава КОН на графитовых электродах:
Суммарное уравнение процесса электролиза
расплав ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Электролиз водных растворов солей на инертных электродах
При выполнении работы используются: электролизер (U – образная стеклянная трубка, закрепленная в штативе), графитовые электроды, выпрямитель тока Е – 24М или ИЭПП–2 и 0,5 М растворы солей CuSO4, KI, NaCl. Примем, что водный раствор указанных солей имеет нейтральную среду, значение pH равно 7. 2.1. Электролиз водного раствора CuSO4 Порядок выполнения опыта. Налейте в электролизер (ниже отводных боковых трубок) 0,5 М раствор CuSO4 и опустите графитовые электроды, подсоединив их через выпрямитель к источнику тока: катод к минусу Тщательно осмотрите поверхность катода. Что наблюдаете? Почему поверхность катода покрыта медью, как это связано с ее активностью? В анодное пространство электролизера опустите полоску индикаторной бумаги (или добавьте раствор лакмуса) и по цветовой эталонной шкале определите значение рН раствора в анодном пространстве. Объясните, почему полученное значение РН<7? За счет какого процесса образовались ионы водорода? Какой газ выделялся на аноде? Окисляются ли кислородсодержащие ионы SO42- на аноде при данном напряжении? Согласуются ли полученные результаты с теоретическими положениями. Исходя из результатов опыта составьте схему электролиза раствора CuSO4 на графитовых электродах, запишите уравнения анодно-катодных процессов, а также уравнения вторичных процессов, протекающих на аноде. Составьте суммарное уравнение. Отработанный раствор слейте в специальный сосуд для отходов. Электролизер тщательно промойте водой. Для удаления продуктов электролиза обработайте электроды: катод в 10 %-ном растворе HNO3, анод в 5 %-ном растворе Na2S2O3. После обработки тщательно промойте электроды водой и просушите салфеткой.
|
||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1089; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.239.111 (0.01 с.) |

 или
или  . (2.34)
. (2.34) или
или  , (3.1)
, (3.1) – время прохождения тока, с.
– время прохождения тока, с. или
или  или
или  , (3.2)
, (3.2) ,
,  – эквивалентные массы и эквивалентные объемы (н.у.) веществ, претерпевших превращения. Для вычисления эквивалентных объемов газообразных веществ. необходимо сравнить их мольную и эквивалентную массы. Во сколько раз эквивалентная масса меньше мольной, во столько раз эквивалентный объем меньше мольного объема(22,4 л). Эквивалентный объем водорода равен 11,2 л, а эквивалентный объм кислорода равен 5,6 л.
– эквивалентные массы и эквивалентные объемы (н.у.) веществ, претерпевших превращения. Для вычисления эквивалентных объемов газообразных веществ. необходимо сравнить их мольную и эквивалентную массы. Во сколько раз эквивалентная масса меньше мольной, во столько раз эквивалентный объем меньше мольного объема(22,4 л). Эквивалентный объем водорода равен 11,2 л, а эквивалентный объм кислорода равен 5,6 л. 96500 Кл (или 26,8 А·ч), m = m Э или
96500 Кл (или 26,8 А·ч), m = m Э или  , тогда
, тогда или
или 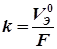 , (3.3)
, (3.3) или
или 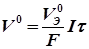 . (3.4)
. (3.4) или
или  . (3.5)
. (3.5) или
или  . (3.6)
. (3.6) ). Для преодоления поляризации извне на электроды подается избыточное напряжение, называемое перенапряжением (
). Для преодоления поляризации извне на электроды подается избыточное напряжение, называемое перенапряжением (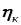 и
и  ). Численное значение
). Численное значение  зависит от природы выделяемых на электродах веществ, природы электродов и состояния их поверхности, плотности тока (i = I / S, A/см2 ) и других факторов. При этом
зависит от природы выделяемых на электродах веществ, природы электродов и состояния их поверхности, плотности тока (i = I / S, A/см2 ) и других факторов. При этом  , отсюда ЭДС разложения электролита будет равна
, отсюда ЭДС разложения электролита будет равна . (3.7)
. (3.7) или
или  . Чем больше значение
. Чем больше значение  , тем быстрее идет процесс восстановления на катоде; чем меньше
, тем быстрее идет процесс восстановления на катоде; чем меньше  . Электродные реакции имеют вид
. Электродные реакции имеют вид основная реакция;
основная реакция;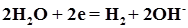 (
( );
); ,
, 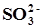 ,
,  ,
,  и др.) и элементарный F- – из водных растворов не окисляются, а окисляется кислород по уравнениям
и др.) и элементарный F- – из водных растворов не окисляются, а окисляется кислород по уравнениям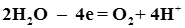 (
( ) или
) или  (
( );
); ,
,  ,
,  ,
,  и др.) окисляются без участия кислорода тем быстрее, чем меньше значение
и др.) окисляются без участия кислорода тем быстрее, чем меньше значение  ). При этом следует учесть, что окисление хлора (
). При этом следует учесть, что окисление хлора (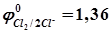 В) происходит за счет большего перенапряжения кислорода (
В) происходит за счет большего перенапряжения кислорода ( рН). Анодные реакции имеют вид, например,
рН). Анодные реакции имеют вид, например, или
или  .
.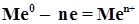 .
. ): а) на графитовых (инертных) электродах; б) на цинковых (растворимых) электродах.
): а) на графитовых (инертных) электродах; б) на цинковых (растворимых) электродах.






