
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химическая связь. Строение молекул и ионовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Химическая связь 41. Чем объясняется высокая прочность связи между атомами в молекуле азота N2 и неустойчивость молекулы Р2? 42. Объясните, почему энергия связи в молекуле Cl2 больше, чем в молекуле F2, а дальше в ряду Cl2 – Br2 – I2 она уменьшается. 43. Назовите элементы, для атомов которых возможно только одно валентное состояние, и укажите, каким оно будет – основным или возбужденным. 44. Возможна ли донорная или акцепторная функция для центрального атома в молекулах BeF2, BF3, CF4. Поясните на примерах. 45. Возможна ли донорная или акцепторная функция для центрального атома в молекулах Н2О, РCl5, BCl3. Поясните на примерах. 46. Чему равны валентности азота и углерода в молекулах N2, H2CO3, C2N2, N2O5. 47. Приведите примеры молекул, которые содержат: а) две σ- и две π-связи; б) две σ- и одну π-связь. 48. Приведите примеры молекул, которые содержат: а) четыре σ- и две π-связи; б) три σ- и одну π-связи. 49. Почему ион 50. Приведите примеры молекул, в которых степень окисления центрального атома по сравнению с его валентностью а) больше; б) меньше; в) равна. Изобразите структурные формулы этих соединений. 51. Может ли произойти реакция между HF и SiF4? Укажите причины, по которым эта реакция может (не может) произойти. 52. Объясните закономерность изменения температуры кипения (при н.у.) в ряду следующих соединений:
53. На основе использования представлений о водородной связи объясните наблюдаемую закономерность в изменении температур кипения в ряду соединений:
54. Укажите, какие из приведенных молекул являются полярными, а какие – неполярные: а) CH3Cl; б) C(CH3)4; в) CO2; г) SO2; д) SO3. Ответ поясните. Укажите тип гибридизации центрального атома в каждом из соединений. 55. Энергия диссоциации в ряду молекул Cl2, Br2, I2 составляют (кДж/моль) 239, 192 и 149 соответственно, однако энергия диссоциации молекулы F2 (151 кДж/моль) значительно меньше по сравнению с молекулой Cl2 и выпадает из общей закономерности. Дайте объяснение приведенным фактам. 56. Приведите структурную формулу гидросульфата аммония. Укажите характер химических связей в соединении, валентность и степень окисления азота. 57. Приведите примеры молекул, которые содержат: а) только σ-связи; б) две σ- и одну π-связь; в) три σ- и три π-связи. 58. почему оказывается энергетически выгодным образование молекулы O2 и энергетически невыгодным образование молекулы S2? 59. Приведите примеры молекул, в которых степень окисления и валентность одного и того же элемента соответственно равны: а) +5 и IV; б) 0 и III; в) +5 и V. 60. Приведите структурную формулу 3-хлорбензойной кислоты. Укажите валентность и степень окисления каждого атома углерода.
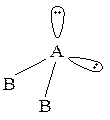
Строение молекул и ионов Наиболее вероятная конфигурация молекулы или иона соответствует наименьшему отталкиванию электронных пар или их максимальному удалению друг от друга. Модель отталкивания электронных пар валентной оболочки (ОЭПВО) коротко сводится к следующему. Пространственное распределение химических связей вокруг поливалентных атомов определяется общим числом пар электронов: связывающих и неподеленных. Тип молекулы в общем виде записывается как ABmEn, где А – центральный атом, В – лиганд, Е – неподеленная пара электронов. Геометрия молекулы определяется только числом σ-связей и несвязанных электронов, π-связями можно пренебречь. (Несколько более сильное отталкивание между двойными связями по сравнению с одинарными приводит к незначительным изменениям углов и энергий связей). В соответствии с методом валентных связей (использование этого метода приводит к такому же результату, что и использование модели ОЭПВО), пространственная конфигурация молекулы определяется пространственным расположением гибридных орбиталей центрального атома, которые образуются в результате взаимодействия между орбиталями. Для определения типа гибридизации центрального атома надо знать число гибридизующихся орбиталей. Его можно найти, сложив число связывающих и неподеленных электронных пар центрального атома и отняв число π-связей. Например, в ионе
общее число связывающих и неподеленных пар равно 4 + 1 = 5. Отняв число π-связей, получим число гибридизующихся орбиталей: 5 – 1 = 4. Таким образом, тип гибридизации sp3, тип иона AB3E, пространственное расположение электронных пар имеет форму тетраэдра, а сам ион представляет собой тригональную пирамиду:
Ниже приведены некоторые из возможных вариантов
Задания к разделу строение молекул и ионов Используя модель отталкивания валентных электронных пар и метод валентных связей, рассмотрите пространственное строение предложенных молекул и ионов. Укажите: а) число связывающих и неподеленных электронных пар центрального атома; б) число орбиталей, участвующих в гибридизации; в) тип гибридизации; г) тип молекулы или иона (ABmEn); д) пространственное расположение электронных пар; е) пространственное строение молекулы или иона.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 598; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.250.241 (0.007 с.) |

 реально существует, а ион
реально существует, а ион 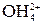 не обнаружен?
не обнаружен?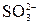


 угловое строение
угловое строение

 тригональная пирамида
тригональная пирамида
 угловое строение
угловое строение
 Т-образное строение
Т-образное строение

 октаэдр
октаэдр
 тетрагональная пирамида
тетрагональная пирамида
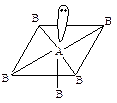 квадрат
квадрат




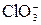
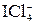
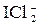
 ; BCl3
; BCl3
 ; BF3
; BF3
 ; SO2
; SO2


 ; SF6
; SF6

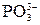 ; COCl2
; COCl2




