
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Повышение температуры кипения растворовСодержание книги
Поиск на нашем сайте
Рассмотрим раствор нелетучего вещества находящийся в равновесии с паром. Так как растворенное вещество нелетучее, то в паре будет находиться только растворитель. Тогда в соответствии с теоремой Гиббса химический потенциал растворителя в растворе
При р = const химический потенциал растворителя в растворе зависит от состава раствора и температуры, а в паровой фазе, находящейся в равновесии с раствором –только от температуры:
где х1 – мольная доля растворителя в растворе. Продифференцируем
Зависимость химического потенциала компонента раствора от его состава при
тогда
С учетом того, что при р, Т = const
где
Преобразуем:
Рассмотрим разбавленный раствор твердого вещества, мольная доля растворенного вещества х2 → 0, а активность растворителя х1 = 1 – х2,
Если х2 << 1, то можно принять
С учетом этого получим:
В числителе получаем парциальную мольную энтропию испарения растворителя
Так как раствор разбавленный, то можно принять, что парциальная мольная энтропия испарения растворителя из раствора равна мольной энтропии испарения чистого растворителя:
В результате получим:
Процесс испарения идет при температуре кипения: Т = Тк = const. Пусть температура кипения чистого растворителя равна Тк0 а раствора – Тк, мольная доля растворенного вещества в чистом растворителе х2 = 0, а в растворе – х2. Проинтегрируем в интервале от Тк0 до Тк:
Температуры кипения Тк0 и Тк выражены в К, следовательно,
Таким образом, при р = const раствор нелетучего вещества кипит при более высокой температуре, чем чистый растворитель (рис. 2.6). Повышение температуры кипения раствора нелетучего вещества по сравнению с температурой кипения чистого растворителя прямо пропорционально мольной доле растворенного вещества. Полученное уравнение справедливо только для разбавленных растворов. На рисунке: Тк10 – температура кипения чистого растворителя при давлении р1; Тк1 – температура кипения раствора при давлении р1. Из рисунка видно, что Тк1 > Тк10.
Тогда если М 1 – молярная масса растворителя, а М 2 – молярная масса растворенного вещества, то на 1000 г растворителя получим:
 ; ;  ; ;  , ,
тогда
Поскольку раствор разбавлен,
Подставим х2 в уравнение:
Введем обозначение:
где Е – эбулиоскопическая константа растворителя. Тогда
Эбулиоскопическая константа зависит от природы растворителя и не зависит от природы растворенного вещества. Физический смысл эбуллиоскопической константы: Е численно равна повышению температуры кипения раствора с концентрацией 1 моль/1000 г растворителя. Значения E для различных растворителей приведены в справочниках. Если молекулы растворенного вещества подвергаются диссоциации, то число моль в растворе увеличивается. С учетом этого процесса уравнение для ∆Тк принимает вид:
где i – изотонический коэффициент или коэффициент Вант-Гоффа. Коэффициент i равен отношению общего числа моль в растворе после диссоциации к числу моль растворенного вещества до диссоциации. Изотонический коэффициент можно определить по формуле:
где α – степень диссоциации электролита; ν – число ионов, образующихся при диссоциации одной молекулы. Физико-химические методы анализа, основанные на измерении повышения температуры кипения растворов, называются эбулиоскопическими. Эбулиоскопический метод применяется для для определения концентрации растворенного вещества, его молярной массы, изотонического коэффициента и степени диссоциации электролита. Для определения молярной массы растворенного вещества экспериментально измеряют ∆Тк раствора. Количество моль растворенного вещества в 1000 граммах растворителя, то есть моляльность можно выразить:
где g 2 – масса растворенного вещества. Тогда молярная масса растворенного вещества равна:
|
||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 144; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.128.201.71 (0.008 с.) |

 и химический потенциал чистого растворителя в паровой фазе
и химический потенциал чистого растворителя в паровой фазе 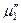 одинаковы:
одинаковы:
 ,
, .
. ,
, .
. , получим:
, получим: ,
, – парциальная мольная энтропия растворителя в растворе данного состава;
– парциальная мольная энтропия растворителя в растворе данного состава; – мольная энтропия чистого растворителя в паровой фазе.
– мольная энтропия чистого растворителя в паровой фазе.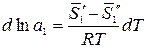 .
. . Выразим х1 через х2 и подставим в уравнение
. Выразим х1 через х2 и подставим в уравнение .
. .
.
 .
. ,
, .
.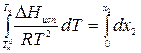 ;
; ;
;
 , поэтому в произведении
, поэтому в произведении  можно Тк заменить на Тк0, не вводя большой ошибки. Тогда получим
можно Тк заменить на Тк0, не вводя большой ошибки. Тогда получим
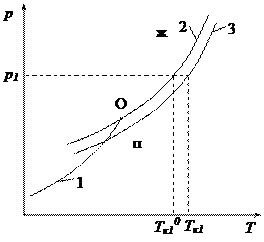 Очень часто вместо мольных долей используют другие способы выражения концентрации растворенного вещества, например, моляльность:
Очень часто вместо мольных долей используют другие способы выражения концентрации растворенного вещества, например, моляльность:
 .
.
 .
.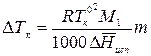 .
. ,
, .
. ,
, ,
, ,
, .
.


