
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Разделение жидких летучих смесей.Содержание книги Поиск на нашем сайте
Различие составов жидкости и равновесного с нею пара имеет большое практическое значение, так как позволяет разделять летучую смесь на практически чистые компоненты. Основными методами разделения жидких летучих смесей является перегонка и ректификация. Эти методы основаны на испарении летучей смеси и конденсации образовавшегося пара. Различают простую и фракционную перегонку или ректификацию. При простой перегонке нагревание жидкости сопровождается непрерывным отбором пара и его конденсацией. В результате простой перегонки можно выделить практически в чистом виде только один из компонентов (менее летучий компонент). Более летучий компонент при простой перегонке в чистом виде не выделяется. Фракционная перегонка заключается в многократном повторении процессов испарения и конденсации и позволяет разделить раствор на чистые компоненты. На производстве фракционная перегонка осуществляется непрерывно и называется ректификацией. Основными законами перегонки и ректификации являются законы Коновалова. Первый закон Коновалова: пар по сравнению с жидкостью обогащен тем компонентом, добавление которого к бинарной смеси увеличивает общее давление пара при данной температуре или понижает температуру кипения при данном давлении. Из первого закона Коновалова следует, что пар по сравнению с жидкостью обогащается более летучим компонентом. Таким образом, путем многократного испарения жидкости и конденсации пара можно добиться практически полного разделения компонентов.
Компонент В является более летучим по сравнению с компонентом А, так как его температура кипения ниже. Согласно диаграмме данный раствор закипит при температуре Т и появится пар, состав которого равен уВ′. Сконденсировав образовавшийся пар, получим жидкую смесь, мольная доля компонента В в которой составит хВ′, причем хВ′ > xB. Если снова нагреть полученную смесь, то получим пар состава уВ″, при конденсации которого образуется жидкая смесь такого же состава хВ″ > хВ′. Повторяя указанные действия, получим практически чистые компоненты А и В (хВ′″ ≈ 100 %). Для реальных растворов, характеризующихся значительными положительными или отрицательными отклонениями, компоненты которых имеют очень близкие температуры кипения или давления насыщенных паров, на кривых жидкости и пара наблюдаются точки экстремума. Второй закон Коновалова: точкам экстремума на кривой зависимости общего давления пара от состава раствора (температуры кипения раствора от состава раствора) соответствуют азеотропные нераздельно кипящие смеси, в которых состав жидкости и состав равновесного с нею пара одинаковы. Диаграммы состояния таких растворов представлены на рис. 2.5.
Рис. 2.5. Диаграммы р – х2(у2) и t – х2(у2) с азеотропом в минимуме давления (максимуме температуры кипения) Примером смеси, образующей азеотроп, является бражка, основными компонентами которой являются этиловый спирт и вода. При концентрации этилового спирта, равной 96 % об. образуется азеотропная смесь. Поэтому путем обычной ректификации получить 100 %-го этиловый спирт нельзя. На практике для устранения азеотропа предпринимают различные меры, например, повышают внешнее давление, в результате увеличивается температура кипения смеси и азеотроп исчезает или изменяется его состав. Коллигативные свойства растворов
Коллигативными называются физико-химические свойства разбавленных растворов, не зависящие от природы растворенного вещества и определяющиеся только его концентрацией и природой растворителя. К таким свойствам относятся: понижение давления пара над раствором по сравнению с чистым растворителем, понижение температуры замерзания и повышение температуры кипения раствора по сравнению с чистым растворителем, осмотическое давление. Понижение давления пара над раствором по сравнению С чистым растворителем Рассмотрим разбавленный раствор нелетучего вещества. Для такого раствора коэффициент активности i -го компонента γi → 1 и ai → xi. Зависимость давления пара i -го компонента над раствором от его мольной доли выражается уравнением Рауля:
Пусть 1 – летучий растворитель, а 2 – нелетучее растворенное вещество. Общее давление пара над раствором равно
Давление пара над чистым нелетучим веществом р 2 ≈ 0, следовательно им можно пренебречь, тогда
Так как мольная доля x < 1, то давление пара над раствором нелетучего вещества ниже по сравнению с давлением пара над чистым растворителем при той же температуре (рис. 2.5).
тогда получим
Преобразуем
вещества по сравнению с давлением пара чистого растворителя при той же температуре равно мольной доле растворенного вещества. На рисунке: 1 – кривая зависимости давления насыщенного пара над чистым твердым растворителем (кривая возгонки) 2 – кривая зависимости давления насыщенного пара над чистым жидким растворителем (кривая испарения); 3 – кривая зависимости давления насыщенного пара над раствором нелетучего вещества с мольной долей х2; р10 – давление насыщенного пара над чистым растворителем при температуре Т1; р1 – давление насыщенного пара над раствором при температуре Т1. Из рисунка видно, что р1 < р10.
|
||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 698; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.009 с.) |


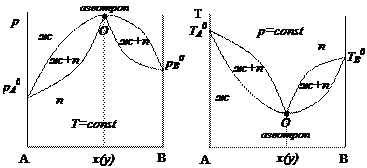
 .
. .
.
 Выразим мольную долю растворителя х1 через мольную долю растворенного вещества х2:
Выразим мольную долю растворителя х1 через мольную долю растворенного вещества х2: ,
,
 . (2.9)
. (2.9)


