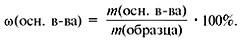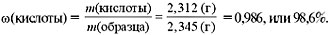Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Массовая доля вещества в раствореСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
– Сколько ложечек сахара ты кладешь в чай? – Дома – две, в гостях – восемь. Шутка известная, но давайте посмотрим на нее глазами химика. Вряд ли вам понравится такой «чай в гостях». Уж очень сладкий он будет из-за неумеренного содержания сахара! Содержание растворенного вещества в растворе химики называют концентрацией. Концентрацию вещества можно выражать различными способами. Кстати, число ложечек на чашку воды – способ вполне приемлемый, но только для кухни. Трудно представить себе химика, приготавливающего раствор таким образом. Один из самых распространенных способов выражения концентрации раствора – через массовую долю растворенного вещества. Массовой долей
Не правда ли, очень похоже на объемную долю? Так оно и есть, ведь любая доля, как вы уже знаете, – это отношение какой-то части к целому. Как и массовая доля элемента в сложном веществе, массовая доля вещества в растворе обозначается греческой буквой Самые простые растворы состоят из двух компонентов. Один из компонентов раствора – растворитель. Для нас более привычны жидкие растворы, значит, растворитель в них – жидкое вещество. Чаще всего – вода. Другой компонент раствора – растворенное вещество. Им может быть и газ, и жидкое, и твердое вещество. Масса раствора складывается из массы растворителя и массы растворенного вещества, т. е. верно выражение: m (раствора) = m (растворителя) + m (растворенного вещества). Предположим, массовая доля растворенного вещества равна 0,1, или 10%. Значит, оставшиеся 0,9, или 90%, – это массовая доля растворителя. Массовая доля растворенного вещества широко используется не только в химии, но и в медицине, биологии, физике, да и в повседневной жизни. В качестве иллюстрации к сказанному рассмотрим решение некоторых задач прикладного характера. Задача 1. Перед посадкой семена томатов дезинфицируют (протравливают) 1%-м раствором марганцовки. Какую массу такого раствора можно приготовить из 0,25 г марганцовки? Дано:
m (марганцовки) = 0,25 г. Найти: m (раствора). Решение Зная массу растворенного вещества и его массовую долю в растворе, можно вычислить массу раствора:
Ответ. m (раствора) = 25 г. Задача 2. В медицине широко применяют так называемые физиологические растворы, в частности раствор поваренной соли с массовой долей соли 0,9%. Рассчитайте массы соли и воды, необходимые для приготовления 1500 г физиологического раствора. Дано:
m (раствора) = 1500 г. Найти: m (соли), m (воды). Решение Вычислим массу соли, необходимой для приготовления 1500 г физиологического раствора: m (соли) = m (раствора)• Определим массу воды, необходимой для приготовления раствора: m (воды) = m (раствора) – m (соли) = 1500 – 13,5 = 1486,5 г. Ответ. m (соли) = 13,5 г, m (воды) = 1486,5 г. Отличаются ли свойства растворов от свойств компонентов, образующих эти гомогенные смеси? С помощью домашнего эксперимента (задание 9 к этому параграфу) вам будет нетрудно убедиться в том, что раствор замерзает при более низкой температуре, чем чистый растворитель. Например, морская вода начинает замерзать при температуре –1,9 °С, в то время как чистая вода кристаллизуется при 0 °С.
2. Массовая доля йода в аптечной йодной настойке составляет 5%. Какую массу йода и спирта нужно взять, чтобы приготовить 200 г настойки? 3. В 150 г воды растворили 25 г поваренной соли. Определите массовую долю соли в полученном растворе. 4. В 200 г столового уксуса содержится 6 г уксусной кислоты. Определите массовую долю кислоты в столовом уксусе.
6. Из 240 г 3%-го раствора питьевой соды выпарили 80 г воды. Найдите массовую долю соды в полученном растворе. 7. К 150 г 20%-го раствора сахара добавили 30 г сахара. Найдите массовую долю вещества в полученном растворе. 8. Смешали два раствора серной кислоты: 80 г 40%-го и 160 г 10%-го. Найдите массовую долю кислоты в полученном растворе.
ПРАКТИЧЕСКАЯ РАБОТА № 3. Цель данной работы состоит в приготовлении раствора с заданной массовой долей путем растворения рассчитанной массы твердого вещества в определенном объеме воды. Рассчитайте массу твердого вещества, необходимого для приготовления раствора в соответствии с вашим вариантом задания (табл. 3). На весах отмерьте рассчитанную массу твердого вещества и перенесите его в химический стакан. Таблица 3 Варианты задания к практической работе № 3
Рассчитайте массу воды, необходимой для приготовления раствора. Поскольку плотность воды равна 1 г/мл, рассчитанная вами масса численно равна ее объему. С помощью мерного цилиндра отмерьте вычисленный объем воды и прилейте его к веществу в стакане. Перемешивая содержимое стакана стеклянной палочкой, добейтесь полного растворения вещества в воде. Требуемый раствор готов. Массовая доля примесей На примере замерзания раствора соли вы убедились, что присутствие посторонних соединений изменяет свойства вещества. В некоторых областях техники использование недостаточно «чистых» материалов недопустимо. Микросхему компьютера не сделать без особо чистого кристалла кремния, в атомной энергетике предъявляются повышенные требования к очистке ядерного топлива, световой сигнал «погаснет» в стекловолоконном кабеле, наткнувшись на посторонние вкрапления. Если главное (основное) вещество содержит посторонние загрязнения – это тоже смесь, только в этом случае все ненужные, а порой и вредные ее компоненты называют одним словом – примеси. Чем меньше примесей, тем чище вещество. Иногда вещество, содержащее примеси, называют техническим образцом или просто образцом. Следовательно, любой такой образец включает основное вещество и примеси. Степень чистоты вещества принято выражать массовой долей основного компонента или массовой долей примесей. С массовыми долями разного типа вы уже знакомы. Попробуйте теперь сами сформулировать определение, что такое массовая доля примесей в веществе. Получилось? Сравните. Массовой долей примесей называется отношение массы примесей к массе образца:
Предположим, вам нужно вычислить массовую долю основного вещества в образце. Тогда можно воспользоваться формулой:
Следует не забывать, что сумма массовых долей основного вещества и примесей всегда равна 1, или 100%:
Также справедливо утверждение, что масса образца складывается из массы основного вещества и массы примесей: m (образца) = m (осн. в-ва) + m (примесей). Разберем несколько задач с использованием понятия «массовая доля примесей». Задача 1. Природная самородная сера содержит 8% примесей. Какая масса чистой серы содержится в 2 т природного образца? Дано:
m (образца) = 2 т. Найти: m (серы). Решение Вычислим массу примесей в 2 т самородной серы: m (примесей) = m (образца)• Рассчитаем массу чистой серы, содержащейся в природном образце: m (серы) = m (образца) – m (примесей) = 2 (т) – 0,16 (т) = 1,84 т. Ответ. m (серы) = 1,84 т. Задача 2. В пищевой отрасли промышленности можно использовать лимонную кислоту, содержащую не более 1% посторонних примесей. В аналитической лаборатории установлено, что в 2,345 г продукта содержится 2,312 г кислоты. Можно ли использовать продукт в пищевых целях? Дано: m (образца) = 2,345 г, m (кислоты) = 2,312 г. Найти:
Решение Вычислим массовую долю лимонной кислоты в образце:
Рассчитаем массовую долю примесей в образце:
Ответ. Данный образец лимонной кислоты не может быть использован в пищевой отрасли промышленности.
2. В промышленности используются вещества с маркировкой «ч», что означает «чистое вещество». Содержание примесей в них может составлять, например, 0,01%. Найдите максимально допустимую массу примесей в 120 г образца сажи с маркировкой «ч». 3. Массовая доля примесей в известняке составляет 5%. Рассчитайте массу основного вещества (карбоната кальция), содержащегося в 300 кг природного известняка.
5. Для изготовления полупроводниковых батарей используется сверхчистый кремний. Массовая доля примесей в нем не должна превышать 0,000 000 0001%. Годится ли для данных целей кремний, в 30 кг которого содержится 0,03 мг примесей? http://him.1september.ru/2006/08/9.htm
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-25; просмотров: 2488; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.19.206 (0.008 с.) |

 вещества в растворе называют отношение массы растворенного вещества к массе раствора:
вещества в растворе называют отношение массы растворенного вещества к массе раствора:
 («омега») и может принимать значения от 0 до 1 (или от 0 до 100%). Она показывает, какая часть массы раствора приходится на растворенное вещество. И еще: массовая доля вещества в процентах численно равна массе растворенного вещества в 100 г раствора. К примеру, в 100 г 3%-го раствора уксуса содержится 3 г чистой уксусной кислоты.
(«омега») и может принимать значения от 0 до 1 (или от 0 до 100%). Она показывает, какая часть массы раствора приходится на растворенное вещество. И еще: массовая доля вещества в процентах численно равна массе растворенного вещества в 100 г раствора. К примеру, в 100 г 3%-го раствора уксуса содержится 3 г чистой уксусной кислоты.
 1. Что такое массовая доля растворенного вещества? Сравните понятия «объемная доля» и «массовая доля» компонентов смеси.
1. Что такое массовая доля растворенного вещества? Сравните понятия «объемная доля» и «массовая доля» компонентов смеси.