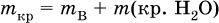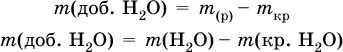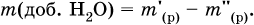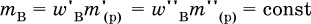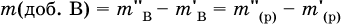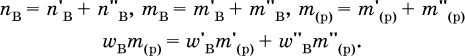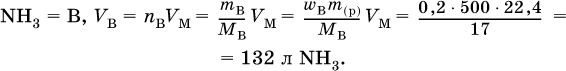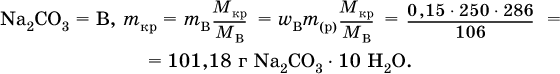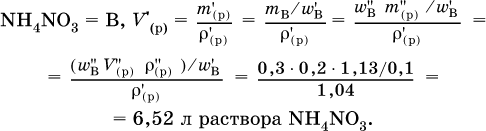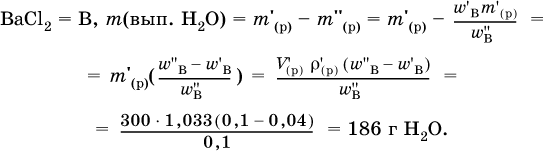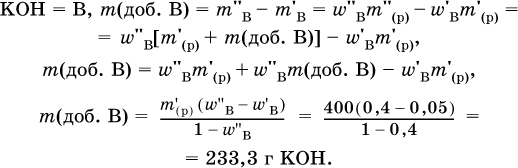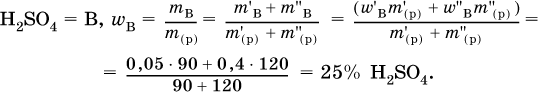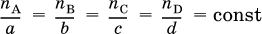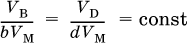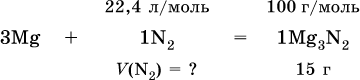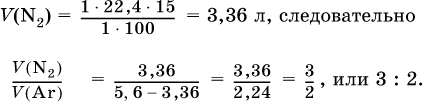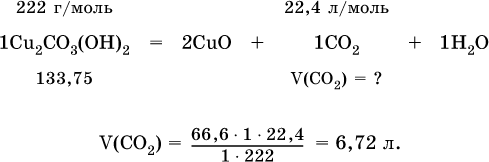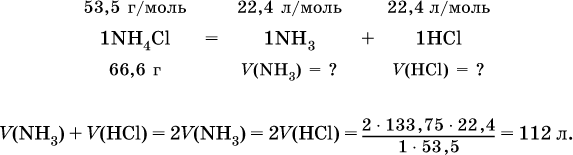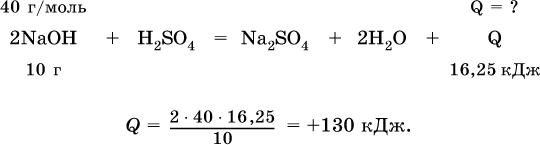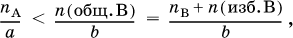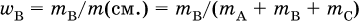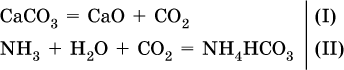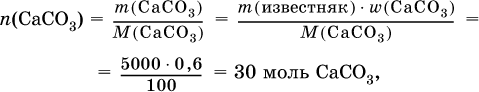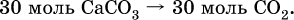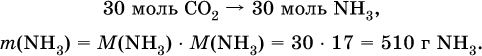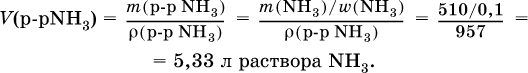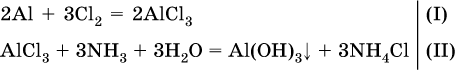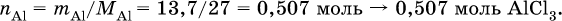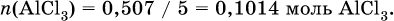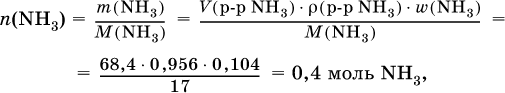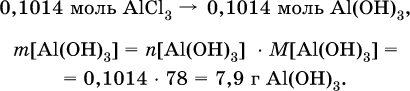Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Массовая доля растворенного вещества. Разбавление, концентрирование и смешивание растворовСодержание книги
Поиск на нашем сайте
Массовая доля растворенного вещества В (ω в) – это отношение массы вещества В (т в) к массе раствора (m (р)):
При решении ω в выражается всегда в долях единицы (например, ω в = 0,01), в ответе – часто в процентах (ω в=1 %). Величина, численно равная ω в (в %), характеризует раствор в целом, например, при ω в = 1 % раствор будет однопроцентным (1 %‑ный раствор вещества В). Соотношения для массы раствора:
где ρ(р) – плотность и V(p) – объем раствора. Для воды условно считается, что ее масса и объем численно равны, т. е. плотность принимается равной 1 г/мл или 1000 г/л. Если для приготовления раствора берется кристаллогидрат некоторой соли (а не сама безводная соль), то используются соотношения: а) масса кристаллогидрата В хН2O
где m (кр. Н2O) – масса воды, которая содержится в данной массе кристаллогидрата; б) масса безводной соли В в кристаллогидрате
так как n в = n кр; б) масса добавляемой воды
где т( Н2O) – суммарная масса воды в приготовленном растворе. В лабораторной практике часто приходится готовить разбавленный раствор вещества (величины с индексом ') из концентрированного раствора того же вещества (величины с индексом ") путем разбавления водой. Масса растворенного вещества при разбавлении не изменяется:
Масса добавляемой воды определяется соотношением:
Для приготовления концентрированного раствора вещества В из разбавленного раствора применяют два способа. а) Выпаривание некоторой порции воды из начального раствора. При этом масса растворенного вещества не меняется.
а масса воды, которую удаляют из раствора, определяется соотношением:
б) Добавление некоторой порции вещества В в начальный раствор. При этом масса воды не изменяется:
а масса добавленного вещества определяется соотношением
Для приготовления раствора с промежуточным составом (величины без индексов) проводят смешивание концентрированного и разбавленного растворов вещества В. При этом все величины связаны соотношениями:
Примеры решения задач
1. Вычислите объем (в литрах, н.у.) аммиака, который полностью поглощается водой с образованием 500 г 20 %‑ного раствора.
2. Какую массу (в граммах) кристаллогидрата Na2CO3 10Н2O следует использовать для приготовления 250 г 15 %‑ного раствора безводной соли?
3. До какого объема (в литрах) надо разбавить водой 250 мл 30 %‑ного раствора нитрата аммония (плотность раствора 1,13 г/мл), чтобы приготовить 10 %‑ный раствор (плотность 1,04 г/мл)?
4. Установите массу (в граммах) выпаренной воды из 300 мл 4%‑ного раствора хлорида бария (плотность раствора 1033 г/л), если приготовлен 10 %‑ный раствор.
5. Вычислите массу (в граммах) порции гидроксида калия, которую добавили в 400 г 5%‑ного раствора этого вещества и довели массовую долю до 40 %.
6. Определите массовую долю (в %) серной кислоты в конечном растворе, приготовленным смешиванием 90 г 5%‑ного и 120 г 40 %‑ного растворов этого вещества.
Задания для самостоятельного решения части В
1. Установите массовую долю (в %) хлорида калия в растворе, приготовленным из 0,65 моль соли и 300 мл воды. 2. Приготовлено 300 г 5%‑ного раствора иода в этаноле. Рассчитайте массу (в граммах) использованного спирта. 3. Какой объем (в литрах, н. у.) метаналя необходимо растворить в 500 мл воды, чтобы приготовить 30 %‑ный формалин. 4. Рассчитайте массовую долю (в %) сульфата цинка (II), если раствор приготовлен из 0,75 моль кристаллогидрата ZnSO4 7Н2O и 600 г воды. 5. Найдите массу (в граммах) кристаллогидрата CuSO4 5Н2O, которую необходимо взять для приготовления 160 г 10 %‑ного раствора безводной соли. 6. Бромоводород объемом 5,4 л (н. у.) затрачен на приготовление 8 %‑ного раствора (плотность равна 1056,8 г/л). Вычислите объем (в литрах) этого раствора. 7. Определите массу (в граммах) добавленной воды, необходимой для приготовления 10 %‑ного раствора из 1 моль дигидрата гидроксида калия. 8. Установите массу (в граммах) 4 % – ного раствора нитрата калия, приготовленного путем разбавления водой из 20 г 15 %‑ного раствора. 9. Рассчитайте, до какого объема (в литрах) надо разбавить водой 700 г 50,5 %‑ного раствора ацетата калия, чтобы приготовить 7,7 %‑ный раствор с плотностью 1038 г/л. 10. Какой объем (в литрах) воды необходим для разбавления 200 мл 96 %‑ного этанола (плотность 0,8 г/мл) до 10 %‑ного спирта? 11. К 100 г 35 %‑ного водного раствора метанола добавили 50 г того же вещества. Найдите массовую долю (в %) спирта в конечном растворе. 12. К 250 мл 8% – ного раствора нитрата серебра (I) добавили еще соли и приготовили 16 %‑ный раствор. Установите добавленное количество соли (моль). 13. Какой объем (в литрах, н. у.) аммиака надо растворить в 1 л 10 %‑ного раствора (плотность 0,96 г/мл) того же вещества для приготовления 15 %‑ного раствора? 14. Определите массовую долю (в %) нитрата натрия в конечном растворе, приготовленным смешиванием 90 г 5%‑ного и 120 г 40 %‑ного растворов. 15. Какую массу в граммах 96 %‑ный серной кислоты надо смешать с 200 г 5%‑ный кислоты, чтобы приготовить 20 %‑ный раствор? 16. Смешали 250 мл 30 %‑ного водного раствора метанола (плотность раствора 0,954 г/мл) и 300 г 40 %‑ного раствора того же спирта. Какой станет массовая доля (в %) вещества в конечном растворе? 17. Заполнили колбу вначале хлороводородом (н. у.), затем водой. Какова массовая доля (в %) вещества в приготовленном растворе? 18. Гидроортофосфат кальция образует 0,02 %‑ный насыщенный раствор в комнатных условиях. Найдите минимальный объем (в литрах) воды, требующийся для растворения 100 г соли. 19. Приготовлен раствор из 219 г кристаллогидрата СаCl2 6Н2O и 1 л воды. Рассчитайте массовую долю (в %) безводной соли в этом растворе. 20. Определите количество гидроксида калия (моль), содержащееся в 3 л 25 %‑ного раствора (плотность 1,24 г/мл). 21. Найдите объем (мл) воды, в котором надо растворить 70 г Fe(NO3)3 9Н2O для приготовления 12 %‑ного раствора. 22. Каким количеством воды (моль) надо разбавить 500 мл 20 %‑ный азотной кислоты (плотность 1,12 г/мл), чтобы приготовить 8 %‑ный раствор? 23. Разбавлением водой приготовлен 1 кг 3,5 %‑ный уксусной кислоты из 70 %‑ной (плотность 1,069 г/мл). Найдите объем (мл) исходного раствора кислоты. 24. Приготовили раствор 10 г сахарозы в 200 г воды. Затем раствор упарили вдвое (по объему). Определите массовую долю (в %) углевода в конечном растворе. 25. К 1 л 25 %‑ного раствора едкого натра (плотность раствора 1,28 г/мл) добавляют порцию той же щелочи и готовят 35 %‑ный раствор. Рассчитайте массу (в граммах) этой порции. 26. Смешали 300 мл 10 %‑ный хлороводородной кислоты (плотность 1,05 г/мл) и 100 г 5%‑ной кислоты. Определите массовую долю (в %) растворенного вещества в конечном растворе. 27. Водный 5 %‑ный раствор нитрата стронция массой 320 г смешали с 45 г 38 %‑ного раствора того же вещества. Рассчитайте конечную массовую долю (в %) растворенного вещества.
Объемное отношение газов
Для химической реакции a A + b B = c C + d D выполняется соотношение
где n А и n В – количества вступивших в реакцию исходных веществ, п С и n D – количества образовавшихся продуктов, а, b, с и d – стехиометрические коэффициенты. От количеств веществ легко перейти к их массам:
Для газообразных веществ чаще задают или определяют их объемы. Если реагент В и продукт D – газы, то проводят переход от количеств этих веществ к их объемам:
При известных (по условию) количестве, массе или объеме (для газа) одного из веществ, участвующих в реакции, можно рассчитать значения всех величин для остальных веществ. В случае смеси газов А и В, один из которых участвует в реакции, можно найти взятое соотношение их объемов V A : V B, а при заданном соотношении – объем их смеси (или наоборот).
Пример решения задачи
При высокой температуре магний реагирует с азотом, взятым в виде смеси с аргоном, общим объемом 5,6 л (н.у.), и образует 15 г нитрида. Рассчитайте объемное отношение газов V (N2): V (Ar) в исходной смеси.
Задания для самостоятельного решения части А
1. Прореагировало 6 л оксида азота (II) с 5 л кислорода (объемы измерены при равных условиях), следовательно, в конечной смеси объемное отношение продукта к одному из реагентов равно 1) 3: 1 2) 2: 1 3) 1: 2 4) 1: 3
2. В замкнутом сосуде сожгли 24 г графита в 67,2 л (н. у.) кислорода и получили объемное отношение кислород: продукт равным 1) 2: 1 2) 1: 1 3) 1: 2 4) 2: 3
3. Пропустили через озонатор 7,5 моль кислорода, который частично превратился в озон. Последний полностью затрачен на «сжигание» (при нормальных условиях) 0,5 моль сероводорода (превращается в SO2); следовательно, объемное отношение O3: O2 на выходе из озонатора составляло 1) 1: 12 2) 1: 19 3) 2: 27 4) 2: 33
4. Бромид калия массой 142,8 г прореагировал количественно в растворе с хлором, взятым в виде смеси с воздухом в объемном отношении 1 (хлор): 2 (воздух). Общий объем (в литрах) исходной смеси газов был 1) 22,4 2) 40,32 3) 13,44 4) 26,88
5. Для полного сгорания 17,92 л (н.у.) смеси СН4 + Н2 потребовался 1 моль кислорода. В исходной смеси объемное отношение СН4: Н2 равно: 1) 2: 1 2) 1: 1 3) 1: 2 4) 3: 2
6. Газ А, полученный при прокаливании 0,04 моль КClO3 на катализаторе, смешали (при н. у.) в сосуде с газом Б, выделившимся при обработке 6 г кальция водой, и получили смесь с объемным отношением А: Б, равным 1) 1: 5 2) 2: 5 3) 3: 4 4) 5: 7
7. После сжигания нитробензола в избытке кислорода получена смесь продуктов (азот, углекислый газ, вода), в которой содержится 4 л (н. у.) азота, а объемное отношение N2: O2 равно 4: 1. В этих условиях исходный объем (в литрах, н. у.) кислорода составлял 1) 11,2 2) 22,4 3) 25,5 4) 51,0
8. Проведено термическое разложение 1 моль хлорида аммония в стальном баллоне, уже содержавшем 11,2 л (н. у.) аммиака. Конечное объемное отношение NH3: НCl равно 1) 5: 2 2) 3: 2 3) 5: 1 4) 3: 1
9. Смесь кислорода и хлора с объемным отношением 9: 1 использована для выделения 0,5 моль простого вещества из раствора KI, следовательно, общий объем (в литрах, н. у.) затраченной смеси газов равен 1) 5,6 2) 56 3) 11,2 4) 112
10. Через озонатор пропустили кислород, полученный при прокаливании 1 моль КClO3 на катализаторе, при этом 5 % кислорода превратилось в озон и на выходе из озонатора объемное отношение O2: O3 составило 1) 23: 1 2) 23: 2 3) 29: 1 4) 29: 2
15.3. Масса вещества (объем газа) по известному количеству другого реагента (продукта)
Примеры решения задачи
1. Прокалили 66,6 г минерала малахит Cu2СO3(OН)2. Установите объем (в литрах, н.у.) собранного газа.
2. Определите суммарный объем (в литрах, н.у.) газов, полученных при термическом разложении 133,75 г хлорида аммония.
Задания для самостоятельного решения части В
1. Какой объем (в литрах, н.у.) газа выделяется при обработке водой смеси 0,2 моль натрия и 1,4 г лития? 2. При действии избытка воды на 10 г некоторого металла из главной подгруппы II группы выделилось 5,6 (н.у.) газа. О каком металле идет речь? 3. В концентрированный раствор щелочи вносят 2,7 г алюминия. Найдите объем (в литрах, н.у.) собранного газа. 4. На сжигание 0,64 г металла расходуется 12 мл (н.у.) кислорода. Какой металл был взят? 5. Металлическая пластинка массой 50 г после пребывания в соляной кислоте уменьшилась на 1,68 % (по массе), при этом выделилось 0,336 л (н.у.) газа. Из какого металла изготовлена пластинка? 6. При нагревании 139,2 г оксида металла (I) выделилось 6,72 л (н.у.) газа. Оксид какого металла был использован? 7. После обработки равномолярной смеси Mg + Zn избытком едкого натра (конц.) образовалось 4,48 л (н.у.) газа. Рассчитайте массу (в граммах) исходной смеси. 8. Установите объем (в литрах, н.у.) хлора, вступившего в реакцию со щелочью в горячем растворе, если образовалось 0,46 моль хлорид‑ионов. 9. Вычислите объем (в литрах, н.у.) полученного газа, если в реакцию с кипящей серной кислотой (конц.) вступило O,5 моль фторида кальция. 10. Сероводород (4,48 л при н.у.) смешали с избытком диоксида серы. Какова масса (в граммах) твердого продукта этой реакции? 11. Поглощение 5,6 л (н.у.) сероводорода раствором нитрата висмута (III) приводит к выпадению осадка средней соли. Найдите массу (в граммах) этого осадка. 12. Раствор гидроксида цезия поглотил 17,92 л (н.у.) диоксида серы с образованием средней соли. Вычислите массу (в граммах) щелочи, истраченной на реакцию. 13. Прокалили 99,3 г нитрата свинца (II). Определите суммарный объем (в литрах, н.у.) полученных газов. 14. В избыток воды внесено 3,75 моль оксида фосфора (V). Какая масса (в граммах) продукта образовалась? 15. Прокаливанием 192 г карбоната аммония получена смесь двух газов и вода. Установите общий объем (в литрах, н.у.) смеси. 16. Внесено 14 г аморфного кремния в концентрированный раствор едкого натра. Рассчитайте объем (в литрах, н.у.) собранного газа. 17. Какой объем в литрах (н.у.) хлора потребуется для получения из метана 4 моль хлороформа? 18. Найдите количество бромэтана (моль), вступившее в реакцию с натрием, если образовалось 237 л (н.у.) органического продукта. 19. Ацетилен обесцвечивает бромную воду с образованием 3,46 г конечного продукта. Определите объем (мл, н.у.) затраченного алкина. 20. Каталитическая реакция дегидрирования 49 г метилциклогексана приводит к получению гомолога бензола. Вычислите объем (в литрах, н.у.) образовавшегося одновременно газа. 21. Этанол с плотностью 0,8 г/мл затрачен на получение 44,8 л (н.у.) дивинила. Установите расход (мл) спирта. 22. На восстановление 10 кмоль этаналя в соответствующий спирт используют водород. Найдите его затраченный объем (м3, н.у.). 23. Рассчитайте объем (в литрах, н.у.) газа, полученного при спиртовом брожении 5 моль глюкозы. 24. При сгорании природной аминокислоты (с одной группой NH2 в молекуле) в кислороде получена смесь N2 + СO2 общим объемом 0,56 л (н.у.) и плотностью по водороду 20,4. Определите массу (мг) взятой кислоты.
Тепловой эффект реакции
Пример решения задачи части В
Вычислите тепловой эффект (кДж) реакции полной нейтрализации гидроксида натрия серной кислотой, если в расчете на 10 г щелочи выделяется 16,25 кДж теплоты.
Задания для самостоятельного решения части А
1. В реакции между железом и хлором на 11,2 л (н.у.) окислителя приходится выделение 132 кДж теплоты, следовательно, в расчете на 0,5 моль железа выделится количество теплоты (кДж), равное 1) +198 2) +148,5 3) +99 4) +49,5
2. Триоксид серы массой 280 г вносят в воду, протекает реакция с тепловым эффектом +73 кДж. Количество теплоты (кДж) в условиях опыта равно 1) +204,4 2) +255,5 3) +408,8 4) +511
3. Термическое разложение нитрата калия привело к выделению 4,48 л (н.у.) газа. Тепловой эффект реакции равен ‑282 кДж, следовательно, сопровождающее процесс количество теплоты (кДж) составляет 1) ‑56,4 2) ‑112,8 3) ‑225,6 4) ‑282
4. Сожжено 10 л (н.у.) аммиака на воздухе (тепловой эффект реакции +1532 кДж). По условию опыта количество теплоты составит 1) +171 2) +342 3) +766 4) +855
5. Термическое разложение карбоната кальция с тепловым эффектом ‑179 кДж привело к получению 33,6 г твердого остатка. В этих условиях поглощенное количество теплоты (кДж) равно 1) ‑537 2) ‑214,8 3) ‑375,9 4) ‑107,4
6. При термическом разложении дихромата аммония протекает экзотермическая реакция, в которой на 1,4 моль образовавшейся воды приходится +106 кДж; следовательно тепловой эффект реакции (кДж) равен: 1) +505 2) +404 3) +303 4) +606
7. Реакция сгорания угарного газа в кислороде сопровождается экзо‑эффектом +566 кДж. Количество теплоты (кДж), приходящееся на 224 г угарного газа, равно 1) +1132 2) +2264 3) +283 4) +566
8. Тепловой эффект реакции полного сгорания ацетилена в кислороде равен +2596 кДж. При сгорании 2 л (н.у.) этого газа выделяется количество теплоты (кДж) 1) +29 2) +58 3) +116 4) +232
9. В термическом разложении метана с образованием ацетилена и 560 л (н.у.) водорода тепловой эффект реакции равен ‑376 кДж. Количество поглощенной теплоты (кДж) в условиях опыта составляет 1) ‑2256 2) ‑752 3) ‑1128 4) ‑376
10. При полном сгорании бутадиена‑1,3 в кислороде на 0,5 моль затраченного окислителя выделяется +18 кДж теплоты, следовательно, на 0,5 моль вступившего в реакцию алкадиена приходится количество теплоты (кДж), равное 1) +49,5 2) +99 3) +148,5 4) +198
15.5. Масса (объем, количество вещества) продукта по реагенту в избытке или с примесями
Избыток и недостаток реагентов. Количества, массы и объемы (для газов) реагентов не всегда берутся стехиометрическими, т. е. в соответствии с уравнениями реакции. Чаще один из реагентов берется в избытке, а следовательно, другой реагент оказывается в недостатке. Избыток реагента участвовать в реакции не будет. Для реакции a A + b B = c C + d D определение реагентов, взятых в избыткеи в недостатке, проводят по неравенству (А – в недостатке, В – в избытке):
где n (общ. В) – общее (взятое с избытком) количество реагента В, п B – стехиометрическое (необходимое для реакции) количество В, n (изб. В) – избыточное количество В, причем
n (изб. B) = n (общ. B) – n B.
Внимание! Расчет получаемых количеств (масс, объемов) продуктов проводят по реагенту в недостатке. Степень чистоты вещества. Химические вещества никогда не бывают идеально чистыми, они всегда содержат в себе примеси. Массовая доля вещества В в смеси, например А + В + С, – это отношение массы вещества В к массе смеси:
Сумма массовых долей всех веществ смеси равна 1 (100 %). Если в смеси примесь присутствует в следовом (неопределяемом) количестве, то говорят о практически чистом веществе. Когда же в веществе имеется примесь в заметном (определяемом) количестве, то само вещество называют основным (его количество преобладает), а другое вещество – это и есть примесь. Степень чистоты основного вещества В – это массовая доля этого вещества в навеске с определенной массой:
Природные вещества (минералы, руды) всегда содержат заметное количество примеси (примесей).
Пример решения задачи
Углекислый газ поглощается 10 %‑ным раствором аммиака (плотность раствора 957 г/л) с образованием кислой соли. Предварительно СO2 получают термическим разложением 5 кг известняка СаСO3 (степень чистоты 60 %). Установите взятый объем (в литрах) раствора аммиака. Элементы ответа. 1) Составлены уравнения реакций:
2) Установлено количество основного вещества в известняке:
и количество углекислого газа по уравнению (I):
3) Установлена масса затраченного аммиака по уравнению (II):
4) Установлен объем взятого раствора аммиака:
Задания для самостоятельного решения частей В, С
1. К 100 г 10 %‑ного раствора хлорида кальция добавили 100 г 10 % – ного раствора AgNO3. Найдите массу (в граммах) осадка. 2. Смешали горячие растворы, содержащие по 33 г хлорида алюминия и сульфида калия. Установите объем (в литрах, н.у.) выделившегося газа. 3. Какой объем (в литрах, н.у.) хлора можно получить при взаимодействии 2 моль хлороводорода (взят в виде соляной кислоты) и 3 моль оксида марганца(IV)? 4. Через раствор, приготовленный из 2 г смеси NaCl + Nal и 100 мл воды, пропустили 1 л (н.у.) хлора. Затем раствор выпарили и сухой остаток нагрели. Получили 1,78 г твердого вещества. Рассчитайте массовую долю (в %) хлорида в исходном растворе. 5. Вычислите объем (в литрах, н.у.) газа, полученного действием кипящей H2SO4 (конц.) на 292,5 г хлорида натрия, содержащего 2O% инертных примесей. 6. После прокаливания 50 г минерала тенорит (CuО и инертные примеси) в токе водорода образуется металл и конденсируется вода объемом 8,1 мл. Определите степень чистоты (в %) этого минерала. 7. Установите массу (кг) технического алюминия (степень чистоты 98 %), требуемую для получения 64,22 кг хрома из оксида хрома (III). 8. Прокалили 32,1 г хлорида аммония с 55,5 г гидроксида кальция (содержит 20 % инертных примесей). Рассчитайте объем (в литрах, н.у.) собранного газа. 9. К 285 г нитрата натрия (содержит примесь хлорида магния) добавили раствор избытка нитрата серебра (I). Выпал осадок массой 86,1 г. Вычислите степень чистоты (в %) нитрата натрия. 10. Найдите массовую долю (в %) примеси NaHCO3 в образце технической соды Na2CO3, если после нагревания 10 г образца получено 9,69 г твердого остатка. 11. Смешали 20 г уксусной кислоты и 8,4 г питьевой соды NaHCO3. Определите объем (в литрах, н.у.) газа, собранного после окончания реакции. 12. На гидрирование 250 г смеси Cl7Н33СООН + Cl7Н35СООН затратили 16,8 л (н.у.) газа. Установите массовую долю (в %) предельной карбоновой кислоты в исходной смеси.
15.6. Масса (объем, количество вещества) продукта по реагенту с известной массовой долей в растворе
Пример решения задачи
Навеску алюминия массой 13,7 г полностью сожгли в хлоре, а из образовавшейся соли приготовили 250 мл раствора. Пробу в 50 мл этого раствора слили с 68,4 мл 10,4 %‑ного раствора аммиака (плотность раствора 0,956 г/мл). Определите массу (в граммах) выпавшего осадка. Элементы ответа. 1) Составлены уравнения реакций:
2) Определены количества AlCl3 в реакциях (I) и (II): в реакции (I)
в реакции (II) взята 1/5 часть AlCl3, т. к.
отсюда
3) Определено количество NH3 в растворе для реакции (II):
следовательно, NH3 – в избытке, и расчет далее ведется по AlCl3. 4) Определена масса Al(ОН)3 по уравнению (II): 0,1014 моль AlCl3 – 0,1014 моль Al(ОН)3,
Задания для самостоятельного решения частей В, С
1. Приготовили раствор 134,4 л (н.у.) диоксида серы и добавили 1,5 л 25 %‑ного раствора гидроксида натрия (плотность раствора 1,28 г/мл). Определите массу (в граммах) образовавшейся соли. 2. Сульфид свинца (II) массой 95,6 г обрабатывают с помощью 300 мл 30 %‑ного раствора пероксида водорода (плотность раствора 1122,2 г/л). Рассчитайте массу (в граммах) продукта – сульфата свинца (II). 3. Смешали 100 г 5,64 %‑ного раствора фенола и 100 г 17,92 %‑ного раствора гидроксида калия. Найдите массовую долю (в %) избытка одного из реагентов в конечном растворе. 4. Установите массу (в граммах) железной пластинки после выдерживания в 110 мл 10 %‑го раствора CuSO4 (плотность раствора 1,1 г/мл), если до опыта ее масса составляла 11,5 г. 5. Вычислите объем (в литрах) 96 %‑ного водного спирта с плотностью 0,81 кг/л, полученного каталитической гидратацией 112 м3 (н.у.) этилена, содержащего 12,5 % (по объему) этана. 6. Газ, полученный сжиганием 44,8 л (н.у.) сероводорода в кислороде, поглощен с помощью 0,5 л 25 %‑ного раствора гидроксида натрия (плотность раствора 1,275 г/ мл). Определите массовую долю (в %) соли в конечном растворе. 7. Углекислый газ объемом 15 л (н.у.) пропущен через 560 г 5%‑ного раствора гидроксида калия. Найдите массу (в граммах) соли, полученной в этом процессе. 8. Железная пластинка массой 5 г опущена на некоторое время в 50 мл 15 %‑ного раствора сульфата меди (II) с плотностью 1,12 г/мл. Масса пластинки увеличилась на 0,16 г. Какова массовая доля (в %) сульфата меди (II) в оставшемся растворе? 9. По реакции Кучерова получен этаналь, который переведен в соответствующую кислоту в виде 100 г 6%‑ного водного раствора. Найдите объем (в литрах, н.у.) исходного органического соединения в получении этаналя. 10. Определите массовую долю (в %) избытка одного из реагентов в растворе после сливания 80 г 10 %‑ного раствора гидроксида натрия и 2O г 18,25 %‑ной хлороводородной кислоты. 11. Установите объем (в литрах, н.у.) газа, собранного после внесения 0,3 моль алюминия в 160 мл 20 %‑ного раствора гидроксида калия (плотность раствора 1,19 г/мл). 12. Найдите массу (в граммах) органического продукта, полученного при смешивании 250 г 94 % – ного водного раствора фенола и 2143 г 3,5 %‑ной бромной воды.
|
||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 477; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.108.125 (0.017 с.) |