Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Распространенные элементы. строение атомов. Электронные оболочки. ОрбиталиСодержание книги
Поиск на нашем сайте
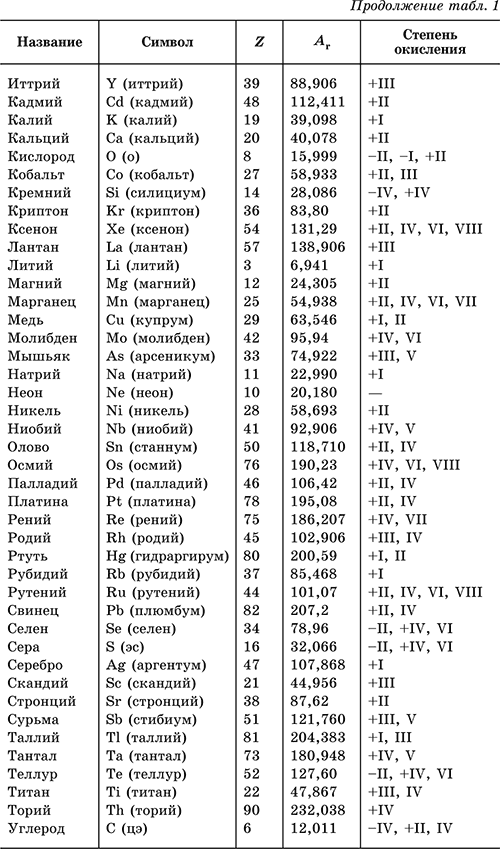
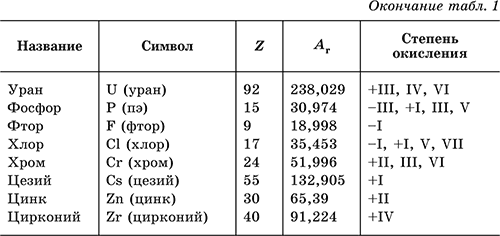
Химический элемент – определенный вид атомов, обозначаемый названием и символом и характеризуемый порядковым номером и относительной атомной массой. В табл. 1 перечислены распространенные химические элементы, приведены символы, которыми они обозначаются (в скобках – произношение), порядковые номера, относительные атомные массы, характерные степени окисления. Нулевая степень окисления элемента в его простом веществе (веществах) в таблице не указана.
Все атомы одного элемента имеют одно и то же число протонов в ядре и число электронов в оболочке. Так, в атоме элемента водород Н находится 1 р+ в ядре и на периферии 1 е ‑; в атоме элемента кислород О находится 8 р+ в ядре и 8 е ‑ в оболочке; атом элемента алюминий Аl содержит 13 р + в ядре и 13 е ‑ в оболочке. Атомы одного элемента могут различаться числом нейтронов в ядре, такие атомы называются изотопами. Так, у элемента водород Н три изотопа: водород‑1 (специальное название и символ протий 1H) с 1 р+ в ядре и 1 е ‑ в оболочке; водород‑2 (дейтерий 2Н, или D) с 1 р+ и 1 п 0 в ядре и 1 е ‑ в оболочке; водород‑3 (тритий 3Н, или Т) с 1 р+ и 2 п 0 в ядре и 1 е ‑ в оболочке. В символах 1Н, 2Н и 3Н верхний индекс указывает массовое число – сумму чисел протонов и нейтронов в ядре. Другие примеры:
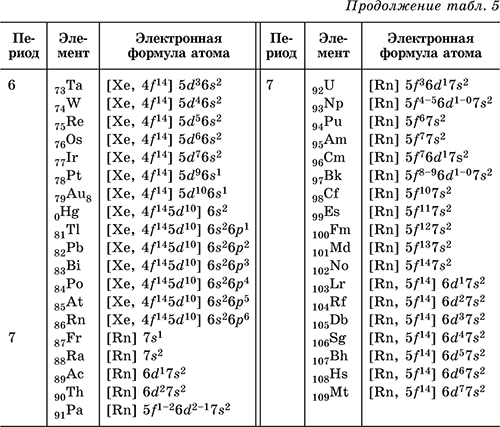
Электронную формулу атома любого химического элемента в соответствии с его расположением в Периодической системе элементов Д. И. Менделеева можно определить по табл. 2.
Электронная оболочка любого атома делится на энергетические уровни (1, 2, 3‑й и т. д.), уровни делятся на подуровни (обозначаются буквами s, р, d, f). Подуровни состоят из атомных орбиталей – областей пространства, где вероятно пребывание электронов. Орбитали обозначаются как 1s (орбиталь 1‑го уровня s‑подуровня), 2 s, 2 р, 3 s, 3 р, 3d, 4 s … Число орбиталей в подуровнях:
Заполнение атомных орбиталей электронами происходит в соответствии с тремя условиями: 1) принцип минимума энергии
Электроны заполняют орбитали, начиная с подуровня с меньшей энергией.
Последовательность нарастания энергии подуровней:
1 s < 2 c < 2 p < 3 s < 3 p < 4 s ≤ 3 d < 4 p < 5 s ≤ 4 d < 5 p < 6 s …
2) правило запрета (принцип Паули)
В каждой орбитали может разместиться не более двух электронов.
Один электрон на орбитали называется неспаренным, два электрона – электронной парой:
3) принцип максимальной мультиплетности (правило Хунда)
В пределах подуровня электроны сначала заполняют все орбитали наполовину, а затем – полностью.
Каждый электрон имеет свою собственную характеристику – спин (условно изображается стрелкой вверх или вниз). Спины электронов складываются как вектора, сумма спинов данного числа электронов на подуровне должна быть максимальной (мультиплетность):
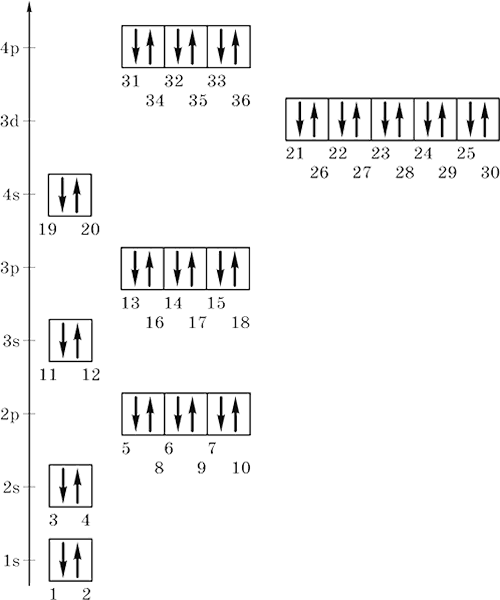
Заполнение электронами уровней, подуровней и орбиталей атомов элементов от Н (Z = 1) до Kr (Z = 36) показано на энергетической диаграмме (номера отвечают последовательности заполнения и совпадают с порядковыми номерами элементов):
Из заполненных энергетических диаграмм выводятся электронные формулы атомов элементов. Число электронов на орбиталях данного подуровня указывается в верхнем индексе справа от буквы (например, 3 d 5 – это 5 электронов на З d ‑подуровне); вначале идут электроны 1‑го уровня, затем 2‑го, 3‑го и т. д. Формулы могут быть полными и краткими, последние содержат в скобках символ соответствующего благородного газа, чем передается его формула, и, сверх того, начиная с Zn, заполненный внутренний d‑подуровень. Примеры: 1H = 1s1 2Не = 1s2 3Li = 1s22s1 = [2He]2s1 8O = 1s2 2s22p4 = [2He] 2s22p4 13Al = 1s22s22p6 3s23p1 = [10Ne] 3s23p1 17Cl = 1s22s22p6 3s23p5 = [10Ne] 3s23p5 2OСа = 1s22s22p63s23p 4s2 = [18Ar] 4s2 21Sc = 1s22s22p63s23p6 3d14s2 = [18Ar] 3d14s2 25Mn = 1s22s22p63s23p6 3d54s2 = [18Ar] 3d54s2 26Fe = 1s22s22p63s23p6 3d64s2 = [18Ar] 3d64s2 3OZn = 1s22s22p63s23p63d10 4s2 = [18Ar, 3d10] 4s2 33As = 1s22s22p63s23p63d10 4s24p3 = [18Ar, 3d10] 4s24p3 36Kr = 1s22s22p63s23p63d10 4s24p6 = [18Ar, 3d10] 4s24p6 Электроны, вынесенные за скобки, называются валентными. Именно они принимают участие в образовании химических связей. Исключение составляют: 24Cr = 1s22s22p63s23p6 3d54s1 = [18Аr] Зd54s1 (а не 3d44s2!), 29Cu = 1s22s22p63s23p6 3d104s1 = [18Ar] 3d104s1 (а не 3d94s2!).
Примеры заданий части А
1. Название, не относящееся к изотопам водорода, – это 1) дейтерий 2) оксоний 3) протий 4) тритий
2. Формула валентных подуровней атома металла – это 1) 4s24p4 2) 3d54s2 3) 2s22p1 4) 3s23p6
3. Число неспаренных электронов в основном состоянии атома железа равно 1) 2 2) 3 3) 4 4) 8
4. В возбужденном состоянии атома алюминия число неспаренных электронов равно 1) 1 2) 2 3) 3 4) 4
5. Электронная формула [Ar]3d94s0 отвечает катиону 1) Ti2+ 2) Cu2+ 3) Cr2+ 4) Zn2+
6. Электронная формула аниона Э2‑ [Ne] 3s23p6 отвечает элементу 1) аргон 2) хлор 3) сера 4) фосфор
7. Суммарное число электронов в катионе Mg2+ и анионе F‑ равно 1) 9 2) 10 3) 20 4) 21
|
||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 235; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.23.110 (0.008 с.) |