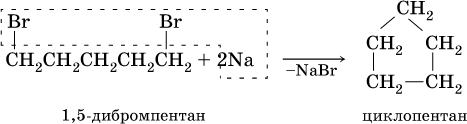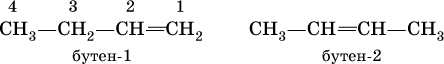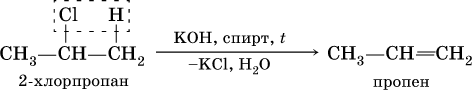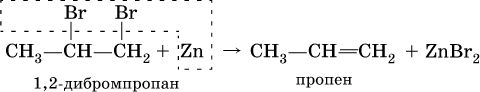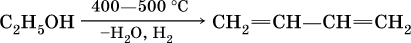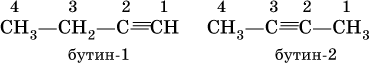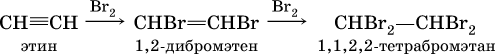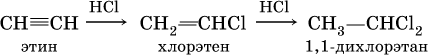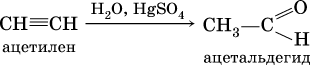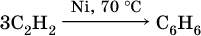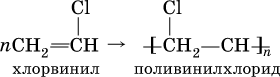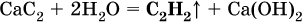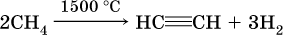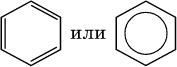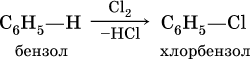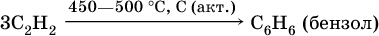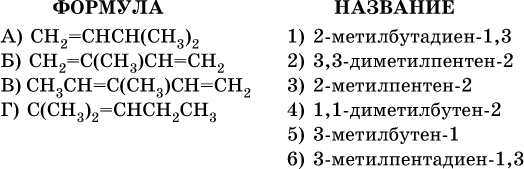Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Углеводороды. Гомология и изомерия. Химические свойства и способы полученияСодержание книги
Поиск на нашем сайте
Алканы. Циклоалканы
Алканы (парафины) – это соединения углерода с водородом, в молекулах которых атомы углерода соединены между собой одинарной связью (предельные углеводороды). Общая формула гомологического ряда алканов СnН2n+2. Радикал, получающийся при отрыве одного атома водорода от молекулы предельного углеводорода, называется алкилож, общая формула алкилов СnН2n+1. Формулы и названия первых шести алканов (С1–С6) и отвечающих им радикалов:
Для радикала С5Н11 использование названия амил не рекомендуется. Для составления названий алканов с разветвленной цепью, например
выбирают самую длинную углеродную цепь (в примере – 5 атомов) и получают основу названия (5 – пентан). Нумеруют цепь (от 1 до 5) так, чтобы заместители (–СН3) получили наименьшие номера (2 и 3). В названии арабскими цифрами указывают положение заместителей, а приставками ди – 2, три – 3, тетра – 4 и т. д. – число одинаковых заместителей. Таким образом, в нашем примере алкан должен быть назван 2,3‑диметилпентан. При наличии разных заместителей их названия расставляют по алфавиту, т. е., например, сначала метил, а затем этил. Для некоторых разветвленных предельных углеводородов используются, наравне с систематическими, традиционные названия, например, для алканов состава С4Н10 и С5Н12 с формулами:
Такие же названия используются для разветвленных радикалов:
При обычных условиях первые алканы – метан, этан, пропан и бутан (С1–С4) – представляют собой газы без цвета и запаха, малорастворимые в воде. Последующие гомологи (С5–C15) – жидкости (при 20 °C), высшие гомологи (C16 и выше) – твердые вещества. В алканах атомные орбитали углерода имеют sр3‑гибридизацию; четыре электронных облака атома углерода направлены в вершины тетраэдра под углами 109,5°. Ковалентные связи, образуемые каждым атомом углерода, в алканах малополярны. Поэтому алканы – сравнительно инертные вещества, вступают только в реакции замещения, протекающие с симметричным (радикальным) разрывом связей С – Н. Эти реакции обычно идут в жестких условиях (высокая температура, освещение). В результате становится возможным замещение водорода на галоген (CI, Br) и нитрогруппу (NO2), например, при обработке метана хлором:
Вторая и последующие стадии реакции протекают легче, чем первая, из‑за смещения электронной плотности к атому хлора:
и увеличения подвижности остающихся атомов водорода. Названия продуктов: СН3Cl – хлорметан, СН2Cl2 – дихлорметан, СНCl3 – трихлорметан (хлороформ), СCl4 – тетрахлорметан (тетрахлорид углерода). В тех алканах, где кроме первичных есть также вторичные и третичные атомы углерода, замещение обычно протекает с образованием смеси однозамещенных продуктов (т. е. в каждой молекуле замещается один атом водорода), например:
Циклоалканы – предельные углеводороды циклического строения, общая формула гомологического ряда СnH2n (п 3), формула совпадает с таковой для алкенов. Важнейшие циклоалканы:
При комнатной температуре С5Н10 и С6Н12 – бесцветные жидкости, малорастворимые в воде. Химические свойства циклоалканов подобны свойствам алканов, например:
Получение: источниками алканов и циклоалканов в промышленности служат нефть, природный газ, каменный уголь. В лаборатории применяют такие способы синтеза алканов: 1) реакция Вюрца – действие натрия на галогенпроизводные углеводородов:
2) каталитическое гидрирование этиленовых углеводородов (катализаторы Pt, Pd, Ni):
3) сплавление солей карбоновых кислот с гидроксидом натрия:
Циклоалканы синтезируют из дигалогенпроизводных алканов:
Алканы широко используются как исходное сырье в химической промышленности, моторное топливо (бензин, керосин и др.); циклоалканы применяются в органическом синтезе. При горении метана выделяется много теплоты:
Поэтому его (в виде природного газа) применяют в качестве топлива в быту и в промышленности.
Алкены. Алкадиены
Алкены (олефины) – это углеводороды, в молекулах которых содержатся атомы углерода, соединенные между собой двойной связью (непредельные углеводороды ряда этилена). Простейший представитель – этилен С2Н4, общая формула гомологического ряда этиленовых углеводородов СnН2n (при п ≥ 2). Систематические названия олефинов производятся от корней названий алканов с заменой суффикса – ан → – ен:
Сохраняются также традиционные названия с заменой суффикса – ан на – илен: С2Н4 – этилен, С3Н6 – пропилен, С4Н8 – бутилен; использование названия амилен для алкена С5Н10 не рекомендуется. Положение двойной связи С=С в изомерах строения (начиная с алкена С4) указывается цифрой после названия:
Радикал этилена – этенил СН2=СН – обычно называют винил, пропена – пропенил СН2=СН – СН2 – именуют аллил. Другой вид изомерии в непредельных углеводородах, помимо структурной изомерии, осуществляется потому, что атомы углерода, образующие двойную связь, находятся в sр2‑гибридном состоянии; σ‑составляющая двойной связи С=С и σ‑связи С – Н лежат в одной плоскости под углом 120° друг к другу, а π‑составляющая двойной связи С=С представляет собой электронное облако, вытянутое в направлении, перпендикулярном плоскости о‑связей. Следствием такого строения алкенов является возможность геометрической изомерии (или цис‑транс‑изомерии) в зависимости от положения заместителей (атомов или радикалов):
(цис – от лат. «рядом, по одну сторону», транс – от лат. «напротив, по разные стороны»). Алкены С2–С4 при комнатной температуре – бесцветные газы со слабым запахом нефти, малорастворимые в воде; алкены С5–C18 – жидкости, алкены C19 и выше – твердые вещества. Важнейшие химические свойства алкенов определяются тем, что в силу меньшей прочности π‑связи (по сравнению с σ‑связью) она легко разрывается, в результате чего протекают реакции присоединения и образуются насыщенные органические соединения. Как правило, такие реакции идут в мягких условиях, часто на холоду и в растворителях, например воде, тетрахлорметане СCl4 и др.:
Аналогично протекает взаимодействие алкенов с бромоводородом:
Присоединение галогеноводородов к несимметричным алкенам теоретически может привести к двум продуктам:
Согласно правилу Марковникова, присоединение галогеноводородов к несимметричным алкенам протекает так, что водород направляется к атому углерода, который уже содержит большее число атомов водорода. В приведенной выше реакции продуктом будет 2‑иодпропан СН3СН(I)СН3. По правилу Марковникова протекает и реакция гидратации, т. е. реакция присоединения воды в присутствии серной кислоты. Она происходит в две стадии: а) вначале образуется алкилсерная кислота, т. е. H2SO4 присоединяется к алкену:
б) затем происходит ее необратимый гидролиз:
Алкены обесцвечивают раствор перманганата калия на холоду в нейтральной среде, при этом образуются гликоли (двухатомные спирты):
Алкены способны вступать в реакции полимеризации:
Качественные реакции на алкены – обесцвечивание бромной воды и раствора КMnO4 (уравнения реакций см. выше). Алкадиены – непредельные углеводороды, в молекулах которых содержатся две связи С=С. Общая формула алкадиенов СnН2n‑2 (n ≥ 3), формула совпадает с таковой для алкинов. Примеры:
Большое практическое значение имеют сопряженные диены, в молекулах которых связи С=С разделены одинарной связью С – С:
Дивинил и изопрен – традиционные названия. Дивинил – бесцветный, легко сжижающийся (при ‑4,5 °C) газ, изопрен – низкокипящая (34,1 °C) жидкость. Алкадиены вступают в те же реакции присоединения, что и алкены. Сопряженные диены имеют особые свойства, в частности, в реакциях присоединения; они образуют продукты 1,4‑присоединения с одной двойной связью посредине:
(далее возможно образование 1, 2, 3, 4‑тетрабромбутана). Алкадиены способны полимеризоваться с образованием каучуков:
Полиметилбутадиеновый каучук – это полимер, существующий в природе (натуральный каучук), а полибутадиеновый каучук получен искусственно (С. В. Лебедев, 1932 г.) и называется синтетическим каучуком. Получение: для алкенов в промышленности используют метод каталитического дегидрирования алканов:
В лаборатории алкены получают: 1) дегидратацией спиртов (отщепление воды от спиртов):
2) дегидрогалогенированиеж – отщеплением галогеноводорода от моногалогенопроизводного под действием спиртового раствора щелочи:
3) дегалогенированиеж – отщеплением галогенов от дигалогенопроизводных, в которых атомы галогена находятся у соседних атомов углерода:
Промышленное получение дивинила: 1) дегидрирование бутана:
2) способ Лебедева – одновременное отщепление воды и водорода от этанола на катализаторе (ZnO/Al2O3):
Алкены используются для органического синтеза, производства пластмасс, искусственного моторного топлива, диеновые углеводороды – исходное сырье в промышленном синтезе каучуков.
Алкины
Алкины – углеводороды с тройной связью C≡C в молекулах (непредельные углеводороды ряда ацетилена). Простейший представитель этого ряда – ацетилен С2Н2, общая формула алкинов CnH2n‑2 (при n ≥ 2). Названия простейших алкинов: С2Н2 – этин (традиционно: ацетилен) С3Н4 – пропин (метилацетилен) С4Н6 – бутин Изомеры бутина:
Ацетилен, пропин и бутин‑1 – бесцветные газы при комнатной температуре, бутин‑2 – легкокипящая жидкость, обладает легким «эфирным» запахом. В алкинах атомные орбитали углерода у тройной связи имеют sp‑ гибридизацию (линейное строение). Наличие двух π‑связей обусловливает их химические свойства, в частности высокую способность к реакциям ступенчатого присоединения водорода, хлора, брома, галогеноводородов, воды: а)
б)
в)
(присоединение НCl к хлорэтену происходит по правилу Марковникова; хлорэтен традиционно называют хлорвинилом или винилхлоридом); г) реакция Кучерова (гидратация на катализаторе)
При циклизации ацетилена образуется бензол:
Упомянутый выше хлорвинил способен полимеризоваться:
Поливинилхлорид (ПВХ) – полимер, основа пластмассы, волокон и пленок, применяется в производстве труб, искусственной кожи, электроизоляции, пеноматериалов. Качественные реакции: 1) на алкины любого строения – обесцвечивание раствора КMnO4, чаще всего происходит разрыв углеродной цепи по месту тройной связи (ср. с алкенами); 2) на алкины с концевой тройной связью – замещение концевого атома водорода на медь (I) с образованием ярко‑красного осадка:
Получение: в промышленности ацетилен ранее получали гидролизом дикарбида (ацетиленида) кальция:
(неприятный «карбидный» запах газа обусловлен примесями, главным образом фосфином РН3). Современный способ – пиролиз (термическое разложение) метана:
В лаборатории для получения ацетилена и его гомологов используют взаимодействие дигалогенопроизводных алканов со щелочами в спиртовом растворе при нагревании:
(обязательное условие – атомы галогенов должны находиться при соседних атомах углерода). Эта реакция может проходить в одну стадию (как показано выше), но чаще – в две стадии: а)
б)
Алкины, особенно ацетилен, используются как исходное сырье в химической промышленности для многих органических синтезов. Кроме того, ацетилен благодаря высокой теплотворной способности сгорания:
применяется для автогенной сварки и резки металлов.
Арены
Арены – это непредельные углеводороды, которые можно рассматривать как производные простейшего из них – бензола С6Н6. Общая формула углеводородов гомологического ряда бензола СnН2n‑6 (при n ≥ 6). В молекуле бензола все атомы углерода находятся в sр2‑гибридизации, каждый атом углерода соединен в одной плоскости σ‑связями с двумя другими атомами углерода и одним атомом водорода. У атома углерода остается еще облако четвертого валентного электрона, расположенное перпендикулярно плоскости. Эти облака участвуют в образовании π‑связи, причем в молекуле образуются не три отдельные π‑связи (как думали раньше, см. формулу Кекуле, 1865 г.), а единая шестицентровая (С6) π‑связь (все атомы равноценны):
Формула Кекуле часто применяется в тех случаях, когда необходимо более наглядно представить протекание реакции с участием бензольного кольца С6; его изображение:
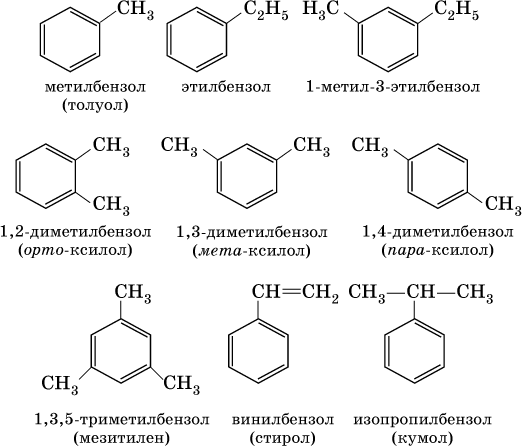
В обеих формулах атомы С кольца и не участвующие в реакции атомы Н опускаются (для краткости). Некоторые простейшие гомологи бензола:
Радикал бензола С6Н5 называется фенил, радикал толуола С6Н5СН2 – бензил. Бензол и его ближайшие гомологи – жидкости без цвета, но с характерным запахом, имеют широкий интервал жидкого состояния. Практически не растворяются в воде, но хорошо смешиваются между собой и с другими органическими растворителями. Пар бензола сильно ядовит. Несмотря на формальную непредельность, бензол отличается высокой устойчивостью к нагреванию и окислению (в гомологах бензола окисляется только боковая цепь). Характерными для бензола являются реакции замещения: а) нитрование в присутствии концентрированной серной кислоты на холоду:
б) галогенирование в присутствии галогенидов железа (III):
в) алкилирование в присутствии хлорида алюминия:
Особый характер ненасыщенности бензола и его гомологов иллюстрируется этими химическими свойствами и называется «ароматическим» характером. В производных бензола атом или группа, заместившие водород кольца, и само бензольное кольцо влияют друг на друга. По характеру влияния различают: 1) заместители I рода – CI, Br, I, СН3, СnН2n+1, ОН и NH2. Они облегчают реакции дальнейшего замещения и направляют второй заместитель по отношению к себе в орто‑ (о‑, или 2‑) положение и в пара‑ (п ‑, или 4‑) положение [для запоминания: о рто – о коло, п ара – п ротив], например:
2) заместители II рода – NO2, С(Н)O, СООН и CN. Они затрудняют реакции дальнейшего замещения и направляют второй заместитель в мета‑ (м ‑, или 3‑) положение, например:
Очевидно, что существуют два орто‑ положения рядом с первым заместителем X, два мета ‑положения, отделенные от первого заместителя одним углеродом кольца, и лишь одно пара ‑положение через два атома углерода бензольного кольца:
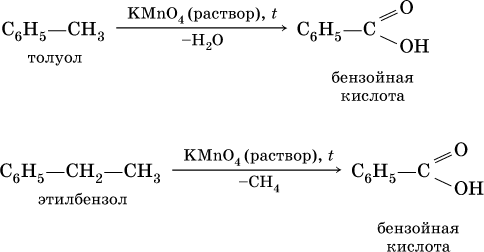
Ранее уже отмечалось, что бензол стоек к окислению даже при действии сильных окислителей. Гомологи бензола с одним боковым радикалом вступают в реакции окисления только за счет радикала; при этом, какова бы ни была его длина, отщепляется вся цепь, кроме ближайшего к кольцу атома углерода (он создает карбоксильную группу):
В жестких условиях бензол вступает в реакции присоединения:
Стирол C6H5–CH=CH2, как этилен, легко полимеризуется:
Полистирол – термопластичная пластмасса (термопласт), прозрачный материал, размягчающийся при температуре выше 80 °C. Используется для изготовления изоляции электропроводов, посуды разового употребления, упаковочной массы (пенопласт). Получение аренов – ароматизация алифатических и алициклических углеводородов, содержащихся в нефтяных или буроугольных бензиновых фракциях: 1) дегидрирование:
2) дегидроциклизация:
3) тримеризация ацетилена (устаревший способ):
Бензол и его гомологи используются в качестве малополярных растворителей (для каучука, лаковых смол, полимеров), сырье в органическом синтезе.
Примеры заданий частей А, В
1–6. Углеводороды с групповым названием 1. алканы 2. алкадиены 3. циклоалканы 4. алкины 5. алкены 6. арены имеют общую формулу 1) С nН2n‑6 2) Сn Н2n‑6 3) Сn Н2n+2 4) Сn Н2n‑2
7. Длина связи углерод – углерод наибольшая в молекуле 1) С 2Н2 2) С 2Н4 3) С 6Н6 4) С 2Н6
8. При гидрировании ацетилена могут образовываться 1) пропилен 2) этилен 3) бензол 4) этан
9. При взаимодействии 2‑бромпропана с натрием образуется 1) 2,2‑диметилбутан 2) изобутан 3) гексан 4) 2‑метилпентан
10. В реакции З‑метилпентана ‑1 с хлороводородом получают 1) З‑метил‑З‑хлорпентан 2) 3‑метил ‑1,2‑дихлорпентан 3) З‑метил‑2‑хлорпентан 4) З‑метил ‑1 ‑хлорпентан
11. При действии спиртовым раствором щелочи на 2‑хлорпропан образуется 1) бутан 2) пропан 3) бутен 4) пропен
12. Соединение 1,2‑дихлорпропан – это продукт хлорирования 1) пропана 2) пропена 3) пропина 4) пропадиена
13. При полимеризации ароматического углеводорода стирол образуется продукт с формулой 1) [ – С6Н4–СН(СН3) – ]n 2) [ – CH2–С6Н3(СН3) – ]n 3) [ – CH2–СН(С6Н5) – ]n 4) [ – СН2–С6Н4–СН2–]n
14. При нитрировании пропилбензола проходит замещение атомов H в положениях 1) 2,3 радикала фенил 2) 2,4,6 радикала фенил 3) 2,3 радикала пропил 4) 1,2,3 радикала пропил
15. Способы получения бензола – это 1) дегидрирование циклогексана 2) дегидрирование и циклизация гексана 3) тримеризация ацетилена 4) действие Na на 1,6‑ цикло ‑С6Н10Cl2
16–19. Указанные органические соединения – это 16. цис‑ и транс ‑1,2‑дихлорэтен 17. пентен‑2 и циклопентан 18. 1,2‑диметилэтен и бутен‑3 19. 1,2‑дибромпропан и 2,3‑дибромбутан 1) гомологи 2) структурные изомеры 3) пространственные изомеры 4) одно и то же вещество
20. В ряду превращений
продукты А, Б, В – это соответственно 1) толуол 2) хлорбензол 3) ацетилен 4) метан
21. Углеводород, который обесцвечивает бромную воду, легко полимеризуется, присоединяет водород и при взаимодействии с бромоводородом образует бромэтан, – это 1) этилен 2) ацетилен 3) этан 4) пропилен
22. С помощью бромной воды можно различить 1) пропан и этан 2) пропин и этин 3) ацетилен и дивинил 4) пропин и пропан
23. Бензол и стирол можно распознать 1) раствором NaOH 2) нитрующей смесью 3) раствором AgNO3 4) раствором КMnO4
24. Установите соответствие между формулой углеводорода и его названием.
25. Процесс, не относящийся к переработке нефти, – это 1) перегонка 2) крекинг 3) риформинг 4) коксование
26. При крекинге нефти из октана образуются 1) бутан 2) этан 3) этилен 4) бутилен
27. Продукт полимеризации этилена (полиэтилен) отвечает формуле 1) (СН2)n(–СН=СН–)n 3) (–СН2–СН2–)n 4) (СН2=СН2)n
28. Для промышленного синтеза бутадиенового каучука используют мономер 1) CH2=CHCH=CH2 2) CH2=CH–C≡CH 3) CH3CH=C=CH2 4) CH2=C(CH3)C≡CH
29. Мономер пластмассы тефлон (политетрафторэтилен) синтезируют по реакции 1) замещения СCl2 + F2 →… 2) пиролиза CHClF2 3) окисления CCl2F2 4) фторирования С2Н6
|
||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 248; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.013 с.) |