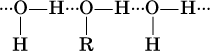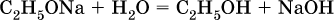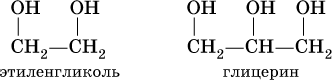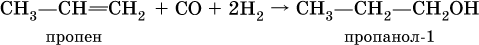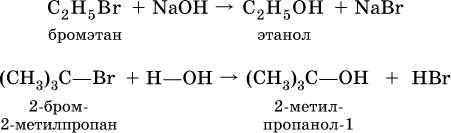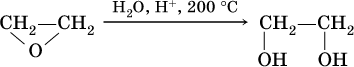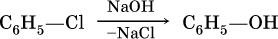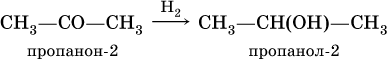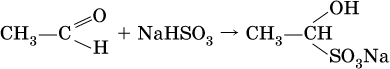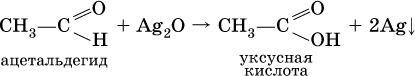Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Спирты. Простые эфиры. ФенолыСодержание книги
Поиск на нашем сайте
Спирты – производные углеводородов, содержащие функциональную группу ОН (гидроксил). Спирты, в которых имеется одна группа ОН, называются одноатомными, а спирты с несколькими группами ОН – многоатомными. Названия некоторых распространенных спиртов приведены в табл. 9. По строению различают спирты первичные, вторичные и третичные, в зависимости от того, при каком атоме углерода (первичном, вторичном или третичном) находится группа ОН:
Одноатомные спирты – бесцветные жидкости (до Cl2Н25ОН), растворимые в воде. Простейший спирт – метанол СН3ОН чрезвычайно ядовит. С увеличением молярной массы температура кипения спиртов повышается.
Молекулы жидких одноатомных спиртов ROH ассоциированы за счет водородных связей:
(эти связи аналогичны водородным связям в чистой воде). При растворении в воде молекулы ROH образуют водородные связи с молекулами воды:
Водные растворы спиртов ROH имеют нейтральную среду; другими словами, спирты практически не диссоциируют в водном растворе ни по кислотному, ни по основному типу. Химические свойства одноатомных спиртов обусловлены присутствием в них функциональной группы ОН. Водород группы ОН в спиртах может замещаться на металл:
Этанолаты и производные других спиртов (алкоголяты) легко гидролизуются:
Группу ОН в спиртах можно заместить на Cl или Br:
При действии на спирты водоотнимающих средств, например концентрированной H2SO4, происходит межмолекулярная дегидратация:
Продукт реакции – диэтиловый эфир (С2Н5)2O – относится к классу простых эфиров. В более жестких условиях дегидратация становится внутримолекулярной и образуется соответствующий алкен:
Многоатомные спирты рассмотрим на примере простейших представителей двух– и трехатомных спиртов:
При комнатной температуре они – бесцветные вязкие жидкости с температурами кипения 198 и 290 °C соответственно, неограниченно смешиваются с водой. Этиленгликоль ядовит. Химические свойства многоатомных спиртов подобны свойствам спиртов ROH. Так, в этиленгликоле одну или две группы ОН можно заместить на галоген:
Кислотные свойства многоатомных спиртов проявляются в том, что (в отличие от одноатомных спиртов) водород группы ОН замещается на металл под действием не только металлов, но и гидроксидов металлов:
а)
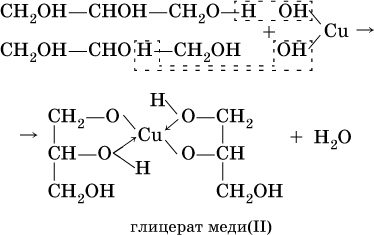
б)
(стрелками в формуле гликолята меди показано образование ковалентных связей медь – кислород по донорно‑акцепторному механизму). Аналогично реагирует с гидроксидом меди (II) глицерин:
Гликолят и глицерат меди (II), имеющие ярко‑синюю окраску, позволяют качественно обнаруживать многоатомные спирты. Получение одноатомных спиртов в промышленности – гидратация алкенов в присутствии катализаторов (H2SO4, Al2O3), причем присоединение воды к несимметричным алкенам происходит по правилу Марковникова:
(способ получения вторичного спирта), или присоединение к алкенам СО и Н2 в присутствии кобальтового катализатора (процесс называется гидрофоржилирование):
(способ получения первичного спирта). В лаборатории (а иногда и в промышленности) спирты получают взаимодействием галогенпроизводных углеводородов с водой или водным раствором щелочи при нагревании:
Этанол С2Н5ОН образуется также при спиртовом брожении сахаристых веществ, например глюкозы:
Этиленгликоль получают в двухстадийном процессе: а) окисление этилена:
б) гидратация этиленоксида:
Глицерин ранее получали омылением жиров (см. 20.3), современный трехстадийный способ – постепенное окисление пропена (приведена только схема процесса):
Спирты используют как сырье в органическом синтезе, в качестве растворителей (для лаков, красок и т. п.), а также в бумажной, полиграфической, парфюмерной, фармакологической и пищевой промышленности. Простые эфиры – класс органических соединений, содержащих мостиковый атом кислорода – О– между двумя углеводородными радикалами: R – О–R'. Самый известный и широко применяемый простой эфир – диэтиловый эфир С2Н5–О – С2Н5. Бесцветная, легкоподвижная жидкость с характерным («эфирным») запахом, в лабораторной практике его называют просто эфиром. Почти не смешивается с водой, tкип = 34,51 °C. Пар эфира воспламеняется на воздухе. Получают диэтиловый эфир при межмолекулярной дегидратации этанола (см. выше), основное применение – растворитель.
Фенолы – это спирты, в которых группа ОН непосредственно связана с бензольным кольцом. Простейший представитель – фенол С6Н5–ОН. Белые (розовеющие на свету) кристаллы с сильным запахом, tпл = 41 °C. Вызывает ожоги кожи, ядовит. Для фенола характерна значительно большая кислотность, чем для ациклических спиртов. Вследствие этого фенол в водном растворе легко реагирует с гидроксидом натрия:
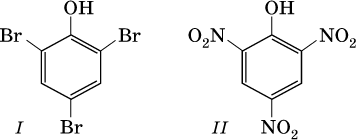
Отсюда тривиальное название фенола – карболовая кислота. Отметим, что группа ОН в феноле никогда не замещается ни на какие другие группы или атомы, но делает более подвижными атомы водорода бензольного кольца. Так, фенол легко реагирует с бромом в воде и азотной кислотой, образуя соответственно 2,4,6‑трибромфенол (I) и 2,4,6‑тринитрофенол (II, традиционное название – пикриновая кислота):
Фенол в промышленности получают нагреванием хлорбензола с раствором гидроксида натрия под давлением при 250 °C:
Фенол применяют в качестве сырья для производства пластмасс и смол, полупродуктов для лакокрасочной и фармацевтической промышленности, как дезинфицирующее средство.
Альдегиды и кетоны
Альдегиды и кетоны – это производные углеводородов, содержащие функциональную карбонильную группу СО. В альдегидах карбонильная группа связана с атомом водорода и одним радикалом, а в кетонах с двумя радикалами. Общие формулы:
Названия распространенных веществ этих классов приведены в табл. 10. Метаналь – бесцветный газ с резким удушающим запахом, хорошо растворим в воде (традиционное название 40 %‑ного раствора– формалин), ядовит. Последующие члены гомологического ряда альдегидов – жидкости и твердые вещества. Простейший кетон – пропанон‑2, более известный под названием ацетон, при комнатной температуре – бесцветная жидкость с фруктовым запахом, tкип = 56,24 °C. Хорошо смешивается с водой. Химические свойства альдегидов и кетонов обусловлены присутствием в них карбонильной группы СО; они легко вступают в реакции присоединения, окисления и конденсации.
В результате присоединения водорода к альдегидам образуются первичные спирты:
При восстановлении водородом кетонов образуются вторичные спирты:
Реакция присоединения гидросульфита натрия используется для выделения и очистки альдегидов, так как продукт реакции малорастворим в воде:
(действием разбавленных кислот такие продукты превращаются в альдегиды). Окисление альдегидов проходит легко под действием кислорода воздуха (продукты – соответствующие карбоновые кислоты). Кетоны сравнительно устойчивы к окислению. Альдегиды способны участвовать в реакциях конденсации. Так, конденсация формальдегида с фенолом протекает в две стадии. Вначале образуется промежуточный продукт, являющийся фенолом и спиртом одновременно:
Затем промежуточный продукт реагирует с другой молекулой фенола, и в результате получается продукт поликонденсации – фенолформальдегидная смола:
Качественная реакция на альдегидную группу – реакция «серебряного зеркала», т. е. окисление группы С(Н)O с помощью оксида серебра (I) в присутствии гидрата аммиака:
Аналогично протекает реакция с Cu(ОН)2, при нагревании появляется красный осадок оксида меди (I) Cu2O.
Получение: общий способ для альдегидов и кетонов – дегидрирование (окисление) спиртов. При дегидрировании первичных спиртов получают альдегиды, а при дегидрировании вторичных спиртов – кетоны. Обычно дегидрирование протекает при нагревании (300 °C) над мелкораздробленной медью:
При окислении первичных спиртов сильными окислителями (перманганат калия, дихромат калия в кислотной среде) процесс трудно остановить на стадии получения альдегидов; альдегиды легко окисляются до соответствующих кислот:
Более подходящим окислителем является оксид меди (II):
Ацетальдегид в промышленности получают по реакции Кучерова (см. 19.3). Наибольшее применение из альдегидов имеют метаналь и этаналь. Метаналь используют для производства пластмасс (фенопластов), взрывчатых веществ, лаков, красок, лекарств. Этаналь – важнейший полупродукт при синтезе уксусной кислоты и бутадиена (производство синтетического каучука). Простейший кетон – ацетон используют в качестве растворителя различных лаков, ацетатов целлюлозы, в производстве кинофотопленки и взрывчатых веществ.
|
|||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 139; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.1.23 (0.007 с.) |