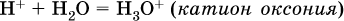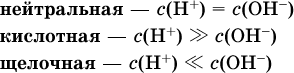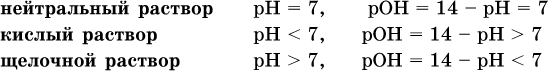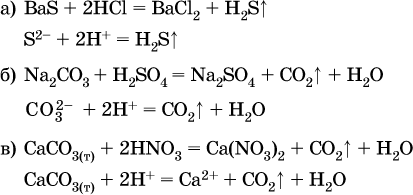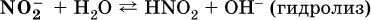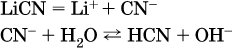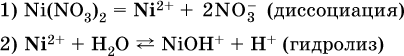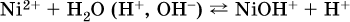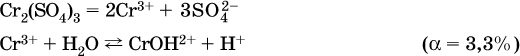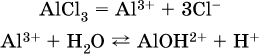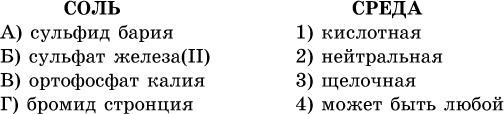Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диссоциация воды. Среда растворовСодержание книги
Поиск на нашем сайте
Сама вода – это очень слабый электролит:
Концентрации катиона Н+ и аниона ОН‑ в чистой воде весьма малы и составляют 1 10‑7 моль/л при 25 °C. Катион водорода Н+ представляет собой простейшее ядро – протон р+ (электронная оболочка катиона Н+ – пустая, 1s0). У свободного протона велики подвижность и проникающая способность, в окружении полярных молекул Н2O он не может оставаться свободным. Протон тут же присоединяется к молекуле воды:
В дальнейшем для простоты оставляется запись Н+ (но подразумевается Н3O+). В воде содержание ионов Н+ и ОН одинаково; в водных растворах кислот появляется избыток ионов Н+, в водных растворах щелочей – избыток ионов ОН (за счет диссоциации кислот и оснований). Типы среды водных растворов:
Содержание Н+ и ОН‑ в водных растворах обычно выражают через водородный показатель рН (читается пэ‑аш) и аналогичный ему гидроксильный показатель рОН:
Для воды при комнатной температуре имеем:
следовательно, в чистой воде:
Это равенство справедливо и для водных растворов:
Практическая шкала рН отвечает интервалу 1–13 (разбавленные растворы кислот и оснований):
В практически нейтральной среде с рН = 6–7 и рН = 7–8 концентрация Н+ и ОН‑ очень мала (1 10‑6 – 1 • 10‑7 моль/л) и почти равна концентрации этих ионов в чистой воде. Такие растворы кислот и оснований считаются предельно разбавленными (содержат очень мало вещества). Для практического установления типа среды водных растворов служат индикаторы – вещества, которые окрашивают в характерный цвет нейтральные, кислые и/или щелочные растворы. Распространенные в лаборатории индикаторы – это лакмус, метилоранж и фенолфталеин. Метилоранж (индикатор на кислотную среду) становится розовым в сильнокислом растворе (табл. 16), фенолфталеин (индикатор на щелочную среду) – малиновым в сильнощелочном растворе, а лакмус используется во всех средах.
Реакции ионного обмена
В разбавленных растворах электролитов (кислот, оснований, солей) химические реакции протекают обычно при участии ионов. При этом все элементы реагентов могут сохранять свои степени окисления (обменные реакции) или изменять их (окислительно‑восстановительные реакции). Примеры, приводимые далее, относятся к обменным реакциям (о протекании окислительно‑восстановительных реакций см. разд. 14).
В соответствии с правилом Бертолле, ионные реакции протекают практически необратимо, если образуются твердые малорастворимые вещества (они выпадают в осадок), легколетучие вещества (они выделяются в виде газов) или растворимые вещества – слабые электролиты (в том числе и вода). Ионные реакции изображаются системой уравнений – молекулярным, полным и кратким ионным. Ниже полные ионные уравнения опущены (читателю предлагается составить их самому). При написании уравнений ионных реакций надо обязательно руководствоваться таблицей растворимости (см. табл. 8). Примеры реакций с выпадением осадков: а)
б)
в)
г)
Внимание! Указанные в таблице растворимости (см. табл. 15) малорастворимые («м») и практически нерастворимые («н») соли выпадают в осадок именно в том виде, как они представлены в таблице (СаF2↓, PbI2↓, Ag2SO4↓, AlPO4↓ и т. д.). В табл. 15 не указаны карбонаты – средние соли с анионом CO32‑. Следует иметь в виду, что: 1) К2СO3, (NH4)2CO3 и Na2CO3 растворимы в воде; 2) Ag2CO3, ВаСO3 и СаСO3 практически нерастворимы в воде и выпадают в осадок как таковые, например:
3) соли остальных катионов, такие как MgCO3, CuCO3, FeCO3, ZnCO3 и другие, хотя и нерастворимы в воде, но не осаждаются из водного раствора при проведении ионных реакций (т. е. их нельзя получить этим способом). Например, карбонат железа (II) FeCO3, полученный «сухим путем» или взятый в виде минерала сидерит, при внесении в воду осаждается без видимого взаимодействия. Однако при попытке его получения по обменной реакции в растворе между FeSO4 и К2СO3 выпадает осадок основной соли (приведен условный состав, на практике состав более сложный) и выделяется углекислый газ:
Аналогично FeCO3, сульфид хрома (III) Cr2S3 (нерастворимый в воде) не осаждается из раствора:
В табл. 15 не указаны также соли, которые разлагаются водой – сульфид алюминия Al2S3 (а также BeS) и ацетат хрома (III) Cr(СН3СОО)3:
Следовательно, эти соли также нельзя получить по обменной реакции в растворе:
(в последней реакции состав осадка более сложный; подробнее такие реакции изучают в высшей школе).
Примеры реакций с выделением газов:
Примеры реакций с образованием слабых электролитов:
Если реагенты и продукты обменной реакции не являются сильными электролитами, ионный вид уравнения отсутствует, например:
Гидролиз солей
Гидролиз соли – это взаимодействие ее ионов с водой, приводящее к появлению кислотной или щелочной среды, но не сопровождающееся образованием осадка или газа (ниже речь идет о средних солях). Процесс гидролиза протекает только с участием растворимых солей и состоит из двух этапов: 1) диссоциация соли в растворе – необратимая реакция (степень диссоциации α = 1, или 100 %); 2) собственно гидролиз, т. е. взаимодействие ионов соли с водой, – обратимая реакция (степень гидролиза α < 1, или 100 %). Уравнения 1‑го и 2‑го этапов – первый из них необратим, второй обратим – складывать нельзя! Отметим, что соли, образованные катионами щелочей и анионами сильных кислот, гидролизу не подвергаются, они лишь диссоциируют при растворении в воде. В растворах солей КCl, NaNO3, Na2SO4 и BaI2 среда нейтральная. В случае взаимодействия аниона растворенной соли с водой процесс называется гидролизом соли по аниону. 1)
2)
Диссоциация соли KNO2 протекает полностью, гидролиз аниона NO2 – в очень малой степени (для 0,1М раствора – на 0,0014 %), но этого оказывается достаточно, чтобы раствор стал щелочным (среди продуктов гидролиза присутствует ион ОН‑), в нем рН = 8,14. Гидролизу подвергаются анионы только слабых кислот (в данном примере – нитрит‑ион NO2‑, отвечающий слабой азотистой кислоте HNO2). Анион слабой кислоты притягивает к себе катион водорода, имеющийся в воде, и образует молекулу этой кислоты, а гидроксид‑ион остается свободным:
Список гидролизующихся анионов:
Примеры: а)
б)
в)
г)
д)
Обратите внимание, что в примерах (в – д) нельзя увеличивать число молекул воды и вместо гидроанионов (HCO3‑, HPO42‑, HS‑) писать формулы соответствующих кислот (Н2СO3, Н3РO4, H2S). Гидролиз – обратимая реакция, и протекать «до конца» (до образования кислоты НnА) он не может. Если бы такая неустойчивая кислота, как Н2СO3, образовалась в растворе своей соли Na2CO3, то наблюдалось бы выделение из раствора газа СO2 (Н2СO3 = СO2↓ + Н2O). Однако при растворении соды в воде образуется прозрачный раствор без газовыделения, что является свидетельством неполноты протекания гидролиза аниона СО| с появлением в растворе только гидроаниона угольной кислоты HCOg. Степень гидролиза соли по аниону зависит от степени диссоциации продукта гидролиза – кислоты (HNO2, НClO, HCN) или ее гидроаниона (HCO3‑, HPO42‑, HS‑); чем слабее кислота, тем выше степень гидролиза. Например, ионы СО32‑, РО43‑ и S2‑ подвергаются гидролизу в большей степени (в 0,1 М растворах ~ 5 %, 37 % и 58 % соответственно), чем ион NO2, так как диссоциация Н2СO3 и H2S по 2‑й ступени, а Н3РO4 по 3‑й ступени (т. е. диссоциация ионов HCO3‑, HS‑ и HPO42‑) протекает значительно меньше, чем диссоциация кислоты HNO2. Поэтому растворы, например, Na2CO3, К3РO4 и BaS будут сильнощелочными (в чем легко убедиться по мылкости раствора соды на ощупь). Избыток ионов ОН в растворе легко обнаружить индикатором или измерить специальными приборами (рН‑метрами).
Если в концентрированный раствор сильно гидролизующейся по аниону соли, например Na2CO3, внести алюминий, то последний (вследствие амфотерности) прореагирует с ОН‑
и будет наблюдаться выделение водорода. Это – дополнительное доказательство протекания гидролиза иона СО32‑ (ведь в раствор Na2CO3 мы не добавляли щелочь NaOH!). В случае взаимодействия катиона растворенной соли с водой процесс называется гидролизом соли по катиону:
Диссоциация соли Ni(NO3)2 протекает полностью, гидролиз катиона Ni2+ – в очень малой степени (для 0,1 М раствора – на 0,001 %), но этого оказывается достаточно, чтобы раствор стал кислым (среди продуктов гидролиза присутствует ион Н+), в нем рН = 5,96. Гидролизу подвергаются катионы только малорастворимых основных и амфотерных гидроксидов и катион аммония NH4+. Гидролизуемый катион притягивает к себе анион ОН‑, имеющийся в воде, и образует соответствующий гидроксокатион, а катион Н+ остается свободным:
Катион аммония в этом случае образует слабое основание – гидрат аммиака:
Список гидролизующихся катионов:
Примеры: а)
б)
в)
г)
Обратите внимание, что в примерах (а – в) нельзя увеличивать число молекул воды и вместо гидроксокатионов FeOH2+, CrOH2+, ZnOH+ писать формулы гидроксидов FeO(OH), Cr(OH)3, Zn(OH)2. Если бы гидроксиды образовались, то из растворов солей FeCl3, Cr2(SO4)3 и ZnBr2 выпали бы осадки, чего не наблюдается (эти соли образуют прозрачные растворы). Избыток катионов Н+ легко обнаружить индикатором или измерить специальными приборами. Можно также проделать такой опыт. В концентрированный раствор сильно гидролизующейся по катиону соли, например AlCl3:
вносится магний или цинк. Последние прореагируют с Н+:
и будет наблюдаться выделение водорода. Этот опыт – дополнительное свидетельство протекания гидролиза катиона Al3+ (ведь в раствор AlCl3 мы не добавляли кислоту!).
Примеры заданий частей А, В
1. Сильный электролит – это 1) С6Н5ОН 2) СН3СООН 3) С2Н4(ОН)2 4) К(НСОО)
2. Слабый электролит – это 1) иодоводород 2) фтороводород 3) сульфат аммония 4) гидроксид бария
3. В водном растворе их каждых 100 молекул образуется 100 катионов водорода для кислоты 1) угольной 2) азотистой 3) азотной 4) серной
4–7. В уравнении диссоциации слабой кислоты по всем возможным ступеням 4. Н3РO4 5. H2SeO3 6. H4SiO4 7. HF сумма коэффициентов равна 1) 3 2) 6 3) 9 4) 12
8–11. Для уравнений диссоциации в растворе двух щелочей набора
8. NaOH, Ва(ОН)2 9. Sr(OH)2, Са(ОН)2 10. КОН, LiOH 11. CsOH, Са(ОН)2 общая сумма коэффициентов составляет 1) 5 2) 6 3) 7 4) 8
12. В известковой воде содержится набор частиц 1) СаОН+, Са2+, ОН‑ 2) Са2+, ОН‑, Н2O 3) Са2+, Н2O, О2‑ 4) СаОН+, О2‑, Н+
13–16. При диссоциации одной формульной единицы соли 13. NH4NO3 14. К2Cr2O7 15. Al(NO3)3 16. Cr2(SO4)3 число образующихся ионов равно 1) 2 2) 3 3) 4 4) 5
17. Наибольшее количество иона РО4‑3 можно обнаружить в растворе, содержащем 0,1 моль 1) NaH2PO4 2) NaHPO4 3) Н3РO4 4) Na3PO4
18. Реакция с выпадением осадка – это 1) MgSO4 + H2SO4 →… 2) AgF + HNO3 →… 3) Na2HPO4 + NaOH →… 4) Na2SiO3 + HCl →…
19. Реакция с выделением газа – это 1) NaOH + СН3СООН →… 2) FeSO4 + КОН →… 3) NaHCO3 + HBr →… 4) Pl(NO3)2 + Na2S →…
20. Краткое ионное уравнение ОН‑ + Н+ = Н2O отвечает взаимодействию 1) Fe(OH)2 + НCl →… 2) NaOH + HNO2 →… 3) NaOH + HNO3 →… 4) Ва(ОН)2 + KHSO4 →…
21. В ионном уравнении реакции SO2 + 2OН = SO32‑ + Н2O ион ОН‑ может отвечать реагенту 1) Cu(ОН)2 2) Н2O 3) LiOH 4) С6Н5ОН
22–23. Ионное уравнение 22. ЗСа2+ + 2РO43‑ = Са3(РO4)2↓ 23. Са2+ + НРO42‑ = СаНРO4↓ соответствует реакции между 1) Са(ОН)2 и К3РO4 2) СаCl2 и NaH2PO4 3) Са(ОН)2 и Н3РО4 4) СаCl и К2НРO4
24–27. В молекулярном уравнении реакции 24. Na3PO4 + AgNO3 →… 25. Na2S + Cu(NO3)2 →… 26. Ca(HSO3)2 [p‑p, t] →… 27. K2SO3 + 2HBr →… сумма коэффициентов равна 1) 4 2) 5 3) 7 4) 8
28–29. Для реакции полной нейтрализации 28. Fe(OH)2 + HI →… 29. Ва(ОН)2 + H2S →… сумма коэффициентов в полном ионном уравнении составляет 1) 6 2) 8 3) 10 4) 12
30–33. В кратком ионном уравнении реакции 30. NaF + AlCl3 →… 31. К2СO3 + Sr(NO3)2 →… 32. Mgl2 + К3РO4 →… 33. Na2S + H2SO4 →… сумма коэффициентов равна 1) 3 2) 4 3) 5 4) 6
34–36. В водном растворе соли 34. Са(ClO4)2 35. AgF 36. Fe2(SO4)3 образуется среда 1) кислотная 2) нейтральная 3) щелочная 4) любая
37. Концентрация гидроксид‑иона увеличивается после растворения в воде соли 1) CsNO3 2) SrCl2 3) NaCN 4) KHSO4
38. Нейтральная среда будет в конечном растворе после смешивания растворов исходных солей в наборах 1) ВаCl2, Fe(NO3)3 2) Na2CO3, SrS 3) BaS, ZnSO4 4) MgCl2, RbNO3
39. Установите соответствие между солью и ее способностью к гидролизу.
40. Установите соответствие между солью и средой раствора.
41. Установите соответствие между солью и концентрацией катиона водорода после растворения соли в воде.
14. Окислительно‑восстановительные реакции. Электролиз
Окислители и восстановители
Окислительно‑восстановительные реакции протекают с одновременным повышением и понижением степеней окисления элементов и сопровождаются передачей электронов:
Повышение степени окисления элемента в ходе реакции, отвечающее потере электронов атомами этого элемента, называют окислением: S‑II – 6е‑ = SIV. В данном примере S‑II окисляется до SIV. Понижение степени окисления элемента в ходе реакции, отвечающее присоединению электронов атомами этого элемента, называется восстановлением: O0 + 2е‑ = О‑II. В данном примере О0 восстанавливается до O‑II. Вещество, частицы которого содержат окисляющиеся атомы, выполняет в реакции функцию восстановителя. В данном примере восстановитель – сероводород H2S.
Вещество, частицы которого содержат восстанавливающиеся атомы, выполняет в реакции функцию окислителя. В данном примере окислитель – молекулярный кислород O2. Вещества, являющиеся окислителями или восстановителями во многих реакциях, называются типичными (сильными). Многие вещества могут проявлять как окислительные, так и восстановительные свойства. К таким веществам принадлежат соединения, содержащие элементы в промежуточной (для них) степени окисления:
Окислительно‑восстановительные свойства веществ связаны с положением элементов в Периодической системе Д. И. Менделеева. Простые вещества – неметаллы обладают бóльшими окислительными свойствами, а металлы – бóльшими восстановительными свойствами (O2, Cl2 – окислители; Na, Ва, Al и Zn – восстановители). В каждой группе Периодической системы элемент с большим порядковым номером будет обладать и бóльшими восстановительными свойствами в своей группе, а элемент с меньшим порядковым номером – бóльшими окислительными свойствами. Так, кальций Са – более сильный восстановитель, чем магний Mg, молекулярный хлор Cl2 – более сильный окислитель, чем иод I2. Соединения, содержащие атомы элементов в низкой степени окисления, будут восстановителями за счет этих атомов, например: NH3 – восстановитель за счет азота (‑III), H2S – за счет серы (‑II), KI – за счет иода (‑I) и т. д. Соединения, включающие атомы элементов в высокой степени окисления, будут окислителями, например: HNO3 – окислитель за счет азота (+V), КMnO4 – за счет марганца (+VII), К2Cr2O7 – за счет хрома (+VI) и т. д.
|
|||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 128; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.227.187 (0.011 с.) |